乌梅总黄酮调控miR-145-3p 表达对MPP+诱导SH-SY5Y 细胞损伤的作用及其机制
文晓东, 王春玲, 蒋媛静, 周欣梅, 张 艺, 伍 媛
(1. 广西中医药大学附属瑞康医院脑病一区,广西 南宁 530011; 2. 广西中医药大学药学院药理教研室,广西 南宁 530200)
帕金森病(Parkinson’s disease,PD)是一种常见的慢性神经退行性疾病,由黑质多巴胺能神经元的进行性丢失引起,并产生运动症状和非运动症状[1]。研究[2]显示:线粒体功能障碍会影响多巴胺能神经元功能,干扰PD 相关通路的基因表达,导致细胞死亡,是PD 发病机制之一。线粒体自噬是细胞隔离并清除受损线粒体的主要方式,对细胞功能和生存维持至关重要[3]。研究[4]显示:特发性PD 患者的线粒体自噬减少,刺激线粒体自噬以维持线粒体健康是延缓PD 患者神经退行性过程的有效方法。
微小RNA (microRNA,miRNA) 作为神经退行性疾病的调节因子,参与调控多种神经性疾病的发生发展。其中,miR-145-3p 可靶向多发性骨髓瘤细胞中的组蛋白去乙酰化酶4 触发自噬过程,在唾液中还可作为PD 的辅助生物标记[5-6]。目前采用中草药辅助治疗的PD 患者占全部患者的25.7%~76.0%[7]。中草药中的黄酮类成分可以保护细胞线粒体功能,避免结构损伤,保护PD 模型动物的神经功能[8]。 乌梅总黄酮(fructus mume total flavone,FMF) 是乌梅主要有效成分,本课题组前期研究[9-10]显示:FMF 可对多巴胺能毒素1-甲基-4- 苯基吡啶(dopaminergic toxin 1-methyl-4-phenylpyridinium,MPP+) 诱导的SH-SY5Y 细胞损伤发挥保护作用,并证实FMF 可通过影响线粒体呼吸链酶复合物的活性防治PD。但FMF 靶向线粒体对MPP+诱导的SH-SY5Y 细胞损伤发挥保护作用的具体机制尚未完全阐明。因此,本研究构建PD 细胞模型,探讨FMF 调控miR-145-3p 对MPP+诱导的SH-SY5Y 细胞损伤的保护作用,为深入研究PD 的发病机制和寻找新的治疗靶点提供参考。
1 材料与方法
1.1 细胞、主要试剂和仪器SH-SY5Y 人神经母细胞瘤购自中国科学院细胞库。FMF 纯度为95%(货号13057-72-2,西安赛奥生物科技公司),MPP+(货号N137206,上海阿拉丁试剂有限公司),CCK-8、RIPA(强)组织细胞快速裂解液和BCA 蛋白浓度测定试剂盒(货号CA1210、R0010和PC0020,北京索莱宝生物有限公司),Opti-MEM和胎牛血清(货号31985-062 和10270-106, 美国Gibco 公司),Lipofectamine®RNAiMAX (货号13778030, 美国Invitrogen 公司) Annexin Ⅴ-FITC/PI 凋亡检测试剂盒(货号556547,美国BD公司),聚偏二氟乙烯(polyvinylidene difluoride,PVDF) 和化学发光试剂(货号IPVH00010 和WBKLS0500,美国Millipore 公司),醋酸铀(西安鼎天化工公司),枸橼酸铅(货号GA10701,北京中镜科仪公司),兔抗Beclin-1、LC3-Ⅰ、LC3-Ⅱ和 GAPDH 单克隆抗体 ( 货号 PAB35215、PAB34124、 PAB30656 和 PAB36269, 武 汉Bioswamp 公司)。311 型CO2恒温培养箱(美国Thermo 公司),AMR-100 型酶标仪(杭州奥盛仪器有限公司),DMIL LED 型倒置荧光显微镜(德国Leica 公司),NovoCyte 型流式细胞仪(天津艾森生物有限公司),Tanon-5200 型全自动化学发光分析仪(上海天能公司),mini protean3 cell 型电泳槽(美国BIO-RAD 公司),HT7700 型透射电镜(日本日立公司)。
1.2 MPP+诱导SH-SY5Y 细胞损伤模型的构建调整SH-SY5Y 细胞悬液浓度,37 ℃、5%CO2环境下培养使细胞贴壁。将MPP+稀释为0、125、250、500、1 000 和2 000 μmol·L-1后处理细胞,继续培养12、24 和48 h。每孔加入10 μL CCK-8 溶液,培养4 h,采用酶标仪于波长450 nm 处检测吸光度(A)值。以A值代表SH-SY5Y 细胞增殖活性,A 值降低代表细胞增殖活性受损,SH-SY5Y细胞损伤模型构建成功。采用Graphpad Prism 9 软件计算MMP+干预SH-SY5Y 细胞12,24 和48 h 的半抑制浓度(50% inhibiting concentration,IC50),计算细胞存活率。细胞存活率=(测量孔A 值-空白孔A值)/(对照孔A值-空白孔A值)×100%。
1.3 FMF 最佳作用时间和干预浓度将正常培养的SH-SY5Y 细胞分别给予0、0.031 25、0.062 50、0.125 00、0.250 00、0.500 00 和1.000 00 g·L-1FMF 干预处理,分别干预12、24和48 h,CCK-8 法检测细胞增殖能力,以波长490 nm 处A 值变化情况确定FMF 最佳作用时间。 将正常培养的SH-SY5Y 细胞随机分为正常培养组、MPP+诱导组(500 μmol·L-1MPP+作用24 h) 和MPP++不同剂量FMF 组(500 μmol·L-1MPP+作用24 h+0.125 00、0.250 00、0.500 00 和1.000 00 g·L-1FMF 干预24 h)。采用CCK-8 法检测各组细胞增殖能力,与MPP+诱导组比较,以波长490 nm处A 值增加最明显的FMF 作用浓度为FMF 最佳干预浓度。
1.4 细胞分组和CCK-8 法检测各组细胞增殖能力根据miR-145-3p基因序列设计合成miR-145-3p引物,将目的片段与载体重组获得重组质粒,并将miR-145-3p 的mimics 及对应的NC 质粒转入MPP+诱导的PD 细胞模型中。将细胞分为对照组(未经处理)、模型组(500 μmol·L-1MPP+作用24 h)、MPP++mimics 组(转染miR-145-3p mimics)、MPP++NC 组(转染miR-145-3p NC)、MPP++FMF 组(0.25 g·L-1FMF 作用24 h)、MPP++mimics+FMF 组 ( 转染 miR-145-3p mimics 后0.25 g·L-1FMF 作用24 h) 和MPP++NC+FMF组(转染miR-145-3p NC 后0.25 g·L-1FMF 作用24 h)。除对照组外,其余各组均经500 μmol·L-1MPP+作用SH-SY5Y 细胞24 h 后再进行相应处理。加入CCK-8 试剂,检测各组细胞于波长490 nm 处A 值,以A(490)值代表各组细胞增殖能力。
1.5 AnnexinⅤ-FITC/PI 染色法检测各组细胞凋亡率收集各组细胞调整浓度,取1×106个细胞,400 g、4 ℃离心5 min,弃上清。加入预冷的PBS缓冲液与细胞混匀,再次离心。细胞重悬,加入10 μL AnnexinⅤ-FITC 和PI,轻轻混匀,4 ℃避光孵育30 min 后加入PBS 缓冲液,流式细胞仪检测各组细胞凋亡情况。细胞凋亡率=(早期凋亡细胞数+晚期凋亡细胞数)/细胞总数×100%。
1.6 透射电镜观察各组细胞中线粒体自噬超微结构表现收集各组细胞,经戊二醛和锇酸固定,丙酮和环氧树脂浸透,采用特制的塑料包埋板加入包埋剂,置入聚合包埋箱聚合。去除组织周围的包埋介质,半薄切片后移至滴加0.5%甲苯胺蓝染色液的载玻片上,染色后切片。醋酸铀避光染色、水洗,再用枸橼酸铅避光染色、水洗、滤纸吸干,于透射电镜下观察并拍照。
1.7 实时荧光定量PCR(real-time fluorescent quantitative PCR, RT-qPCR)法检测各组细胞中miR-145-3p 表达水平TRIzol 法提取各组细胞总RNA,逆转录获得cDNA,进行扩增。反应条件:95 ℃预变性3 min,扩增95 ℃、5 s,56 ℃、10 s,72 ℃、25 s,共40 个循环,最后65 ℃~95 ℃制备熔解曲线。引物序列为miR-145-3p F:5′-GGGGTCCAGTTTTCCC-3′,miR-145-3p R:5′-CTGGTGTCGTGGAGTCGG-3′;U6 F:5′-CTCGCTTCGGCAGCACA-3′; U6 R: 5′-AACGCTTCACGAATTTGCGT-3′。以U6 为内参,采用2-ΔΔCt法计算各组细胞中miR-145-3p 表达水平。
1.8 Western blotting 法检测各组细胞中Beclin-1蛋白表达水平和LC3-Ⅰ/LC3-Ⅱ比值将细胞组织剪碎,加入强裂解液,匀浆直至完全裂解。离心电泳后湿法转膜,加入5%的脱脂奶粉室温封闭4 ℃过夜。根据说明书稀释一抗(1∶1 000),与膜室温孵育1 h。PBST 缓冲液洗涤后,加入HRP 标记的二抗(1∶2 000),与膜室温孵育1 h。ECL 发光液充分与膜接触后,全自动化学发光分析仪分析蛋白条带灰度值,以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.9 统计学分析采用GraphPad Prism 9.0 统计软件进行统计学分析。FMF 最佳干预浓度、细胞增殖能力、细胞凋亡率、各组细胞中miR-145-3p表达水平和Beclin-1蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比值均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用Student’st检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 MPP+诱导SH-SY5Y 细胞损伤的最佳作用浓度和时间不同浓度的MPP+作用SH-SY5Y 细胞后,细胞增殖能力明显降低(P<0.01),提示PD细胞模型构建成功,且细胞增殖能力降低呈作用浓度和作用时间依赖性。干预12、24 和48 h, MPP+诱导SH-SY5Y细胞IC50值分别为(986.23±42.53)、(550.93±13.97)和(358.30±21.57)μmol·L-1,500 μmol·L-1MPP+干预24 h 作用效果最佳,此时细胞存活率为(53.67±0.64)%。见图1。
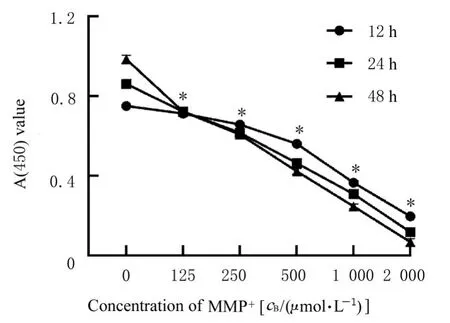
图1 MPP+作用浓度和时间Fig. 1 Concentration and duration of MPP+ action
2.2 FMF最佳干预浓度和作用时间0、0.031 25、0.062 50、0.125 00 和0.250 00 g·L-1FMF 对SH-SY5Y 细胞增殖能力无明显影响;0.500 00 和1.000 00 g·L-1FMF 对SH-SY5Y 细胞增殖能力影响较小。与正常培养组比较,MPP+诱导组细胞增殖能力明显降低(P<0.01)。与MPP+诱导组比较,MPP++不同剂量FMF 组细胞增殖能力均明显升高(P<0.01), 且MPP++0.250 00 g·L-1FMF 组细胞增殖能力升高最明显。因此,FMF最佳干预浓度为0.250 00 g·L-1,最佳干预时间为24 h。见图2。
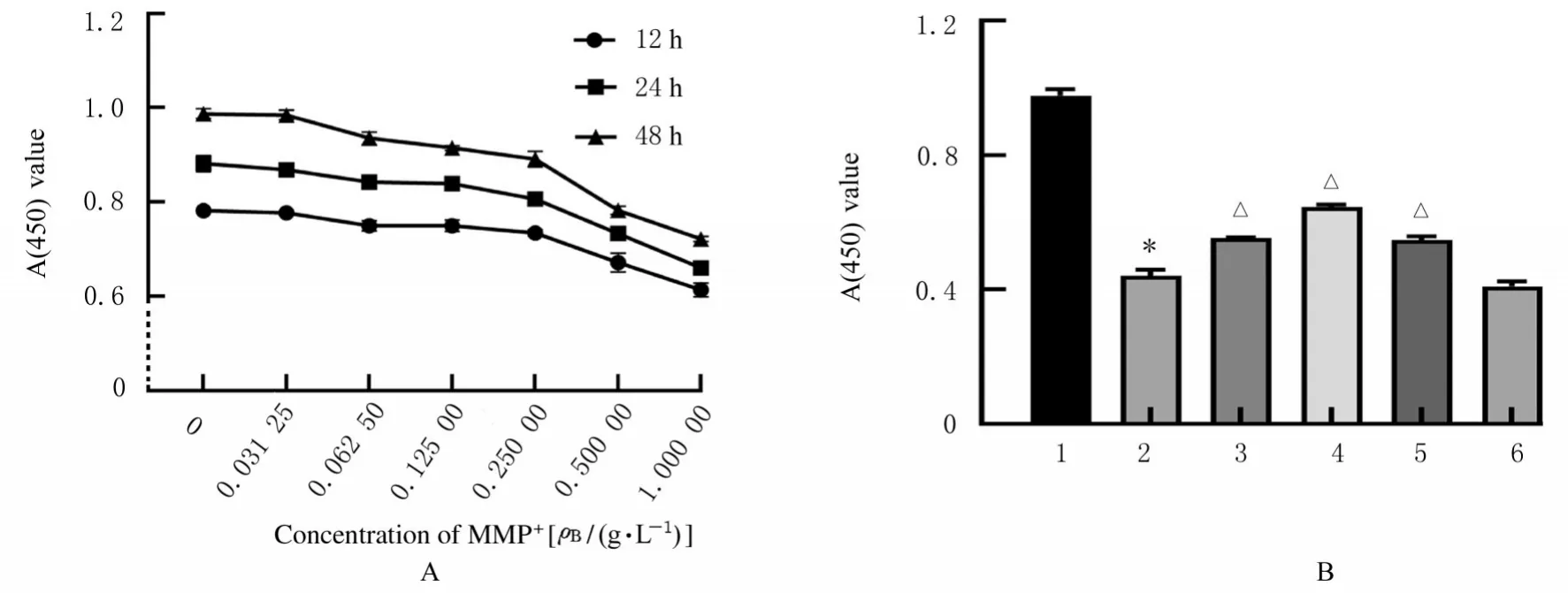
图2 不同作用时间(A)和干预浓度(B)FMF 作用后各组细胞增殖能力Fig. 2 Proliferation abilities of cells in various groups after treated with FMF for different time (A) and different intervention concentrations (B) of FMF
2.3 各组细胞增殖能力与对照组比较,模型组细胞增殖能力明显降低(P<0.01)。与模型组比较,MPP++mimics 组和MPP++FMF 组细胞增殖能力均明显升高(P<0.01)。与MPP++FMF 组比较,MPP++mimics+FMF 组细胞增殖能力明显升高(P<0.01)。见图3。
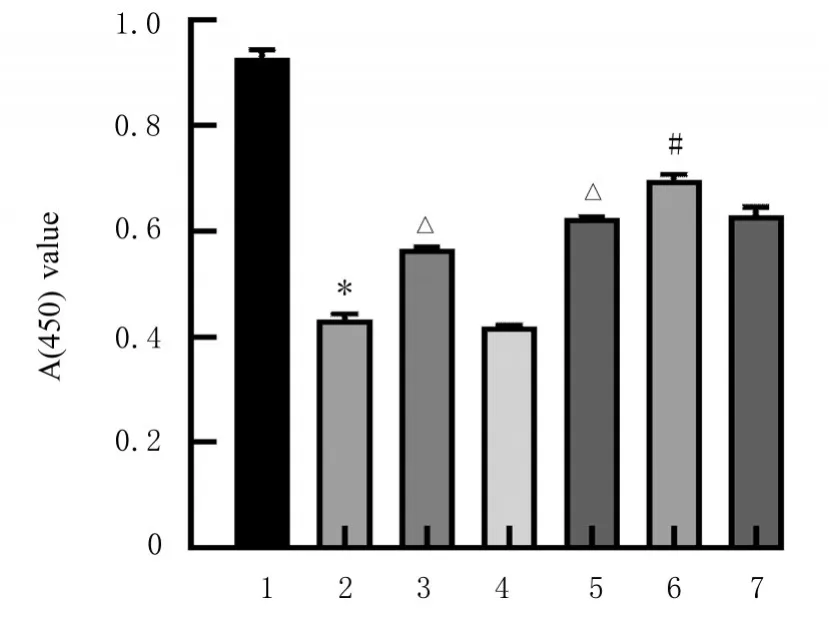
图3 各组细胞增殖能力Fig. 3 Proliferation abilities of cells in various groups
2.4 各组细胞凋亡率与对照组比较,模型组细胞凋亡率明显升高(P<0.01)。与模型组比较,MPP++mimics 组和MPP++FMF 组细胞凋亡率均明显降低(P<0.01)。与MPP++FMF 组比较,MPP++mimics+FMF组细胞凋亡率明显降低(P<0.01)。见图4 和5。

图4 AnnexinⅤ-FITC/PI 染色法检测各组细胞凋亡率Fig. 4 Apoptotic rates of cells in various groups detected by AnnexinV-FITC/PI staining method

图5 各组细胞凋亡率Fig. 5 Apoptotic rates of cells in various groups
2.5 各组细胞线粒体自噬超微结构表现对照组细胞线粒体形态均匀,结构完整;模型组细胞线粒体体积变大,结构不规则,出现空化现象。与模型组比较,MPP++mimics 组和MPP++FMF 组细胞线粒体结构改善,自噬小体数量增加。与MPP++FMF 组比较,MPP++mimics+FMF 组细胞线粒体结构较为完整,自噬小体数量进一步增加。见图6。

图6 透射电镜观察各组细胞中线粒体自噬超微结构表现(×12 000)Fig. 6 Ultrastructural morphology of mitochondrial autophagy in cells in various groups observed under transmission electron microscope(×12 000)
2.6 各组细胞中miR-145-3p 表达水平与对照组比较,模型组细胞中miR-145-3p 表达水平明显降低(P<0.01)。与模型组比较,MPP++mimics 组和MPP++FMF 组细胞中miR-145-3p 表达水平均明显升高(P<0.01)。与MPP++FMF 组比较,MPP++mimics+FMF 组细胞中miR-145-3p 表达水平明显升高(P<0.01)。见图7。

图7 RT-qPCR 法检测各组细胞中miR-145-3p 表达水平Fig. 7 Expression levels of miR-145-3p in cells in various groups detected by RT-qPCR method
2.7 各组细胞中Beclin-1 蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ比值与对照组比较,模型组细胞中Beclin-1 蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ比值均降低(P<0.05)。与模型组比较,MPP++mimics 组和MPP++FMF 组细胞中Beclin-1 蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ比值均明显升高(P<0.01)。与MPP++FMF 组比较,MPP++mimics+FMF 组细胞中Beclin-1 蛋白表达水平和LC3-Ⅱ/LC3-Ⅰ比值均明显升高(P<0.01)。见图8。

图8 Western blotting 法检测各组细胞中Beclin-1 蛋白表达电泳图(A)和直条图(B)及LC3-Ⅱ/LC3-Ⅰ比值(C)Fig. 8 Electrophoregram(A) and histograms(B) of expression of Beclin-1 protein and ratios of LC3-Ⅱ/LC3-Ⅰ(C) in cells in various groups detected by Western blotting method
3 讨 论
全球约2%的60 岁以上人群受PD 影响,引发快速眼动睡眠行为障碍、嗅觉减退、便秘、特征性运动困难和心理或认知问题,对患者日常生活造成较大负担。但目前PD 的发病机制尚未完全阐明。研究[11-12]显示:MPP+结构类似于百草枯神经毒剂,会损害黑质纹状体系统的多巴胺能神经元,其积聚于线粒体中抑制线粒体复合物Ⅰ活性,导致腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)合成不足,线粒体膜极性丧失,线粒体损伤严重。MPP+造成线粒体功能障碍,使线粒体突变并导致其功能和裂变融合机制及中枢神经系统退化,是PD 发生的主要诱因[13]。本研究结果显示:MPP+干预SH-SY5Y 细胞后,SH-SY5Y 细胞的增殖能力、自噬小体数量和线粒体自噬相关蛋白Beclin-1蛋白表达水平及LC3 Ⅱ/LC3 Ⅰ比值明显低于正常培养的细胞,表明MPP+造成SH-SY5Y 细胞线粒体自噬损伤,并导致SH-SY5Y 细胞异常凋亡。
在神经退行性疾病中,线粒体参与ATP 产生、Ca2+稳态和神经递质代谢,维持神经元稳态[14]。作为清除细胞受损线粒体的主要手段,线粒体自噬对于细胞功能和生存至关重要[15]。XU 等[16]发现:肉桂苷A 可降低MPP+诱导的神经元和线粒体膜电位降低并促进自噬体激活,加速受损线粒体降解,减少氧化应激,保护PD 多巴胺能神经元。因此,靶向SH-SY5Y 细胞线粒体自噬损伤在PD 治疗中具有关键作用。PD 治疗多以西药为主,但西药的不良反应对其治疗效果影响较大。类黄酮可激活靶向线粒体功能障碍并诱导神经营养因子的抗凋亡途径,进而表现神经保护作用,是预防PD 的天然产物[17]。乌梅中黄酮含量丰富,其可诱导癌症细胞凋亡,发挥抗炎和抗癌作用[18]。本研究结果显示:FMF 干预SH-SY5Y 细胞损伤模型后,细胞增殖能力恢复,线粒体自噬小体数量和自噬相关蛋白Beclin-1 蛋白表达水平及LC3 Ⅱ/LC3 Ⅰ比值均升高,细胞凋亡率降低。在线粒体自噬过程中,内质网膜包裹受损的线粒体形成自噬体,随后将LC3 Ⅰ蛋白修饰为LC3 Ⅱ蛋白,促进其与溶酶体融合,线粒体自噬作用增强时,自噬标志物LC3 Ⅱ和Beclin-1 蛋白表达均上调[19]。因此,本研究结果进一步证实FMF 可抑制MPP+诱导的SH-SY5Y 细胞凋亡,促进自噬,减轻线粒体损伤。
研究[20-21]显示: miR-145-5p 和miR-145-3p 是新的miRNA 分子,参与调控细胞侵袭、转移、增殖和凋亡等过程,在多种病理和生理过程中发挥重要作用。LIU 等[22]研究表明:在肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)介导的炎症损伤中,下调miR-145 表达可逆转对线粒体活性的抑制,增加SH-SY5Y 细胞存活率。miR-145 表达上调可促进SH-SY5Y 细胞自噬,沉默miR-145 能够逆转SH-SY5Y 细胞自噬的促进作用[20-21]。本研究结果显示:miR-145-3p 在MPP+诱导PD 细胞模型中表达下调,FMF干预后表达明显上调,SH-SY5Y细胞增殖能力增强,线粒体自噬小体数量和自噬相关蛋白Beclin-1 蛋白表达水平及LC3 Ⅱ/LC3 Ⅰ比值均升高,细胞凋亡率降低。FMF 与miR-145-3p mimics 协同作用时,细胞增殖和自噬能力增加,细胞凋亡率降低。FMF 可上调miR-145-3p 表达,促进受损线粒体自噬作用,从而增强对MPP+诱导损伤的SH-SY5Y 细胞的保护作用。
综上所述,FMF 可通过调控miR-145-3p 抑制线粒体功能障碍,明显减轻MPP+诱导的SH-SY5Y细胞损伤,本文结果为深入研究PD 的发病机制及寻找新的治疗靶点提供了参考。

