阻塞性睡眠呼吸暂停低通气综合征与支气管哮喘关系的研究进展
郑志璇,平 芬,李 萍,吴国飘
(河北省人民医院 老年呼吸内科,河北 石家庄 050001)
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea hypopnea syndrome, OSAHS)是上气道塌陷所致的反复呼吸暂停、低通气并伴有夜间血氧水平周期性下降的疾病[1]。支气管哮喘(bronchial asthma, BA)是一种表现为气道高反应性的异质性疾病[2]。全球约有超过1亿的OSAHS患者[3],约有3.5亿BA患者[4],我国BA发病率接近2%[5]。OSAHS在BA患者中的患病率达70%。在欧共体的一项健康呼吸调查[6]中,自诉习惯性打鼾和呼吸暂停的BA患者比例明显高于对照组,说明OSAHS在严重BA患者中更为普遍。OSAHS与BA密切相关。澳大利亚一项研究发现[7],BA患者打鼾发生率高于普通人群。同时,多项研究发现,OSAHS是独立于其他已知因素外引起的BA控制欠佳的高危因素。导致2种疾病相互影响的原因可能是其存在某些共同病因及诱因,如吸烟、肥胖、胃食管反流病(gastroesophageal reflux disease,GERD)及血管生长因子的影响等[8]。OSAHS是BA反复发作的独立危险因素,BA也是OSAHS病情加重的诱因[9]。一种疾病可能使另一疾病恶化,且2种共存会导致病情进展迅速,不利于预后。
1 OSAHS与BA的共同危险因素
1.1吸烟 吸烟被认为是BA与OSAHS的独立危险因素。烟中化学物质可损伤气道上皮细胞和纤毛运动,并降低吞噬细胞功能,产生大量氧自由基,损害气道黏膜引起气道炎症,同时炎症可增加气道阻力,导致气道塌陷,加重睡眠呼吸暂停;吸烟会导致白三烯等炎症介质产生增多,诱发或加重BA。因此,吸烟是OSAHS合并BA的独立危险因素[10-11]。
1.2肥胖 肥胖是引起OSAHS的危险因素,肥胖患者上呼吸道结构和功能改变,氧需求量增加,功能残气量减少,以及呼吸驱动和负荷补偿关系改变都可能引起OSAHS[12];另外,肥胖与促炎介质,如瘦素、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素6(interleukin 6,IL-6)和其他脂肪因子生成有关,这些炎症介质独立于共存的气道疾病而产生气道炎症[11, 13];同时,肥胖也是BA的危险因素,超重/肥胖BA患病率更高。研究表明[14],体重指数(body mass index,BMI)的增加与BA发生频率和发作程度呈正相关。
1.3GERD 夜间迷走神经兴奋性增加诱发支气管痉挛,迷走神经反射由食管远端胃酸触发后导致呼吸阻力增加引发支气管收缩[12]。常用的BA药物,如肾上腺素激动剂和茶碱可能会降低食管下括约肌的张力[15],导致夜间GERD发生。BA或OSAHS引起上气道阻塞使胸腔内负压增加,导致胃内容物逆行运动[16-17]。此外,GERD可通过微呼吸直接诱发BA,胃酸和胃蛋白酶或胆酸和胰蛋白酶内容物损伤呼吸黏膜,并通过迷走神经介导机制或反射性支气管痉挛间接诱发BA[18]。
1.4血管内皮生长因子(vascular endothelial growth factor,VEGF) VEGF是一种缺氧敏感的糖蛋白,有刺激内皮细胞增殖和新血管生成的作用。VEGF参与支气管高反应性、气道重构和新血管的生成,是OSAHS和BA共同致病因素[11, 19]。OSAHS引起的低氧血症,在缺氧与复氧中可诱导低氧诱导因子-α(hypoxia inducible factor-1, HIF-1α)高表达,而HIF-1α是VEGF刺激血管生成的重要因素[19]。HIF-1α高表达及气道塌陷会进一步加重气道重构,诱导BA发生[17]。同时,BA也可由于VEGF高表达出现血管重塑,上气道横截面缩小,鼻腔及咽喉部堵塞导致气道塌陷,促进OSAHS产生。
2 BA对OSAHS的影响
2.1直接作用 OSAHS与BA的机械作用是双向的。BA患者夜间睡眠期间气道阻力增加,功能残气量与呼气末肺容积减少又加重气道阻力,严重时诱导气道塌陷。OSAHS患者常出现习惯性打鼾,呼吸道内湍流的空气导致软腭和上气道组织局部炎症和水肿,增加气流阻力引发或加重BA[11]。
2.2间接作用
2.2.1皮质类固醇的影响 皮质类固醇激素是治疗BA的主要手段,吸入糖皮质激素后导致支气管壁及其周围脂肪沉积,使气管横截面变窄,加重气道痉挛[20];同时,糖皮质激素可诱导气道扩张[8];另外,糖皮质激素明显的不良反应是中心性肥胖,而肥胖是OSAHS的危险因素[11];接受长期、慢性或频繁类固醇激素治疗的BA患者OSAHS的致病率达95%[9]。
2.2.2鼻部疾病 大多数BA患者鼻炎、鼻息肉和腺样体肥大发病率较高[21],感染区域的细菌落入下呼吸道定植,随气管收缩细胞因子转移到体循环,引起并加重局部或全身炎症及气道阻塞[22];鼻部炎症会引起黏膜充血、水肿、鼻狭窄和梗阻,鼻腔阻力增加时会导致吸气时口咽阻力升高,产生的高负压增加了上气道塌陷的风险[23-24]。慢性炎症刺激还能通过副交感神经嗅-支气管反射引起反射性支气管痉挛。鼻塞时,口代替鼻呼吸会导致过多干燥空气进入下呼吸道,易引起BA发作[11]。
3 OSAHS对BA的影响
3.1直接作用
3.1.1神经反射 反复打鼾会造成呼吸道及鼻腔周围软组织损害,引起气道炎症;OSAHS患者睡眠呼吸暂停发作期间迷走神经张力增加并激活中央气道的毒蕈碱受体,导致支气管收缩及夜间BA发作。
3.1.2间歇性缺氧 OSAHS支气管高反应性触发因素之一是气流停止导致间歇性血氧饱和下降,睡眠期间出现部分或完全上气道阻塞导致慢性间歇性缺氧(chronic intermittent hypoxia,CIH)和复氧,间歇性缺氧可导致活性氧(reactive oxygen species,ROS)产生,ROS可能通过转录因子、核因子-κB(nuclear factor kappa-B,NF-κB)和激活蛋白1.68的信号传导触发炎症通路[25];另一种合理解释是胰岛素抵抗(insulin resistance,IR),其不仅与CIH相关,且还是携带全身炎症的代谢综合征的主要“桥梁”。另外,间歇性睡眠呼吸暂停期间胸腔内负压增高,毛细血管血容量增多,易引发BA。
3.1.3炎症 OSAHS会导致局部和全身性炎症[24],局部炎症可能是由于气道闭合的机械创伤、打鼾对黏膜的机械应力,以及局部氧化应激所致[12]。全身炎症的核心特点是血清促炎性细胞因子和趋化因子,如TNF-α、C反应蛋白(c-reactive protein,C-RP)、IL-6、IL-8、VEGF明显升高[26],同时这些促炎细胞混合可能会促进内皮活化和气道常驻细胞(上皮细胞、肥大细胞和成纤维细胞)的活化,导致白细胞聚集[11-12]。
3.1.4瘦素 瘦素是由脂肪组织合成和分泌的蛋白质,已知OSAHS患者瘦素升高[12]。瘦素参与各种呼吸系统疾病的发病,其作为IL-6细胞因子家族的成员具有促炎作用,并引起气道高反应性(bronchial hyperresponsiveness, BHR),与OSAHS患者BA恶化相关[22]。
3.1.5睡眠 睡眠结构紊乱可能导致OSAHS和BA交互作用,睡眠分裂和频繁觉醒是OSAHS的特征,可能会导致气道阻力增加并减弱支气管觉醒收缩反应。BA夜间症状恶化的多种因素中,包括夜间GER和夜间β受体分布密度降低导致自身调节性改变,以及细胞因子和激素分泌昼夜变化。上述因素均可能导致慢性睡眠碎片化,从而引起上呼吸道塌陷。此外,BA患者快动眼睡眠期间胆碱能流出增多更易出现低呼吸、高呼吸和睡眠呼吸暂停,同时又调节下气道的口径和反应性,加重睡眠呼吸暂停的症状。
3.2间接作用 OSAHS可诱发或加重心功能不全。在快动眼睡眠期间,机体代谢和交感神经活动降低,而迷走神经的活性增高,整个心脏呈放松状态。由于OSAHS患者睡眠结构发生变化,快动眼睡眠时间减少,心脏失去正常的放松功能,使做功增多、负荷增加;OSAHS及BA引起的间歇性低氧引起内皮细胞功能障碍进一步导致心肌缺血和心肌重塑[4],还能增强交感神经活性,主动脉收缩增加左心室后负荷,加重心室重构,进而加重心力衰竭过程[11]。见图1。
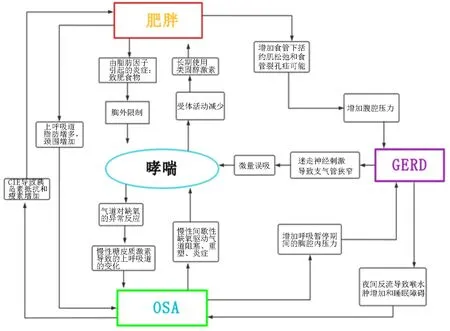
图1 肥胖、BA、OSA、GERD相关机制
4 治疗
4.1持续气道正压通气(continuous positive airway pressure,CPAP) CPAP有利于改善OSAHS症状[3],对BA的发作可能产生积极影响[27]。CPAP可通过增加气道平滑肌压力、补充通气不足的肺泡、增加每分通气量方面改善机械作用等方式缓解BA和OSAHS症状[28];其次,BA和OSAHS共存会加重炎症反应,CPAP可减少TNF-α和C-RP等炎症介质释放,从而改善BA合并OSAHS的炎症反应[3, 29];此外,应用CPAP可改善GERD患者睡眠期间发作的频率和持续时间[12],而GERD症状会随BA发作频率下降而减少[3];最后,CPAP可改善充血性心力衰竭(congestive heart failure, CHF)发生风险, 在改善心功能的同时降低BHR,减少OSAHS与BA症状发生[27]。
4.2孟鲁司特 有研究[30]表明,孟鲁司特可有效降低BA合并OSAHS患者炎症因子水平,其联用无创通气(noninvasive ventilation, NIV)可降低BA合并OSAHS患者临床症状和肺纤维化(pulmonary fibrosis, PF)[31]。
4.3减肥手术 减肥手术可改善BA控制、肺功能、BHR和生活质量[32]。一项大型前瞻性研究[33-34]结果显示,OSAHS二线治疗中,如下颌前移装置(mandibular advancing devices,MAD),耳鼻咽喉(ear, nose and throat,ENT)和横杆手术[9],可明显改善OSAHS合并BA重叠综合征(overlap syndrome,OS)患者,术后2年OSAHS症状。
4.4其他 其他辅助治疗包括超重患者减重、睡前避免使用镇静剂和饮酒等[9]。
5 小结
BA和OSAHS相互影响,BA患者易患OSAHS,OSAHS会加重BA的发作,以及不良结局,因此,明确其相互关系的机制将有助于有效治疗合并症,改善患者预后。目前,OSAHS的诊断主要依赖于多导睡眠监测(polysomnography,PSG)检查,该项检查费时,费用相对较高且多数患者较难适应监测环境。目前,BA合并OSAHS尚未引起足够重视[13]。积极治疗OSAHS可能会减少BA发作频率,从而更好地控制BA,以改善患者生活质量。目前,基于研究资料受限,尚无关于OSA和BA联合治疗的相关指南,BA和OSAHS的治疗仅限于每种特定疾病的指南,2种疾病联合有效的治疗方案仍需大量的研究和证实。

