乳酸菌富硒及其体外抗氧化能力的研究
胡陆军,曹雨澜,陈晓蝶,徐腾,周云川
(1.四川轻化工大学生物工程学院,四川 宜宾 644000;2.宜宾郭满堂生态食品有限公司,四川 宜宾 644000)
引言
硒是人体必需的微量元素之一,是谷胱甘肽过氧化物酶的活性中心元素[1],与机体氧化防御系统以及多种疾病密切相关[2]。但是,硒在全球的分布极不均衡,超过2/3 的人口生活在低硒地带[3],当人体持续硒摄入不足时会导致生殖障碍、免疫缺陷和克山病等[4]。现阶段,我国缺硒现象普遍存在,成人每日硒平均摄入量仅26.3 μg[5]。研究发现,成人每日硒的摄入量应不低于40 μg[6],才能基本维持硒酶在人体内的活性。而仅靠从天然食物摄取难以满足人体对硒的需求[7]。在自然界中,硒按其结合形态可分为有机硒和无机硒,有机硒安全且生物利用度更高[8],具有抗癌[9]、抗菌[10]、抗病毒[11]、抗氧化等药理活性以及神经保护作用[12];无机硒如亚硒酸钠和硒酸钠等化合物则表现出较高的遗传毒性[12]。大量研究表明无机硒可被微生物利用、转化和积累[13],是转化为有机硒从而为人体补充硒的良好硒源。
乳酸菌是目前食品发酵行业应用最为广泛的微生物,具有突出的微量元素富集能力[14],有机硒积累方面也表现出良好的生物安全性和高效的无机硒转化率[15]。无机硒能以化学吸附形式与乳酸菌等微生物在胞外结合[16],进入细胞后再通过乳酸菌代谢将无机硒与体内的生物大分子结合形成硒蛋白、硒多糖或析出单质硒等富硒物质[17],毒性大大降低。大量研究表明乳酸菌在富硒方面具有优越的表现,如从伊朗传统乳制品中分离出的短乳杆菌,能耐受3.16 mmol·L-1亚硒酸钠,具有较强的硒耐受性[18]。王丽红等[19]将植物乳杆菌接入改良后的含硒MRS培养基中,发现菌株生长繁殖能力增强,合成的纳米硒颗粒也更均匀、稳定,富硒率为1.3 g/L。
基于此,为了探究不同种属乳酸菌的富硒能力,本研究以实验室筛选并保存的3 种乳酸菌为研究对象,分析乳酸菌对亚硒酸钠的耐受性及其在硒环境中表观结构的变化,并以此为基础进一步研究乳酸菌富硒能力和体外抗氧化能力,从而为富硒乳酸菌及其发酵食品的研发提供理论基础和实践依据,满足人体对硒的需求和改善硒缺乏现状。
1 材料与方法
1.1 菌种
植物乳杆菌(Lactobacillus plantarum)3 株(分别为ZW19、ZW107、ZW109);戊糖片球菌(Pediococcus pentosaceus)3 株(分别为WT89、WT111、WT125)和短乳杆菌(Lactobacillus brevis)3 株(分别为DR91、DR93、DR104),共9株乳酸菌,均来源于发酵食品。
1.2 试剂
无水亚硒酸钠(Na2SeO3)、乙二胺四乙酸二钠盐(EDTA-2Na)、3,3’-二氨基联苯胺(DAB)均为AR,购于成都西亚化工股份有限公司;盐酸(AR)购于重庆川东化工有限公司;氢氧化钠、叔丁醇均为AR,购于成都市科隆化学品有限公司;甲苯(AR)购于重庆化工有限公司;2.5%的戊二醛电镜固定液购于以达科技有限公司;超氧阴离子含量检测试剂盒与羟自由基清除能力试剂盒购于生工生物工程(上海)股份有限公司。
1.3 仪器与设备
生物显微镜(SK210,麦克奥迪实业有限公司);分光光度计(UV-1601,北京北分瑞利分析仪器有限责任公司);pH 计(PHS-10,成都世纪方舟科技有限公司);真空冷冻干燥机(SCIRNTZ-10N,宁波新芝生物科技股份有限公司);扫描电子显微镜(VEGA3SBU,捷克Tesan公司)。
1.4 实验方法
1.4.1 乳酸菌菌株硒元素耐受性测定
将乳酸菌培养至对数前期,以4%的接种量接种于含50 μg/mL亚硒酸钠的MRS液体培养基中,每组做3 次平行试验,于37 ℃培养箱中培养24 h。利用比浊法测定菌液的OD600nm吸光度,分析乳酸菌菌株对硒元素的耐受性。
1.4.2 乳酸菌富硒能力测定
1.4.2.1 硒母液与DAB溶液的配制
将Na2SeO3溶于蒸馏水中配制成1 mg/mL Na2SeO3母液。将DAB 溶于1 mol/L 的盐酸配制成0.5wt% DAB溶液。
1.4.2.2 亚硒酸钠标准曲线的绘制
以1 mg/mL 的Na2SeO3母液为基础配制浓度为10 μg/mL 的Na2SeO3标准溶液。分别吸取硒浓度为10 μg/mL 的Na2SeO3标准溶液0、2、4、6、8、10 mL 至锥形瓶内,加蒸馏水定容至35 mL,随后加入1 mL的5wt%的EDTA-2Na 溶液,混匀。用HCl 调pH 值至2~3,混匀后 避光反 应 30 min。加 入 4 mL 0.5wt% DAB 溶液,用NaOH 调pH 至中性;最后加入10 mL 甲苯,混匀,确保无机硒被甲苯充分萃取,溶液置于暗处分层,弃水层,收集甲苯层于比色皿中。在波长420 nm 处用紫外分光光度计测定滤液的吸光度,绘制标准曲线[20]。
1.4.2.3 乳酸菌富硒率的测定
乳酸菌富硒率的测定参考杨鹤等[21]的方法稍做修正。取3 mL 菌液于离心机中在6000 r/min 条件下离心10 min。取2.8 mL 上清液于锥形瓶中,加蒸馏水至35 mL,再加入1 mL 5wt% EDTA—2Na 溶液。测定方法与硒元素标准曲线相同,根据样品在波长420 nm 处测得的吸光度,在标准曲线中计算出相应的硒含量,所得值即为无机硒含量,用总硒含量减去无机硒含量即得到菌株富硒量。乳酸菌富硒率计算公式如下:
1.4.3 扫描电镜分析乳酸菌表观结构
将富硒乳酸菌于离心机中在6000 r/min 条件下离心20 min,弃上清液,加入2.5%(vol)戊二醛电镜固定液固定,涡旋震荡5 min,置于4 ℃条件下避光处理2 min,经6000 r/min 离心20 min,弃去上层清液。用pH 值为7.2 的磷酸缓冲溶液清洗,随后用不同浓度的乙醇进行梯度洗脱(加乙醇溶液后涡旋震荡5 min,静置5 min,再以6000 r/min 转速离心5 min),弃上清液,用叔丁醇置换乙醇,将样品进行真空冷冻干燥,样品喷金后进行电镜扫描分析[22]。
1.4.4 富硒乳酸菌的抗氧化能力测定
参照超氧阴离子含量检测试剂盒与羟自由基清除能力试剂盒说明书,分别对含有和不含有亚硒酸钠溶液的MRS 液体培养基中的乳酸菌菌株抗氧化能力进行测定。
2 结果与分析
2.1 乳酸菌菌株耐硒能力分析
乳酸菌对50 μg/mL Na2SeO3的耐受性如图1 所示。通过比较乳酸菌在含有和不含有Na2SeO3的MRS 培养基中乳酸菌的生长状况来反映乳酸菌对Na2SeO3的耐受性,通过测定乳酸菌在600 nm 处的吸光度值来反映乳酸菌的生长状况。

图1 乳酸菌对50 μg/mL Na2SeO3的耐受性(NS表明无显著性差异)
从图1 可知,9 株乳酸菌在含有和不含50 μg/mL Na2SeO3的MRS 培养基中培养后,这9 株乳酸菌生长都没有显著性差异,因此,这9株乳酸菌对50 μg/mL Na2SeO3都表现出较好的耐受性。其中,植物乳杆菌ZW109、戊糖片球菌(WT89、WT111、WT125)、短乳杆菌(DR91、DR93、DR104)富硒后的菌体生物量相对于未富硒的菌体生物量有所下降,但是和对照组之间没有显著性差异。这表明50 μg/mL Na2SeO3未对菌株发育繁殖造成影响,与其他研究结果一致[23]。当硒元素浓度较低时可以促进乳酸菌的生长,但高浓度的硒元素则会抑制生长、导致菌体细胞破损甚至造成乳酸菌死亡[24]。
2.2 乳酸菌菌株富硒能力分析
利用硒元素与DAB 在酸性的条件下生成黄色络合物质这一特性,通过测定不同浓度Na2SeO3标准溶液在420 nm 波长下吸光度确定硒元素含量[24]。利用DAB 比色法对Na2SeO3标准曲线进行绘制,如图2 所示,其回归方程为y=0.00518x+0.00919(R2=0.998),这表明该模型线性拟合程度较好,可用于后续相关结果分析。

图2 亚硒酸钠标准曲线
利用DAB 比色法测定不同乳酸菌菌株富硒率,结果如图3 所示。植物乳杆菌ZW19、ZW107 和ZW109 的富硒率分别为65.35%、65.63%和62.59%,经计算富硒量分别为490.13、492.20、469.44 μg/mL;戊糖片球菌不同菌株之间存在显著差异,其中WT111 富硒率为54.18%,富硒量为406.35 μg/mL。短乳杆菌3 菌株之间也存在显著性差异,其中DR104 富硒率最高为 64.52%,富硒量为483.92 μg/mL,该菌株富硒率显著高于另外两株短乳杆菌。这与已有研究发现的不同来源的同种乳酸菌富硒特性不同的结果具有一致性[25]。

图3 乳酸菌富硒率种内差异
乳酸菌富硒率种间差异如图4 所示,图中可见,3 种菌富硒率存在显著的种间差异,植物乳杆菌富硒率最高,戊糖片球菌富硒率次之,短乳杆菌富硒率最低。已有研究发现不同种属乳酸菌富硒能力不同[25],Mörschbächer等[23]研究发现在添加150 mg/L Na2SeO3培养液中培养后,与粪肠球菌、拟布氏乳杆菌和植物乳杆菌相比,副干酪乳杆菌表现出最佳富硒能力。王翼雪等[2]研究发现,相对于嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌而言,植物乳杆菌具有更高的富硒率。因此,乳酸菌富硒能力的差异不仅与菌株有关,还与菌种有关。
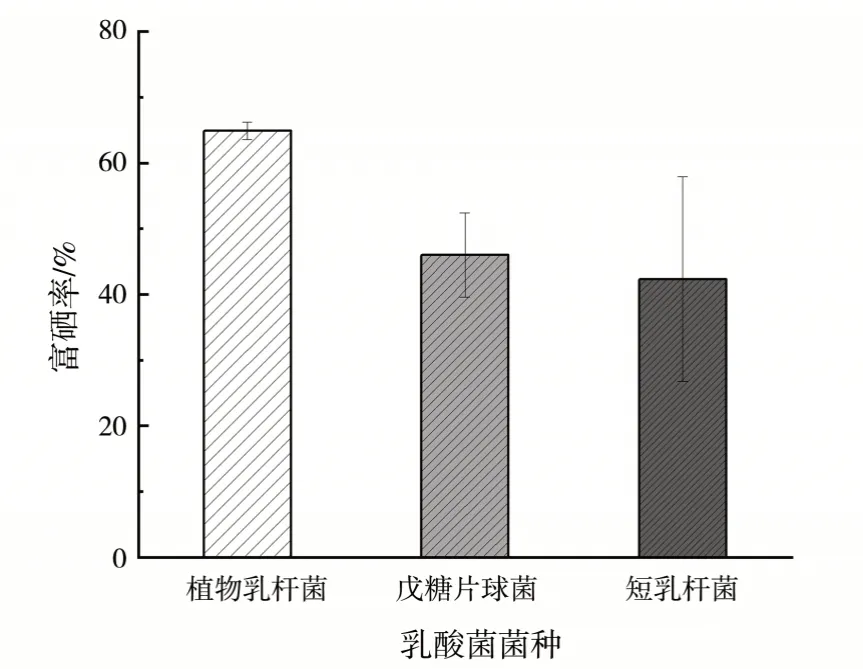
图4 乳酸菌富硒率种间差异
2.3 富硒乳酸菌表观形态观察
为研究Na2SeO3对乳酸菌菌体细胞形态的影响,用扫描电镜对富硒率较高的4 株乳酸菌ZW19、ZW107、ZW109 和 DR104 在 50 μg/mL Na2SeO3条件下菌株细胞表观结构进行观察,4 株乳酸菌的扫描电镜结果如图5所示。

图5 乳酸菌扫描电镜图(× 20 000)
从图5 可见,4 株乳酸菌对照组与实验组的菌体形态和表观结构并未发生明显变化。植物乳杆菌ZW19、ZW107 和ZW109 在50 μg/mL Na2SeO3条件下仍然呈现与对照组(图5(a)、图5(b)和图5(c))相似的 经典的 短杆状[26],长0.42~0.67 μm,宽0.67~5.20 μm,短乳杆 菌DR104 在50 μg/mL Na2SeO3条件下与对照组均呈现相同的较短杆状[27],长 1.00~2.17 μm,宽 0.87~1.04 μm。经Na2SeO3处理后的菌体表面光滑完整、界限清晰,形态饱满无收缩破裂现象。因此,50 μg/mL Na2SeO3对4 株乳酸菌的表观结构无影响,这表明4 株乳酸菌对50 μg/mL 的Na2SeO3具有较强耐受性。
富硒后的植物乳杆菌ZW107 电镜图如图6 所示,图中可见,细胞表面有明显的微小球状颗粒,这可能是植物乳杆菌合成并析出了单质硒[15]。在其他研究中也有相同的发现。比如,Xu 等以含1.2 mmol/mL Na2SeO3培养液培养干酪乳杆菌能产出大量50~80 nm 的硒纳米颗粒[28]。Martínez等[29]通过SEM 观察发酵饮料中的硒化短乳杆菌,也清楚地观察到纳米硒。

图6 富硒后ZW107电镜图(× 5000)
2.4 富硒乳酸菌抗氧化能力分析
富硒乳酸菌抗氧化能力结果如图7 所示,图中可见,9 株乳酸菌富硒后超氧阴离子均显著降低,而羟基自由基清除能力显著提高。因此,9 株乳酸菌菌株经过富硒后表现出良好的抗氧化能力。特别地,植物乳杆菌ZW19、ZW107、ZW109和短乳杆菌ZW104 具有更突出的抗氧化活性,这与菌株富硒能力的研究结果一致。乳酸菌富硒后可以显著提高抗氧化能力,如Hyrslova等[30]研究发现富硒的嗜热链球菌具有更高的抗氧化活性;同样Shakibaie等[18]发现短乳杆菌在含硒培养基中培养后该菌株抗氧化活性显著高于无硒培养基中培养的短乳杆菌,自由基的清除率达到36.5% ± 1.31%,p<0.05。

图7 富硒乳酸菌抗氧化能力
超氧阴离子是大多数活性氧簇(ROS)的前体和氧化链反应的介质[31],具有抗氧化能力的富硒乳酸菌能够有效清除活性氧和自由基[32]。当细胞受到无机硒胁迫时产生氧化应激反应,细胞会合成用于ROS解毒和修复大分子氧化损伤的谷胱甘肽过氧化物酶(GSH—Px)、硫氧还蛋白还原酶(TrxR)和其他氧化还原酶类来抵御氧化应激[31]。这些酶是乳酸菌通过自身代谢形成含有硒半胱氨酸残基的硒蛋白,以硒酶的形式在机体中发挥抗氧化功能[33]。GSH—Px 以硒为活性中心元素,催化过氧化氢和各种有机过氧化氢,将其还原成无害的水和相应的醇[34],TrxR 是以NADPH 为电子供体的二聚体硒酶,通过催化调节氧化的硫氧还蛋白还原而发挥抗氧化作用[35]。此外,还有其他氧化还原酶形式,如甲酸脱氢酶和甘氨酸还原酶可赋予细胞抗氧化特性[36]。
3 结束语
通过研究乳酸菌菌株对硒耐受性发现添加50 μg/mL 亚硒酸钠未对乳酸菌的生长繁殖造成影响。进一步对乳酸菌菌株富硒能力研究发现,植物乳杆菌富硒能力均高于戊糖片球菌和部分短乳杆菌,戊糖片球菌WT89、WT125 和短乳杆菌DR91、DR93 的富硒能力相对较低。此外,分别对4 株高富硒能力乳酸菌菌株(ZW19、ZW107、ZW109 和DR104)进行电镜观察,结果显示加硒培养后4 株乳酸菌菌体的形态和表观结构并未发生变化,且富硒后的植物乳杆菌ZW107 细胞表面有单质硒颗粒析出。最后,对乳酸菌菌株进行超氧阴离子含量与羟自由基清除能力测定,发现9 株乳酸菌的实验组均比对照组显示出更高的抗氧化活性。本研究对不同种属的乳酸菌富硒能力进行了初步研究,并对其富硒后的体外抗氧化活性进行了测定,然而,对于其具体作用机理有待进一步探究。

