miR-148a-3p 调控血管生成的体内外表型鉴定
黄瑾 韩文卿 李鑫 陈骁俊
miRNA 是一类由约22 个核苷酸组成的内源性非编码小RNA,可通过调控mRNA 转录后修饰,参与多种生理和病理过程。有研究认为miR-148a-3p可参与调节血管生成,但尚未形成定论。有文献报道miR-148a-3p 可 通 过 调 节DNMT1[1-2]、ERBB3[3]、IGF-IR、IRS1[2]、NRP1[4]、WNT1[5]、PKM2[6]、FGF2[7]等靶基因抑制血管生成;也有文献报道其可通过调控FIH1[8]、KLF6[9]等靶基因促进血管生成。
前述miR-148a-3p 调控血管生成的相关研究大多基于体外实验,缺乏体内真实微环境下的研究结果。本研究拟利用miR-148 基因敲除小鼠,结合miRNA mimic 转染,从敲除和过表达两方面明晰miR-148a-3p 对血管生成的作用。
1 材料与方法
1.1 miR-148a 基因敲除小鼠的构建及基因型鉴定
本研究所使用的miR-148a 基因敲除小鼠由江苏集萃药康生物科技股份有限公司构建,在上海交通大学医学院附属第九人民医院动物房饲养。所有动物实验操作均经上海交通大学医学院附属第九人民医院动物伦理委员会批准(伦理审批编号:SH9H-2023-A776-1)。繁育过程均采用杂合子小鼠,雌雄比例为1 : 2,取耳朵或尾巴部分组织行基因型鉴定,根据实验设计选取相应周龄的敲除型(Knock-out,KO)、杂合型(Heterozygous,HE)和野生型(Wild type,WT)同窝小鼠开展动物实验。
1.2 冷冻切片及免疫荧光染色
取4 周龄雄性小鼠,安乐死后取材,实验方案参考文献[10]。取新鲜胫骨样本,4%多聚甲醛溶液固定4 h、10% EDTA 溶液脱钙24 h,冰冻切片保护液(20%蔗糖和2%聚乙烯吡咯烷酮溶液)浸润24 h 后,加入明胶完成包埋。切片完成后,依次完成透膜、封闭、一抗孵育(CD31,R&D Systems,Abcam, UK)、二抗孵育、DAPI 染色等步骤完成免疫荧光染色,并在荧光显微镜下完成图像拍摄。
1.3 跖骨离体培养实验
在解剖显微镜下,解剖分离E17.5 d 胎鼠的跖骨行离体培养,剩余组织取样行基因型鉴定,以明确相应跖骨的基因型。将单个跖骨放置在24 孔板的1个孔内,并加入200 μL完全培养基,在5%CO2、37 ℃培养箱内培养。每隔72 h 更换300 μL 完全培养基。第16 天时,固定、透膜、封闭、CD31 一抗孵育和二抗孵育,在荧光显微镜下直观地观察和评估出芽式血管生成的情况。
1.4 细胞培养
miR-148a-3p 在人类和小鼠中高度保守,故本研究后续借助人脐静脉内皮细胞系(Human umbilical vein endothelial cells,hUVECs)在体外实验中进一步探究miR-148a-3p 在血管生成中的作用。hUVECs 用含5%胎牛血清(FBS)、1%内皮细胞生长因子(ECGS)、1%双抗(P/S)的内皮细胞培养基(ECM),在5%CO2、37 ℃恒温培养箱中培养。
1.5 细胞转染
采用miR-148a-3p Mimic 试剂(广州锐博生物科技有限公司)转染hUVECs,过表达内皮细胞miR-148a-3p。转染方法参照试剂使用说明书。首先将转染试剂与miR-148a-3p Mimic 试剂混合,室温静置20 min 后,转染细胞6 h,之后将转染混合物更换为完全培养基。在转染后48 h,提取RNA做相关检测。
1.6 细胞增殖实验
采用CCK8 细胞计数试剂盒(同仁化学,日本)检测miR-148a 过表达在细胞增殖中的作用。将hUVECs 细胞以每孔3×103个的密度接种于96孔板,在不同的时间点(分别为种板后24 h、48 h、72 h 和96 h)将培养基更换为含10 μL CCK8 试剂的100 μL 完全培养基,37 ℃培养箱内继续孵育2 h,之后使用Tecan 多功能分光光度计测量其在450 nm处的吸光度,并采用GraphPad Prism 8 计算细胞增殖曲线。
1.7 Matrigel 管腔形成实验
以 每 孔50 μL 的 剂 量,将Matrigel 基 质 胶(Corning®,BD,美国)添加到预冷却的96 孔板中,室温水平放置约10 min 后,37 ℃培养箱中再放置30 min,使其完全凝固。在等待基质胶凝固时,进行内皮细胞消化、重悬和计数,消化后采用无血清无双抗的双无ECM 培养基重悬,并以1.5×104个/孔的密度接种到Matrigel 基质胶上,孵育4 h后拍摄图像。采用Image J 软件Angiogenesis Analyzer 插件的“Analyze hUVEC Phase Contrast”功能作定量分析。
1.8 细胞迁移实验
在每个小室(8 μm,Millipore)中加入100 μL细胞悬液(细胞密度为5×105个细胞/mL,重悬溶液为无血清无双抗的ECM 培养基),在24 孔板中加入600 μL 完全培养基。培养18 h 后,4%多聚甲醛固定,结晶紫溶液染色。用棉签轻轻拭去残留在上室的细胞后,显微镜下拍摄图像。每个小室拍摄上下左右中5 个视野的图像,用Image J完成细胞计数,取5 个视野的计数平均值作为该小室的迁移细胞数。
1.9 F-actin 肌动蛋白显像实验
将hUVECs 细胞悬液以无血清无双抗的ECM培养基重悬,以1×104个细胞/皿的密度接种于共聚焦培养皿,37 ℃培养箱孵育4 h 后,在室温下用携带有荧光标记的鬼笔环肽(phalloidin-AF594)和DAPI 染色1 h,后在共聚焦显微镜下拍摄荧光图像。
1.10 实时荧光定量聚合酶链反应(qPCR)
采用Multisource total RNA Extract Reagent(Catalog#11818KD1,Axygen,美国)提取细胞总RNA,使用Nanodrop ND-1000(Thermo Fisher,美国)检测RNA 纯度和浓度后,使用逆转录酶和oligo(dT)引物(Catalog#RR036,TaKaRa,日本)从500 ng 总RNA 中逆转录出单链cDNA。使用PrimeScript ™RT-PCR 试剂盒(Catalog#RR420,TaKaRa,日本)进行实时qPCR 扩增。所有PCR 操作均在Quant-Studio 6 Flex(Applied Biosystems,美国)中进行,使用2-ΔΔCt方法进行分析。
1.11 统计分析
2 结果
2.1 miR-148a 敲除可促进血管生成
胎鼠跖骨离体培养实验是一种具有代表性的研究血管生成的方法,即通过离体培养胎鼠跖骨,观察其萌出的血管结构以评估出芽式血管生成的情况[11]。经过16 d 的离体培养,相较野生型跖骨,miR-148a 敲除胎鼠的跖骨可形成明显更多的CD31阳性的血管网状结构,但血管管径偏细,且网状结构略显杂乱(图1)。
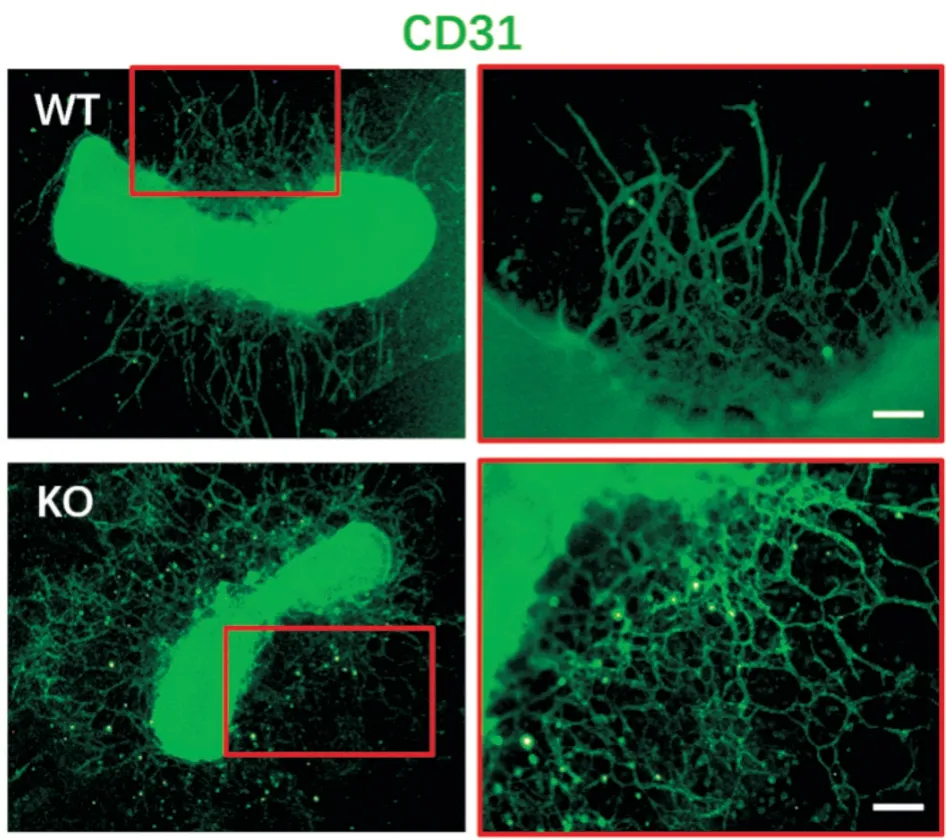
图1 离体培养实验显示敲除型胎鼠(KO)组跖骨离体培养后CD31 阳性的血管网状结构明显多于野生型胎鼠(WT)组(比例尺=10 μm)Fig.1 The metatarsal experiment showed more CD31-positive structures in the knock-out (KO) group than the wild-type (WT)ones (Scale bar=10 μm)
2.2 miR-148a 基因敲除小鼠H 型血管形成异常
文献报道miR-148a 基因敲除小鼠存在骨骼发育异常,骨量上升[12]。H 型血管(CD31highEMCNhigh)是一种偶联成骨和成血管的特殊内皮细胞亚型,主要分布于干骺端和骨内膜区域。因此,本研究通过冰冻切片,对miR-148a 基因敲除小鼠的H 型血管分布情况进行了探究,发现与同窝杂合小鼠相比(图2),miR-148a 基因敲除小鼠H 型血管存在分布异常。在杂合小鼠中,H 型血管面积占比平均约为10.82%,而miR-148a 敲除小鼠中,H型血管的面积占比平均值仅为7.478%,两者具有统计学差异(P=0.0273)。此外,全敲小鼠中H 型血管的平均直径从杂合型小鼠的17.36 μm 下降到14.89 μm(P=0.0242)。

表1 引物序列Tab.1 Primer sequence
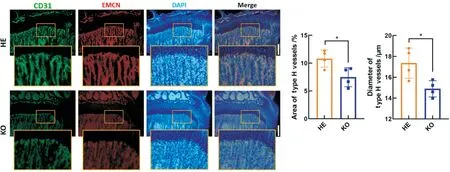
图2 miR-148a 基因敲除小鼠H 型血管分布异常Fig.2 miR-148a knock-out mice demonstrated abnormal type H vessels
2.3 miR-148a 过表达可抑制血管生成
由于miR-148a-3p 在人类和小鼠间高度保守,我们借助人脐静脉内皮细胞系(hUVECs),在体外实验中探索miR-148a-3p 对血管生成各个环节的作用。我们先通过miR-148a-3p Mimic 转染实验过表达内皮细胞内的miR-148a-3p。经qPCR 验证 发 现,在hUVECs 中 转 染miR-148a-3p Mimic后,miR-148a-3p 的表达水平可升高至原表达水平的1 000 多倍(图3A)。虽然细胞增殖实验的结果提示miR-148a-3p 过表达并不影响内皮细胞的增殖能力(图3B),但对其出芽和迁移能力都存在不同程度的抑制效果。与阴性对照组(NC)相比,miR-148a-3p 过表达组(Mimic)内皮细胞的管腔形成能力受损。其中,总分支长度下降了约15%,两组间具有统计学差异(P=0.0110,图3C)。与阴性对照组(NC)相比,miR-148a-3p 过表达组(Mimic)内皮细胞的迁移能力下降了约66.92%,两者具有统计学差异(P=0.0083,图3D)。通过鬼笔环肽显像丝状肌动蛋白(F-actin),可以较为直观地看到miR-148a-3p 过表达后,内皮细胞整体形态更为圆滑,板状伪足数目明显减少(图3E)。之后,我们又通过qPCR 检测了血管生成相关的几个特异性基因mRNA 表达水平改变情况。在miR-148a-3p 过表达的条件下,各相关标志基因(VEGF、bFGF、HIFα、VWF、VEGFR1、VEGFR2、MMP2和MMP9)的表达水平均呈现不同程度的显著下调(图3F)。
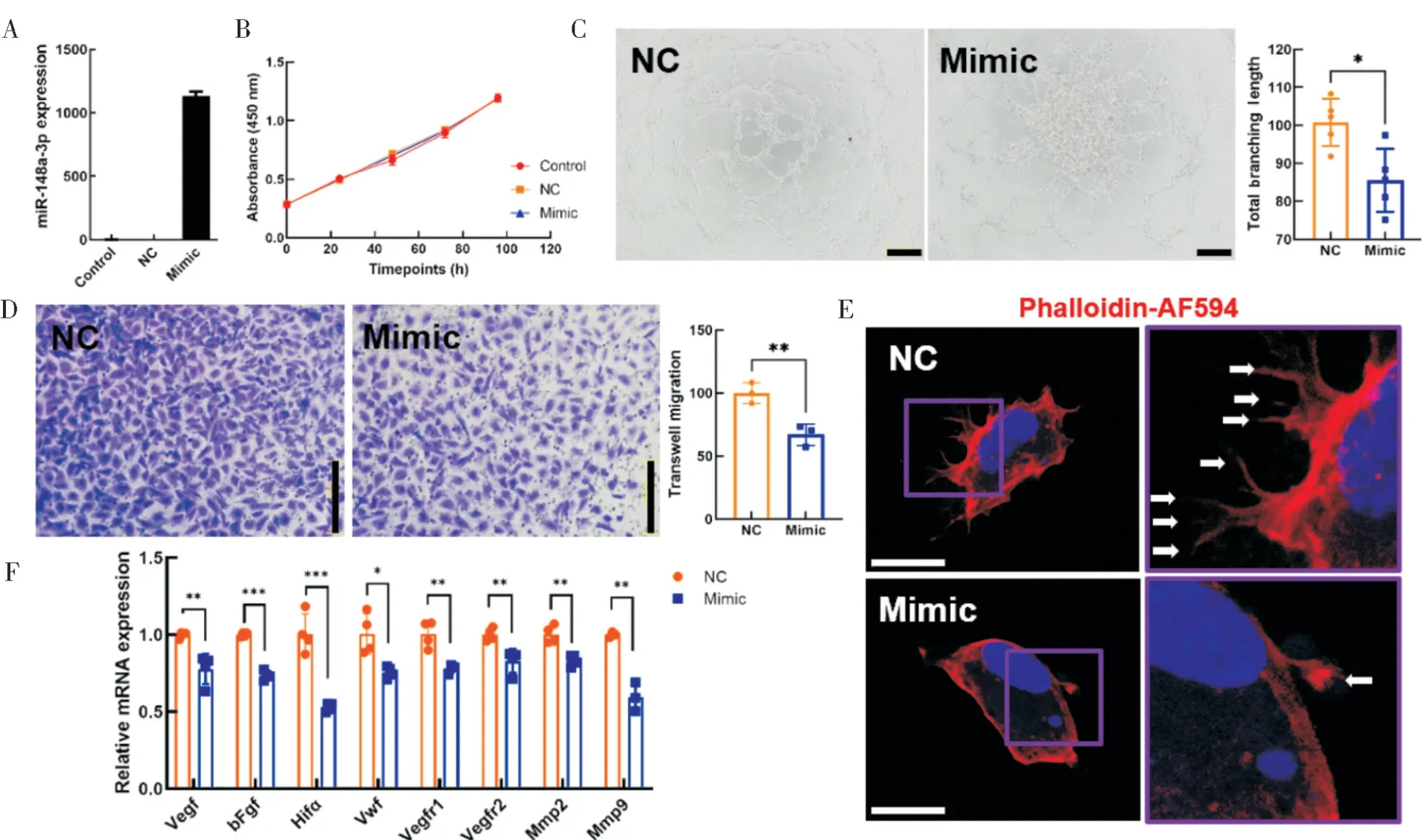
图3 miR-148a-3p 过表达可抑制血管生成Fig.3 miR-148a-3p suppressed angiogenesis in-vitro
3 讨论
本研究通过miR-148a 敲除小鼠的组织切片和免疫荧光染色实验、跖骨离体培养实验,以及miR-148a-3p 过表达的一系列体外实验(细胞增殖实验、管腔形成实验、细胞迁移实验、细胞出芽实验和血管生成特异性标志基因mRNA 表达水平检测),证实了miR-148a-3p 可抑制血管生成。
在骨塑建/骨重塑过程中需要充足的血液供应。文献报道,miR-148a 基因敲除小鼠具有骨量上升的长骨表型[12],miR-148a-3p 可通过调节NRP1[13]或Kdm6b[14]等下游靶基因抑制成骨分化。H 型血管(CD31highEmcnhigh)是骨骼组织中一种特殊的内皮细胞亚型,能够偶联骨内血管生成和成骨生成的生物学过程。H 型血管在骨塑建和骨重塑过程中有着至关重要的作用,生长发育阶段破坏H 型血管形成可导致骨骼发育不良,而促进H 型血管形成则有利于骨创伤愈合和牵张成骨等。因此,miR-148a 基因敲除小鼠中H 型血管的分布异常也从另一个角度佐证了其成骨生成能力的增强。
关于miR-148a-3p 影响血管生成的机制研究不少,但已报道的下游靶基因众多,趋势也不一致。已知miR-148a-3p 可通过调节DNMT1[1-2]、ERBB3[3]、IGF-IR、IRS1[2]、NRP1[4]、WNT1[5]、PKM2[6]、FGF2[7]等靶基因抑制血管生成;也可通过调控FIH1[8]、KLF6[9]等靶基因促进血管生成。由于miRNA 的表达模式具有位相性和时序性[15],在不同实验条件下,同一种miRNA 的研究可能会得到截然不同的结果。
上述miR-148a-3p 调控血管生成的机制研究多基于体外实验,缺乏体内真实微环境下的研究结果。骨内皮细胞有着不同于其他器官内皮细胞的独特生物学特征[16],又因其占比较小(骨内皮细胞仅占整个骨组织细胞总量的约2%),下一阶段,我们拟基于体内真实环境,提取原代骨血管内皮细胞,借助多组学研究,进一步探索miR-148a-3p 调控骨内血管生成的分子机制。
4 结论
miR-148a 敲除可促进血管生成。miR-148a 基因敲除小鼠存在H 型血管分布异常。miR-148a-3p 过表达可抑制血管生成,包括细胞出芽、迁移、管腔形成等生物学过程。

