赤铁矿{001}和{012}晶面对Cr(Ⅵ)吸附差异性研究
廖荣, 罗才贵,b, 高琦, 钟丽娴, 罗仙平*
(江西理工大学,a. 江西省矿冶环境污染控制重点实验室;b. 钨资源高效开发及应用教育部工程研究中心,江西 赣州 341000)
当前,随着工业的迅速发展,国内外重金属污染问题愈发严重。铬作为一种典型的重金属元素,主要来源于制革、电镀、陶瓷等工业生产过程[1]。铬通常以Cr(Ⅲ)和Cr(Ⅵ)形态存在。其中,Cr(Ⅵ)以溶解态分布于环境中,其毒性高于Cr(Ⅲ)约100 倍[2-3],对人体具有致癌、致突变及损伤呼吸道危害,严重威胁人体健康[4-5],其高迁移性的特点进一步增加了Cr(Ⅵ)的环境风险。Cr(Ⅵ)通常以含氧酸根阴离子(CrO42-和Cr2O72-)形式存在于地表环境中,在环境中的迁移转化过程容易受铁氧化物吸附的影响[6],因此,探明Cr(Ⅵ)与铁氧化物之间的相互作用(吸附)尤为重要。
铁氧化物广泛分布于水体、土壤等地表环境中,具有反应活性高、比表面积大的特点,对污染物具有良好的吸附作用,影响地表环境中污染物(阴、阳离子等)的迁移与转化[7-8]。在众多铁氧化物中,赤铁矿热稳定性最高,具有丰富的表面羟基,是一种优良的天然吸附剂[9-10]。研究表明,赤铁矿可通过静电引力、表面络合等作用机制,对重金属、含氧酸根离子等环境污染物进行吸附固定[11-12]。
前人大多以粗制无定型的赤铁矿为研究对象,通常是由各种不同晶面赤铁矿混合而成的粉晶,研究过程忽略了不同晶面之间的本征差异性所带来的影响,导致对赤铁矿吸附机制及其地球化学过程的认识存在一定的局限性[13-15]。近年来,赤铁矿的晶面效应越来越受研究者关注[16-19]。MEI 等[16]研究发现,由于赤铁矿不同晶面表面羟基的种类和密度具有差异,导致U(Ⅵ)以单核双齿共边配位的形式吸附于赤铁矿{001}面,而在{012}面上却以双核双齿共角配位的形式存在。综上,赤铁矿不同晶面之间的差异对吸附Cr(Ⅵ)影响是不可忽略的。
本文以{001}(或{012})为主暴露晶面的赤铁矿纳米晶(HNPs 或HNCs)为吸附剂,通过X 射线衍射(XRD)、扫描电子显微镜(SEM)、透射电镜(TEM)等一系列手段对吸附剂进行了表征,并结合批量吸附实验与DFT 计算,系统地研究了赤铁矿不同晶面对Cr(Ⅵ)的吸附特征。
1 实验部分
1.1 实验试剂
六水合三氯化铁(FeCl3·6H2O)、无水乙醇(C2H5OH),均为国药集团化学试剂有限公司生产;二苯氨基脲(C13H14N4O),上海麦克林生化科技有限公司生产;无水乙酸钠(CH3COONa)、重铬酸钾(K2Cr2O7)、氯化钠(NaCl)、丙酮(CH3OCH3)、盐酸(HCl)、氢氧化钠(NaOH),均为西陇科学化工生产;去离子水,实验室纯水仪制备。所有试剂均为分析纯。
1.2 赤铁矿纳米晶的制备
参考前人合成方法,制备赤铁矿纳米片(HNPs)[20]:取2.703 g 六水三氯化铁(FeCl3·6H2O)溶解于100.0 mL 无水乙醇(C2H5OH)中,用磁力搅拌器进行搅拌,随后依次加入7.0 mL去离子水、8.000 g无水乙酸钠(CH3COONa)。混合后的溶液继续磁力搅拌2 h获得均匀的混合溶液。将此溶液转移至容量为250 mL、内衬材质为聚四氟乙烯的高压反应釜中,将其密封后放置烘箱中以180 ℃保温12 h。室温条件下冷却后将上层清液去除,把沉淀物移至高速离心管中,并用乙醇和去离子水交替洗涤3 次,得到的干净产物放入烘箱中40 ℃烘干12 h。
制备赤铁矿纳米立方体(HNCs)[21]:取2.703 g FeCl3·6H2O 溶解于100.0 mL C2H5OH 中,用磁力搅拌器进行搅拌,随后依次加入25.0 mL去离子水、8.000 g CH3COONa。混合后的溶液继续磁力搅拌2 h 获得均匀的混合溶液。将此溶液转移至容量为250 mL,内衬材质为聚四氟乙烯的高压反应釜中,将其密封后放置烘箱中以180 ℃保温12 h。室温条件下冷却后将上层清液去除,把沉淀物移至高速离心管中,并用乙醇和去离子水交替洗涤3次,得到的干净产物放入烘箱中40 ℃烘干12 h。
烘干后的赤铁矿纳米晶体,过200目(0.074 mm)筛网,取筛下产品最终得到所需要的HNPs和HNCs。
1.3 赤铁矿纳米晶的表征
采用 X 射线衍射仪(XRD,PANalytical Empyream)测定合成样品的物相和结晶度。利用拉曼光谱仪(INVIRAMAN)进一步判定纳米晶物质成分。运用扫描电子显微镜(SEM,ZEISS Sigma 300)和透射电子显微镜(TEM,JEOL JEM-F200)获取样品形貌特征。通过高分辨透射电镜(HR-TEM)判断赤铁矿样品晶格间距和主导晶面等微观信息。采用BET 法通过物理吸附分析仪(Micromeritics ASAP 2460)进行N2吸附-脱附测定,得出样品的比表面积参数。利用Zeta 电位仪(Malvern-Zetasizer Nano S90)测定两种赤铁矿纳米晶的pHZPC。
1.4 批吸附实验
吸附动力学实验:准确称取0.100 g HNPs(或HNCs)于烧杯中,加入100 mL pH=5.0、含Cr(Ⅵ)浓度0.15 mmol/L、背景离子为0.01 mol/L NaCl 的混合溶液,置于298 K 水浴磁力搅拌锅中磁力搅拌,定时取样2 mL,用0.22 μm 水系滤头进行过滤,将滤液稀释一定倍数,采用二苯碳酰二肼分光光度法测定滤液中Cr(Ⅵ)含量。
吸附热力学实验:准确称取0.020 g HNPs(或HNCs)于30 mL 玻璃瓶中,随后向玻璃瓶中加入20.00 mL、pH=5.0、含Cr(Ⅵ)浓度为0.025~0.25 mmol/L、背景离子为0.01 mol/L NaCl 的混合溶液,将玻璃瓶转移至气浴恒温振荡器中,在298、308、318 K 温度下以180 r/min 的速度振荡24 h。振荡结束后取样经0.22 μm 的水系滤膜过滤并稀释合适倍数,用二苯碳酰二肼分光光度法测定滤液中Cr(Ⅵ)含量。
初始pH 影响实验:固定Cr(Ⅵ)初始浓度(0.15 mmol/L),改变吸附体系初始pH(3~9),其余实验操作同吸附热力学实验(298 K)一致。
背景离子浓度影响实验:固定pH=5,改变背景离子(NaCl)浓度(0.01~0.5 mol/L),其余实验操作同吸附热力学实验(298 K)一致。
1.5 模型构建与优化
使用Materials Studio(2019 版)软件(以下简称MS)对吸附模型进行构建与优化[22]。基底引用MS内置数据库中的Fe2O3作为赤铁矿初始构型,随后切割((001)晶面和(012)晶面)、建立真空层(厚度设置为10 Å,1 Å=0.1 nm)、扩胞(2*2*1);吸附质为HCrO4-,置于边长为5 Å的立方单元中。构建好的基底与吸附质选用MS 软件中的CASTEP 模块进行结构优化和高精度单点能计算。吸附模型为结构优化后的基底与吸附质组合。对构建好的吸附初始构型再次进行结构优化和高精度单点能计算。结构优化均采用PBE 交换关联泛函,截断能为340 eV,K 点采样精度设置为fine。高精度单点能计算中电子自洽能量收敛标准设置为10-6eV, 其他参数设置与结构优化一致。
1.6 计算公式与参数
归一化到单位比表面积后,采用准二级动力学模型拟合Cr(Ⅵ)在HNPs 与HNCs 上的吸附动力学数据:
式(1)中:qt为t时刻Cr(Ⅵ)在赤铁矿纳米晶表面的吸附量数值,单位μmol/m2;qe为平衡吸附量数值,单位μmol/m2;ks为准二级动力学模型吸附常数数值,单位m2·min/(μmol)。
归一化到单位比表面积后,采用Langmuir 等温吸附模型拟合Cr(Ⅵ)在HNPs 与HNCs 上的等温吸附数据:
式(2)中:qe为平衡吸附量数值,单位μmol/m2;ce为溶液平衡浓度数值,单位mmol/L;kL为Langmuir 吸附常数,单位L/mmol,qm为最大吸附量数值,单位μmol/m2。
归一化到单位比表面积后,采用Freundlich 等温吸附模型描述Cr(Ⅵ)在HNPs 与HNCs 上的等温吸附数据:
式(3)中:qe为平衡吸附量数值,单位μmol/m2;Ce为溶液平衡浓度数值,单位mmol/L;kF和1/n为吸附系数。
吸附吉布斯自由能、吸附焓及吸附熵的计算公式如下:
式(4)中:K0为吸附标准平衡常数;R为气体常数(8.314 J/mol·K);T为温度;△Gθ为标准吸附吉布斯自由能变;△Hθ为标准吸附焓变;△Sθ为标准吸附熵变。
吸附能计算公式如下:
式(5)中:Ead表示吸附能,EH+Cr表示吸附构型优化后的总能量;EH表示不同晶面赤铁矿的能量;ECr表示吸附质(HCrO4-)的能量。
2 结果与讨论
2.1 赤铁矿纳米晶的性质
首先采用XRD 对合成的赤铁矿(即HNPs 和HNCs)的晶体结构进行表征(见图1)。由XRD 谱图可知,所合成的2 种赤铁矿样品的XRD 衍射峰峰位与赤铁矿物相的标准卡片(JCPDS NO. 33-0664)相一致,说明2种赤铁矿都属于纯相为六方晶系赤铁矿(α-Fe2O3),且两者的XRD 衍射峰均较为尖锐,表明所合成的2种赤铁矿结晶性较好。
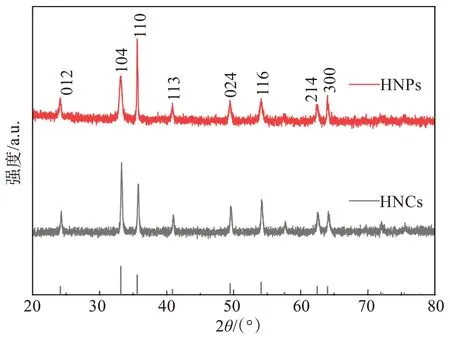
图1 赤铁矿(HNPs、HNCs)的粉晶X-射线衍射图谱Fig. 1 Powder X-ray diffraction diagram of hematite(HNPs and HNCs)
进一步采用拉曼光谱对样品的拉曼峰位进行检测,谱图如图2 所示,在大约225 cm-1和500 cm-1的峰位归属于α-Fe2O3的A1g模式振动,在约245、292、411、609 cm-1的是α-Fe2O3的Eg振动模式,与前人研究报道基本一致[23]。
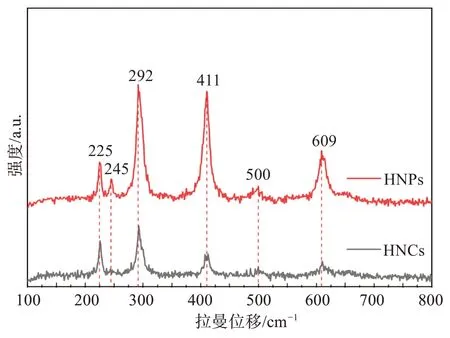
图2 赤铁矿(HNPs和HNCs)的拉曼光谱Fig.2 Raman spectra of hematite (HNPs, HNCs)
运用SEM 和TEM 对2 种赤铁矿纳米晶进行形貌和结构表征。从SEM 像和TEM 图谱(图3(a)和图3(d))显示,所合成的赤铁矿样品的形貌非常规则,其中,HNPs 的形貌为纳米六角片状,HNCs 的形貌为纳米立方体状。HRTEM图谱(图3(c)和图3(f))表明HNPs 晶格条纹间距为0.25 nm,对应赤铁矿(110)晶面,结合晶体学相关知识与快速傅里叶变换(FFT)图像结果,表明HNPs 主暴露面为{001}晶面;纳米立方体状的HNCs 六个基面的晶格条纹间距为0.37 nm,对应赤铁矿(012)晶面,结合晶体学相关知识与其FFT 图像结果,证明HNCs 主暴露面为{012}晶面。
采用BET 测试法得到HNPs 与HNCs 的比表面积分别为19.87 m2/g 和19.57 m2/g。利用Zeta 电位仪测得HNPs与HNCs的pHZPC分别为8.54和8.44。
2.2 赤铁矿纳米晶对Cr(Ⅵ)的吸附动力学
赤铁矿纳米晶(HNPs或HNCs)对Cr(Ⅵ)的吸附动力学结果如图4所示。在前5 min内,两者均对Cr(Ⅵ)进行了快速吸附,吸附量呈直线上升趋势;5 min 至20 min 区间,两者的吸附动力学曲线均缓慢上升;而在20 min 后,两者对Cr(Ⅵ)的吸附均趋于平衡。通过吸附动力学模型拟合发现,HNPs 与HNCs 对Cr(Ⅵ)的吸附符合准二级动力学模型(R2分别为0.971 5、0.983 0),表明2种不同主暴露晶面赤铁矿对Cr(Ⅵ)的吸附动力学受化学吸附控制[24]。
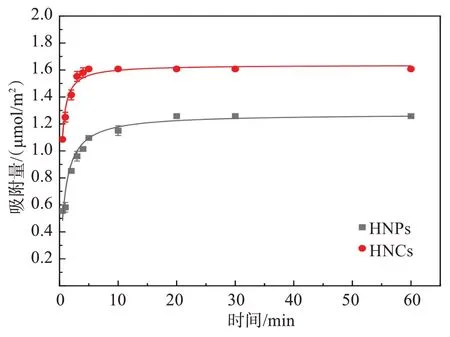
图4 HNPs与HNCs对Cr(Ⅵ)的吸附动力学曲线Fig.4 Adsorption kinetic curves of Cr(Ⅵ)by HNPs and HNCs
2.3 赤铁矿纳米晶对Cr(Ⅵ)的吸附热力学
不同温度下,赤铁矿纳米晶(HNPs 或HNCs)对Cr(Ⅵ)的吸附等温曲线如图5 所示。HNPs 与HNCs对Cr(Ⅵ)的吸附性能均随温度升高而下降。进一步运用Langmuir 和Freundlich 等温吸附模型对HNPs与HNCs 吸附Cr(Ⅵ)的数据进行拟合,拟合结果如表1 所列。HNPs 对Cr(Ⅵ)的吸附更符合Langmuir模型,说明在设定浓度范围内Cr(Ⅵ)在HNPs表面以单层吸附为主[25]。HNCs 对Cr(Ⅵ)的吸附更符合Freundlich 模型,说明Cr(Ⅵ)在HNCs 表面则是以多层吸附为主[26]。相同条件下,HNCs对Cr(Ⅵ)的吸附能力强于HNPs,这是由于HNCs 和HNPs 的主暴露面分别为{012}和{001},{012}表面上的羟基分别以单、三配位形式存在,其活性更高,而{001}面则以双配位的形式存在,使其{001}面为惰性面[27-29]。
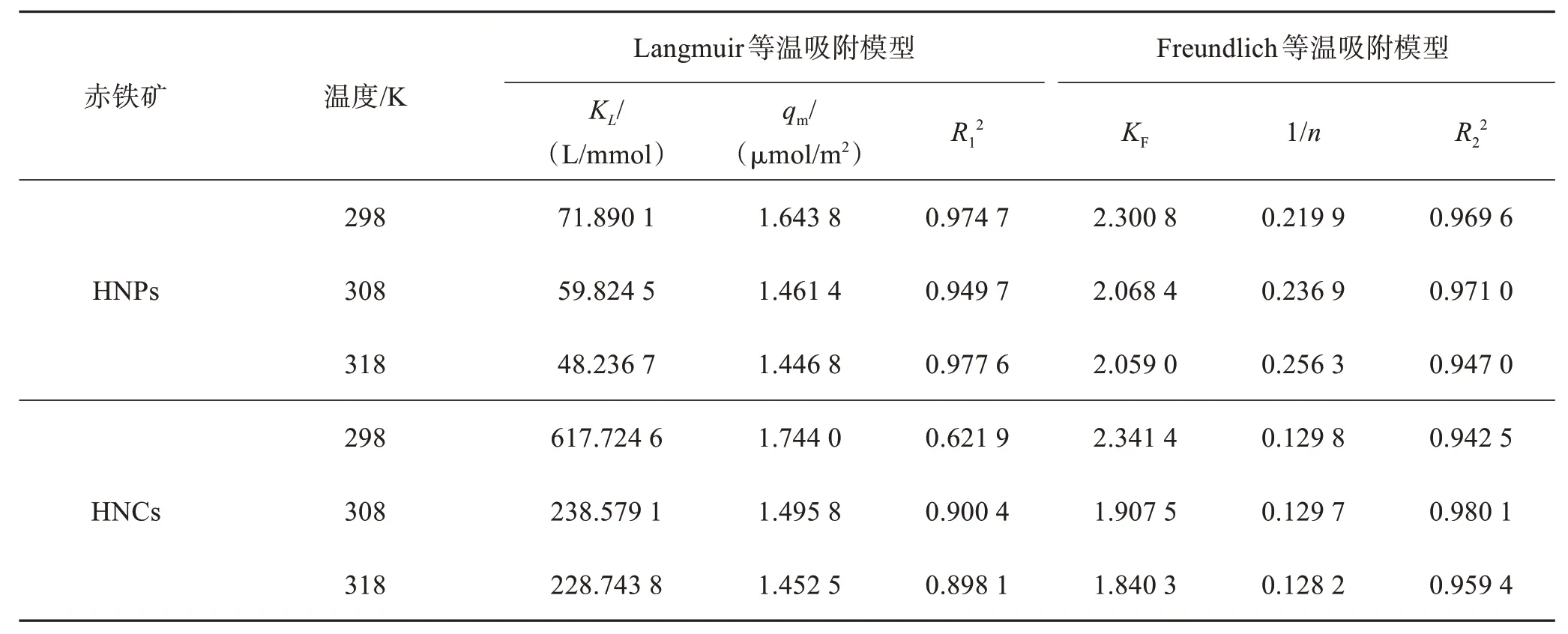
表1 Langmuir与Freundlich等温吸附模型对HNPs与HNCs吸附Cr(Ⅵ)的拟合参数Table 1 Fitting parameters of Langmuir and Freundlich isotherm adsorption model for Cr(Ⅵ) adsorption by HNPs and HNCs
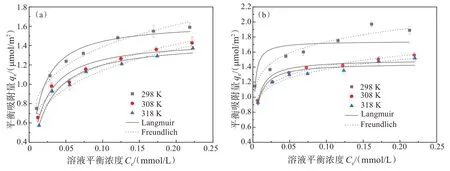
图5 不同温度下HNPs与HNCs对Cr(Ⅵ)的吸附等温线:(a)HNPs ;(b)HNCsFig.5 Adsorption isotherms of Cr(Ⅵ) on HNPs and HNCs at different temperatures:(a) HNPs; (b) HNCs
对两者的吸附热力学参数(见表2)分析发现,Cr(Ⅵ)在HNPs表面上的△Gθ在-28.51~-27.71 kJ/mol其间,在HNCs 表面的△Gθ在-19.88~-19.22 kJ/mol其间,说明HNPs 和HNCs 对Cr(Ⅵ)的吸附均为自发进行的,且吸附过程可能同时存在物理吸附和化学吸附,与前人研究结论相一致[30]。此外,通过对吸附热力学参数分析发现,HNPs 和HNCs 的吸附系数KL和KF均随温度的上升而降低,且△Hθ<0,表明两者吸附Cr(Ⅵ)是放热过程。

表2 HNPs与HNCs吸附Cr(Ⅵ)的热力学参数Table 2 Thermodynamic parameters of adsorption of Cr(Ⅵ) by HNPs and HNCs
2.4 初始pH对赤铁矿纳米晶吸附Cr(Ⅵ)的影响
溶液初始pH 对赤铁矿不同晶面吸附Cr(Ⅵ)的影响如图6 所示。在pH=3~9 之间时,随着pH 的升高,HNPs 和HNCs 对Cr(Ⅵ)的吸附量均逐步降低。在相同pH 时,HNCs 对Cr(Ⅵ)的吸附量均高于HNPs。当pH=3 时,HNCs 和HNPs 对Cr(Ⅵ)的吸附量分别为3.813、3.687 μmol/m2;而当pH=9 时,HNCs 和HNPs 对Cr(Ⅵ)的吸附量分别为0.501、0.372 μmol/m2。这说明两者对Cr(Ⅵ)的吸附受溶液pH 的影响较大。
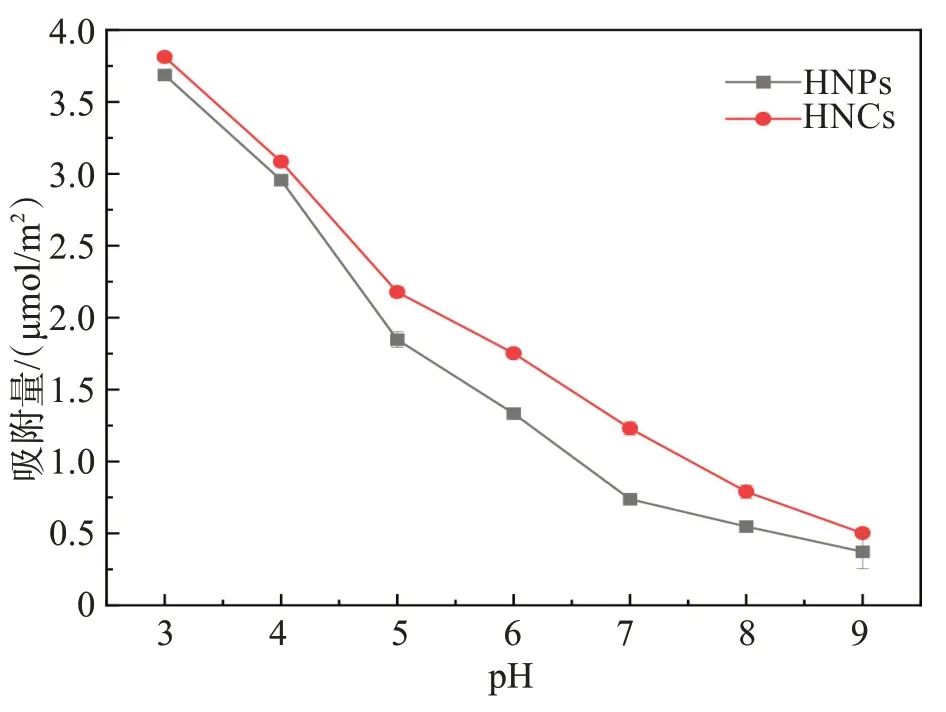
图6 初始pH对HNPs与HNCs吸附Cr(Ⅵ)的影响Fig.6 Effect of initial pH on the adsorption of Cr(Ⅵ) by HNPs and HNCs
当溶液pH 小于赤铁矿的pHZPC时,HNPs 与HNCs表面均发生质子化,且两者表面所带正电荷随pH 减小而增多,进而有利于其对Cr(Ⅵ)的静电吸附。有研究表明[31],HNCs 的{012}晶面具有单、三配位羟基,而HNPs 的{001}晶面则以双配位(惰性位点)羟基为主。当pH <pHZPC时,HNCs 的正电荷密度比HNPs 高,故在相同pH 条件下,HNCs 对Cr(Ⅵ)的吸附能力强于HNPs。当pH>pHZPC时,赤铁矿纳米晶呈负电性,不利于其以静电吸附形式吸附Cr(Ⅵ),但HNPs 和HNCs 对Cr(Ⅵ)仍有少量吸附,说明2 种赤铁矿纳米晶体对Cr(Ⅵ)不仅存在静电吸附,还有化学吸附(表面络合)。进一步采用Visual MINTEQ 3.1软件获取溶液中Cr(Ⅵ)形态(见图7)。当pH 从3 增至9 时,溶液中Cr(Ⅵ)的形态从以HCrO4-为主逐渐变为以CrO42-为主。与HCrO4-相比,CrO42-吸附需要2 个吸附位,而HCrO4-吸附只需一个吸附位[32],故2 种赤铁矿纳米晶对Cr(Ⅵ)的吸附量均随着pH的升高而逐渐减少。

图7 吸附体系中Cr(Ⅵ)存在形态与pH关系分布Fig.7 Distribution of Cr(Ⅵ) existing form and its relationship with pH in the adsorption system
2.5 离子强度对赤铁矿纳米晶吸附Cr(Ⅵ)的影响
理论上,Cr(Ⅵ)吸附在赤铁矿表面可通过表面络合形成内圈配位模式,也可通过静电作用力形成外圈配位模式。由于外圈配位模式容易受到离子强度的影响,而内圈配位模式不容易受到离子强度的影响[33-34],所以通过改变离子强度可以确定Cr(Ⅵ)在赤铁矿表面的吸附模式(图8)。当离子强度从0.01 mol/L 增大至0.1 mol/L 时,HNPs 对Cr(Ⅵ)的吸附量几乎不受影响,而HNCs 对Cr(Ⅵ)的吸附量明显降低,说明HNPs对Cr(Ⅵ)的吸附主要以表面络合为主,而HNCs 对Cr(Ⅵ)的吸附同时存在静电吸附和表面络合。当离子强度进一步增至0.5 mol/L 时,HNPs与HNCs在Cr(Ⅵ)初始浓度低时(<0.15 mmol/L)对Cr(Ⅵ)的吸附量均减小,可能由于随着离子强度的增加,吸附剂表面活性位点可能被背景离子Cl-占据,导致两者对Cr(Ⅵ)的静电吸附作用下降;与此同时,HNPs 与HNCs 在Cr(Ⅵ)初始浓度高时(>0.15 mmol/L)对Cr(Ⅵ)的吸附量均增大,可能是吸附剂表面的双电层结构被压缩[35],溶液中Cr(Ⅵ)浓度越高,Cr(Ⅵ)越容易穿过双电层与吸附剂表面形成表面络合。
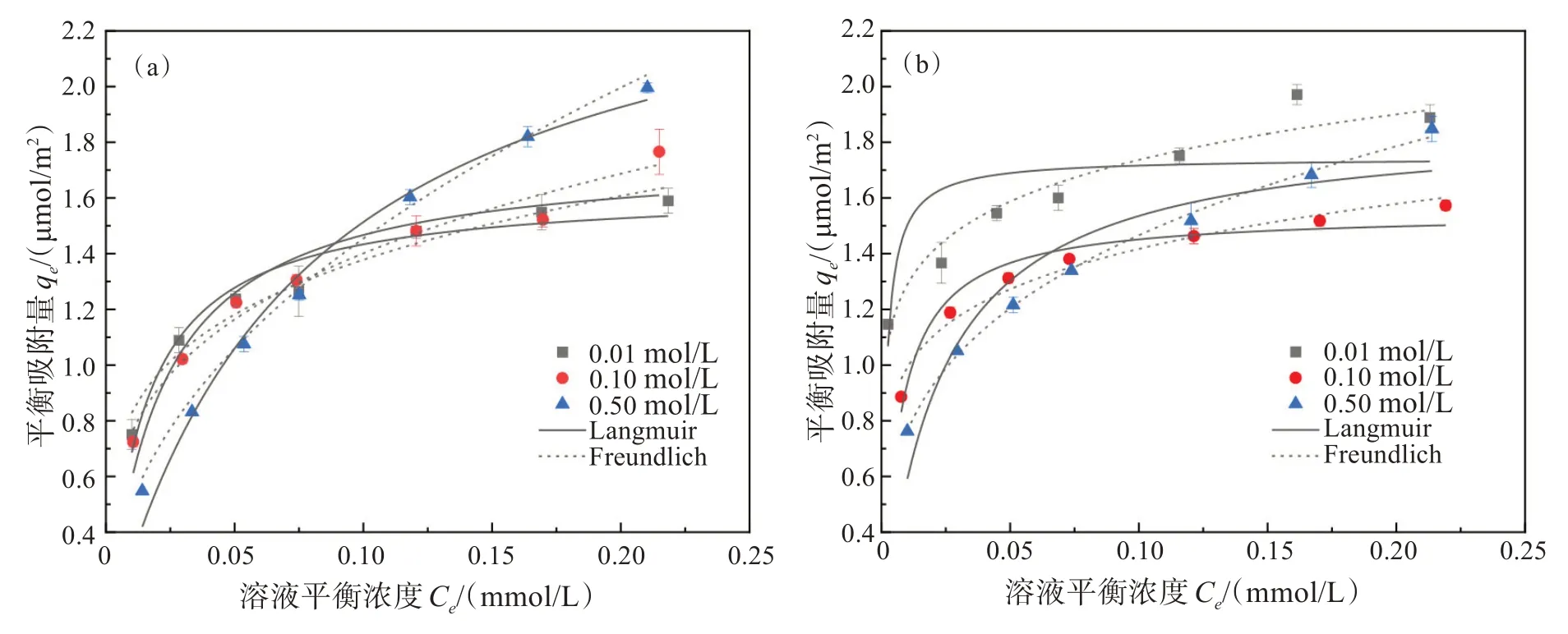
图8 不同浓度NaCl对HNPs与HNCs吸附Cr(Ⅵ)的影响: (a)HNPs ;(b)HNCsFig.8 Effect of different concentrations of NaCl on the adsorption of Cr(Ⅵ) by HNPs and HNCs: (a) HNPs; (b) HNCs
2.6 赤铁矿纳米晶对Cr(Ⅵ)的吸附构型
HNPs 表面({001}晶面)与HNCs 表面({012}晶面)吸附Cr(Ⅵ)(以HCrO4-为主)的构型经MS 软件中CASTEP 模块优化后如图9 所示。Cr(Ⅵ)在赤铁矿{001}晶面上形成单齿单核吸附构型,而在{012}晶面上形成双齿双核吸附构型。造成吸附构型差异的原因可能是赤铁矿不同晶面所暴露相邻配位不饱和Fe原子的距离不一样[10]。通过吸附能计算可知,HNPs吸附能为-23.05 kJ/mol, HNCs 吸附能为-45.15 kJ/mol。两者吸附能均为负值,说明吸附均为热力学自发过程[36],这与上述热力学实验结果(见本文2.3 节)相符。
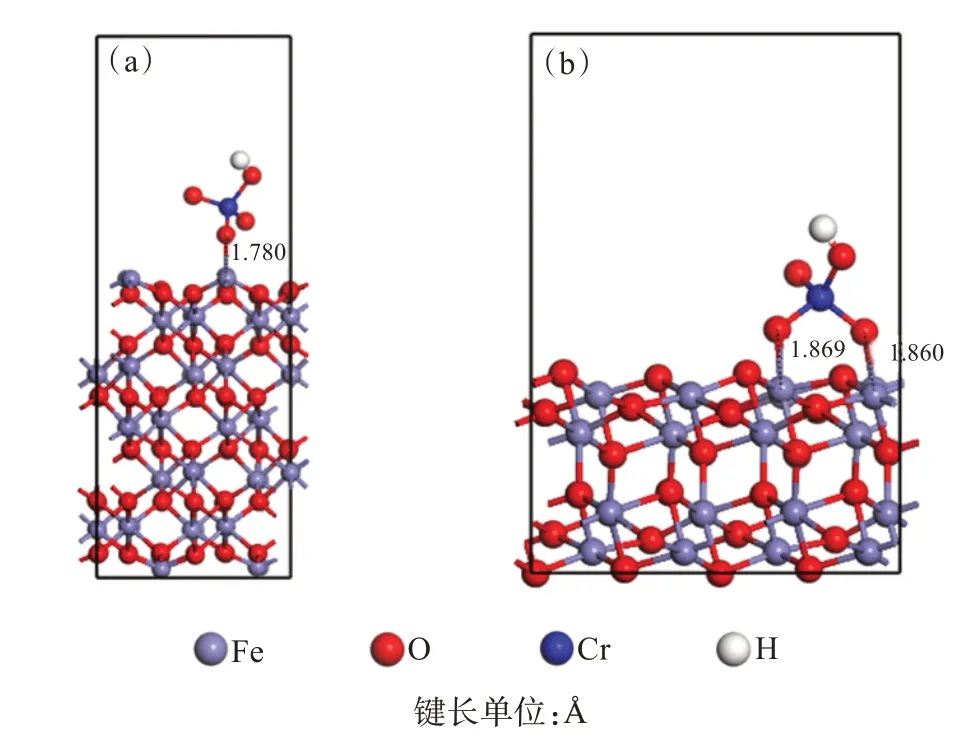
图9 HNPs与HNCs吸附HCrO4-优化后构型:(a)HNPs;(b)HNCsFig.9 Optimized configuration of HNPs and HNCs adsorbing HCrO4- :(a) HNPs;( b) HNCs
3 结 论
1)采用水热法成功合成以{001}为主暴露晶面的赤铁矿纳米片(HNPs)及以{012}为主导晶面的赤铁矿纳米立方体(HNCs)。
2)HNPs 和HNCs 对Cr(Ⅵ)的吸附动力学符合准二级动力学模型。HNPs 对Cr(Ⅵ)的吸附等温线符合Langmuir 等温吸附模型,HNCs 对Cr(Ⅵ)的吸附等温线符合Freundlich 等温吸附模型,两者吸附过程均为自发且放热过程,温度升高不利于吸附的进行。相同条件下,HNCs 对Cr(Ⅵ)的吸附能力强于HNPs。
3)HNPs对Cr(Ⅵ)的吸附模式为表面络合,推测其表面吸附构型为单齿单核;HNCs对Cr(Ⅵ)的吸附模式为表面络合和静电吸附共存,推测其表面吸附构型为双齿双核。
不同晶面的赤铁矿对Cr(Ⅵ)具有不同的吸附模式,导致吸附性能具有差异性,Cr(Ⅵ)在赤铁矿{012}晶面形成的双齿双核吸附模式具有更高的吸附量。因此,可以通过合成特定暴露高活性晶面的赤铁矿来提高其对环境中Cr(Ⅵ)等重金属离子的吸附性能,为重金属污染修复提供新思路。

