液相色谱-质谱/质谱法测定植物源性食品中2,4-D 残留量
张远芳,江涛,万建春
(1.江西泉谷科技有限公司,江西南昌,330038;2.南昌海关技术中心,江西南昌,330038)
0 引言
2,4-D(2,4-Dichlorophenoxyacetic acid),又名2,4-D酸、2,4-二氯苯氧乙酸,是一种人工合成的植物生长剂,同时也是一种广泛使用的苯氧羧酸类除草剂[1]。2,4-D 属低毒除草剂,渗透力强,易进入植物体内,但不易被雨水冲刷去除,使用后易于在植物体内形成残留[2],易对人体健康和环境造成危害,因此许多国家都对其规定了严格的残留限量。我国也在《食品安全国家标准 食品中农药最大残留限量》(GB 2763—2021)[3]中规定了其在谷物、蔬菜、水果及食用菌等中的最大残留限量,如规定谷物中2,4-D 的最大残留限量范围为0.01 mg/kg~2 mg/kg,以高粱为例,最低为0.01 mg/kg;蔬菜中最大残留限量范围为0.05 mg/kg~0.5 mg/kg,以玉米笋为例,最低为0.05 mg/kg;水果中2,4-D 最大残留限量范围为0.01 mg/kg~1 mg/kg,以仁果类水果为例,最低为0.01 mg/kg;食用菌2,4-D 最大残留限量为0.1 mg/kg。
目前适用于谷物、蔬菜、水果及食用菌的标准方法主要有《粮食和蔬菜中2,4-滴残留量的测定》(GB/T 5009.175—2003)[4]。《出口水果中2,4-滴残留量检验方法》(SN/T 0152—2014 )[5]为气相色谱法,气相色谱法在前处理时多需要对样品进行衍生,较为复杂和费时。《蔬菜中2,4-D 等13 种除草剂多残留的测定 液相色谱质谱法》(NY/T 1434—2007)[6]为液相色谱质谱法,适用基质仅为蔬菜。除标准方法外,虽然其他文献对2,4-D 残留量的检测方法也多有报道[7-11],但测定基质较为单一,包含了对谷物、蔬菜、水果及食用菌多种植物源性食品基质中2,4-D残留量测定的方法报道较少。本文建立了利用高效液相色谱串联质谱法检测植物源性食品中包含谷物、蔬菜、水果、食用菌中2,4-D 残留量的分析方法,本方法灵敏度高,前处理较为简便且定量限为10μg/kg,回收率良好,可以满足《食品安全国家标准 食品中农药最大残留限量》(GB 2763—2021)中关于谷物、蔬菜、水果及食用菌中2,4-D 最大残留限量(谷物、蔬菜、水果及食用菌品类中2,4-D的最大残留限量的最低值0.01mg/kg)的规定。
1 试验部分
1.1 仪器设备
高效液相色谱-串联质谱联用仪:配有电喷雾(ESI)离子源(美国AB Sciex 公司),配Agilent 1200 高效液相色谱仪;分析天平(德国Sartorius 公司,感量0.1 mg,0.01 g);旋涡混合器(德国IKA 公司);超声波仪(昆山市超声仪器有限公司);冷冻高速离心机(德国Eppendorf 公司);振荡混合器(常州国宇仪器制造有限公司);氮吹浓缩仪(美国Organo-matian Associates 公司);固相萃取装置(美国Supelco 公司)。

图1 各基质样品标准溶液色谱图
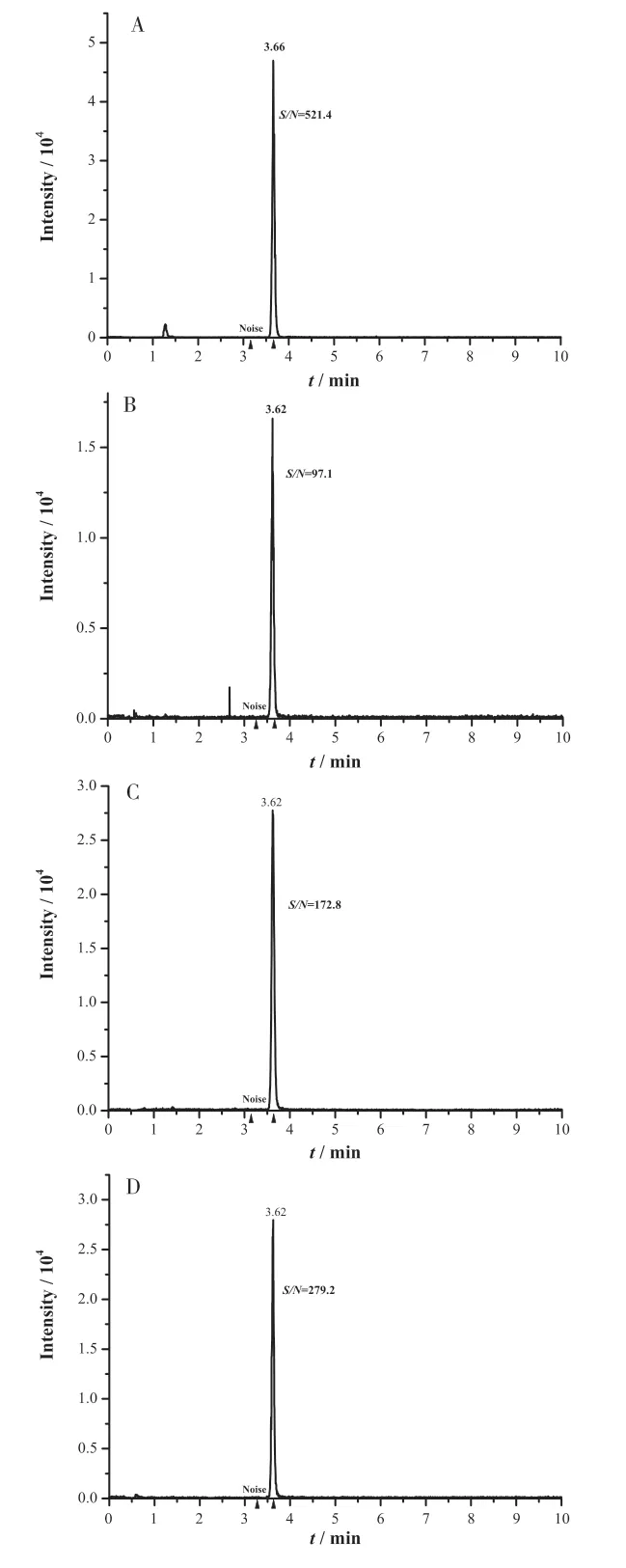
图2 各类别样品添加浓度为10.0 µg/kg 质控样品定量离子S/N结果图
1.2 试剂材料
乙腈(色谱纯,德国Merck 公司);乙酸乙酯(色谱纯,美国TEDIA 公司);2,4-D(纯度99.0%,CAS号:94-75-7,德国Dr.Ehrenstorfer 公司);盐酸(分析纯,国药集团化学试剂有限公司);甲酸(色谱纯,上海安谱公司);氢氧化钠(分析纯,国药集团化学试剂有限公司);甲醇(色谱纯,德国Merck 公司);Oasis MAX 柱(500mg/6mL,美国Waters 公司,使用前依次用5mL 甲醇和5mL 水活化,且保持柱体湿润);针式滤头(0.22 μm 水相,天津津腾);配制溶液的水均为GB/T 6682—2008 规定的一级水。
1.3 标准溶液及试剂配制
2,4-D 标准储备液(1.0mg/mL):准确称取10.0mg 2,4-D 标准物质于10mL 容量瓶中,加入甲醇超声溶解后,再用甲醇定容至10mL。氢氧化钠溶液(10 mol/L):准确称取400.0g 氢氧化钠固体于1L 容量瓶中,加入水溶解后,定容至1L,转移至塑料瓶中储存备用。甲酸甲醇溶液(2%):准确量取2mL 甲酸和98mL 甲醇,混匀后备用。1mol/L 盐酸:准确移取90mL 盐酸溶液至1L容量瓶中,加入水混匀后,定容至1.0L,备用。1mol/L氢氧化钠溶液:准确移取50mL 浓度为10mol/L 氢氧化钠溶液至500mL 容量瓶中,加水混匀后,定容至刻度,摇匀,备用。
1.4 样品前处理方法
称取谷物试样1 g,水果、蔬菜、食用菌试样5 g,置于50 mL 具塞聚乙烯离心管中,加入5 mL 浓度为1 mol/L 盐酸于漩涡混合器上涡动30 s 后,加入20 mL 乙酸乙酯,涡匀,置于振荡混合器中振荡10 min,离心,取上清液置于另一套50 mL 具塞聚乙烯离心管中,残渣重复提取一遍,合并上清液,氮气吹干。5 mL 浓度为1 mol/L 氢氧化钠溶液溶解残渣,涡旋混匀,离心,上清液过MAX 柱(水果、谷物、食用菌全部过柱,蔬菜取2.5 mL 过柱),再依次用5 mL 水和5 mL 甲醇淋洗,10 mL 2%甲酸甲醇洗脱,40 ℃氮气吹干,1 mL水定容,经0.22 μm 水系针式滤头过滤后,用液相色谱串联质谱仪测定。
1.5 测定方法
色谱柱:Phenomenex Luna C8 柱,50mm×2.0 mm(i.d),3.0 μm;柱温35 ℃;流速0.3 mL/min;流动相A 为乙腈,B 为0.1%甲酸;以65%流动相A 及35%流动相B 等度洗脱;进样20 µL;电喷雾离子源;负离子扫描;检测方式为多反应监控(MRM);离子源温度400 ℃;气帘气压力(CUR)10 psi;雾化气(Gas1)55 psi;辅助气(Gas2)55 psi;喷雾电压(IS)3500 v;其他质谱参数见表1。

表1 质谱参数
2 结果与讨论
2.1 样品前处理方法的优化
2.1.1 提取方法的优化
相对于单一基质,多种基质样品的提取既要考虑到各基质中目标化合物的提取效果,避免不同基质中的杂质,又要考虑能否将提取方法整合统一,适用于多种基质。首先考虑目标化合物2,4-D 属于苯氧羧酸类除草剂,易溶于水,化学结构中含羧酸基功能团,在碱性条件下易离解成盐,降低在有机相中的溶解度,因此在提取时需要加入适量的酸以抑制其电离,从而容易被有机相提取。有文献研究以稻米基质为例,在盐酸-乙腈提取体系中,盐酸浓度高于0.1 mol/L 时,苯氧羧酸类除草剂回收率大于80%[8],以水果基质为例,用盐酸调节样品溶液的pH 值,当pH 值为在2.0~3.0 时,大部分苯氧羧酸类除草剂的回收率集中在80%~100%[9]。其次是在选择合适的有机提取试剂上,有研究比较了2,4-D 在正己烷、甲醇、二氯甲烷、乙酸乙酯中的溶解度及萃取时的杂质情况,以乙酸乙酯较好[10]。最后综合上述研究结果及各基质间的差异,本方法采用以盐酸酸化,再以乙酸乙酯为提取试剂的提取方式进行各基质样品的提取,同时结合实际试验时对各基质调节pH 的具体情况,最终确定酸化时加入的盐酸的浓度及体积。
2.1.2 净化方式的优化
在净化方式上,由于本方法涵盖了多种基质样品,因此可能面临经提取后大量杂质同时被提取出来,导致成分多、检测干扰大的问题,固相萃取可以在复杂样品溶液经过萃取柱中吸附剂时,通过吸附剂的极性相互作用、疏水作用或离子交换等作用选择性地对样液中的成分进行吸附,再进行选择性洗脱,从而很好地实现对复杂样品的分离、纯化和富集。2,4-D 属酸性物质,因此可以考虑采用阴离子交换柱。另有文献研究报道[11],以大豆基质为例,采用Oasis MAX 柱进行净化,试验结果的回收率均在70%以上,因此考虑采用Oasis MAX 柱进行净化。另外为了更好地提升回收率,从两方面对净化条件进行了优化改进,一是为了更好地促进离子交换,本方法采取了对提取后氮吹干的残渣加入氢氧化钠溶液进行适当碱化的操作;二是为了更好的洗脱效果,对洗脱液进行了改进。经试验考察验证,最终确定了本方法采取的净化条件。
2.2 测定仪器的选择
目前检测2,4-D 的主要方法有气相色谱-质谱联用法、气相色谱法、高效液相色谱法、液相色谱-质谱联用法等,其中采用气相色谱-质谱联用法、气相色谱法分析时需要对样品溶液进行衍生化处理。高效液相色谱法、液相色谱-质谱联用法相比于前两种方法具有操作简便的优势[12]。高效液相色谱串联质谱法融合了前处理操作相对较简便,灵敏度高,定性定量更准确等多种优点,因此本研究采取高效液相色谱串联质谱法进行测定。
2.3 色谱-质谱调节的优化
2.3.1 色谱条件的选择
对于多种基质中2,4-D 的分离,本实验通过比较,选择采用以乙腈-0.1%甲酸为流动相,Phenomenex Luna C8 柱(50 mm×2.0 mm,3.0 μm)分离。结果各基质中目标物2,4-D 色谱峰分离良好,峰形尖锐。各基质样品的标准溶液色谱图如图1 所示。
2.3.2 质谱条件的优化
本实验对1 µg/mL 的2,4-D 标准溶液进行全扫描,并结合其理化性质,在Q1MS(Q1)模式下确定母离子,在Product Ion(MS2)模式下选定2 个丰度较高、干扰较少的子离子分别作为定性和定量离子,其中响应较高者作为定量离子,并依次对各子离子的去簇电压(DP)、碰撞气能量(CE)、入口电压(EP)及碰撞室出口电压(CXP)进行优化,优化后的参数见1.5 测定方法部分的表1。
2.4 定量限
对各类别样品取1 倍添加浓度10.0µg/kg 质控样所得的MRM 色谱图进行处理,得到的定量离子S/N 结果如图2,其结果S/N 均远大于10,满足定量限要求。本方法定量限可达到10µg/kg(样品定容至1mL 的信噪比结果)。
2.5 标准曲线绘制、线性相关系数及回归方程
用各类别基质提取液将标准工作液稀释得到表2 中标准曲线浓度范围的标准溶液,浓度由低到高进样检测,以基质标准溶液浓度为横坐标,以峰面积为纵坐标绘制校正曲线。所得标准曲线线性关系良好,相关系数均大于0.99,各相关系数及线性回归方程见表2。

表2 水果、蔬菜、谷物、食用菌各基质标准曲线相关系数及线性回归方程

表3 水果、蔬菜、谷物、食用菌基质中2,4-D 残留量回收率及精密度数据
2.6 回收率与精密度
在水果、蔬菜、谷物、食用菌基质中均添加2,4-D 10/20/40μg/kg,3 个浓度水平,每个浓度水平进行6 次平行试验,计算添加回收率及精密度。回收率及精密度数据见表3。从表中可以看出回收率范围为80.9%~118%,精密度范围为2.3%~12.7%,满足分析要求。
3 结论
本文以植物源性食品包含水果、蔬菜、谷物及食用菌为基质,建立了利用高效液相色谱串联质谱法检测植物源性食品中包含谷物、蔬菜、水果、食用菌中2,4-D残留量的分析方法。本方法覆盖植物源性样品基质种类较多,灵敏度高,前处理较为简便,且定量限、线性相关系数、回收率及精密度均能满足检测需求,可以用于植物源性食品中包含水果、蔬菜、谷物、食用菌中2,4-D 残留量的检测。

