三种常见先天性长QT综合征的基因突变特点及致病性评估流程
杨 英 张 萍 吕婷婷
(1.三峡大学 第一临床医学院[宜昌市中心人民医院]心血管内科 &三峡大学 心血管疾病研究所,湖北 宜昌 443003;2.清华大学 医学院,北京 100084;3.清华大学 附属北京清华长庚医院 心内科,北京 102218)
先天性长QT 综合征(long QT syndrome,LQTS)是一类编码心脏离子通道(钠、钾、钙)或离子通道调节蛋白的基因突变,导致心脏复极延迟,QT间期延长,以尖端扭转型室速、室颤、晕厥甚至猝死为主要表现的一组常染色体遗传病。LQTS的发病率约为1:2 000,多见于青少年,是青少年猝死的主要原因[1]。根据遗传方式不同,LQTS可分为常染色体显性遗传和隐性遗传的综合征,后者常伴有先天性耳聋。因为LQTS 的基因型与临床表型的一致性较好,临床中常根据致病基因不同进行分型,目前发现至少有17个亚型,以LQT1~3型最常见,占LQTS的75%~80%,其中LQT1占35%~40%,LQT2占25%~30%,LQT3 占10%~15%[2-4]。在我国,以LQT2最常见,其比例可高达52%[5]。
基因突变包括点突变、移码突变、插入/缺失突变和剪接突变,LQTS的基因突变以点突变最常见。近年来,国内外学者在三种常见的LQTS 患者中相继发现了近千个突变位点,其中有10%~20%的突变不影响所编码蛋白质的功能,即“假阳性”突变,不能用于指导LQTS 的危险分层、临床治疗和预后分析[2-4]。近年来,研究者们陆续验证了LQTS突变基因的电生理功能,寻找突变基因的致病规律,筛选出“假阳性”突变,探索LQTS突变基因的功能评估流程,为临床快速识别致病突变提供新思路。本文就上述研究的最新进展进行综述。
1 三种常见LQTS的基因突变特点
1.1 LQT1
心脏缓慢激活延迟整流钾通道(slowly activated delayed rectifier potassium current,IKs)由KCNQ1基因编码的4 个α亚单位和KCNE1 基因编码的2个附属β亚单位组成,α亚单位有676个氨基酸,包含N 末端、C末端及跨膜区(6次跨膜的核心区和1个成孔区),其中N 末端和C 末端均在胞浆侧,LQT1是编码α亚单位的KCNQ1基因突变所致。
LQT1患者检测KCNQ1 基因的6 个大规模临床研究汇总分析发现,244个突变位点中,55%位于跨膜区,39%位于C末端,6%位于N 末端,致病性风险得分从高到低依次为跨膜区、C 末端和N 末端,进一步分析发现C 末端子单元(subunits assembly domain,SAD)区(589-620氨基酸)突变的致病性强,其风险估计预测值(estimated predictive values,EPVs)为100%(95%CI: 64%,100%)[3,6]。上述研究结果提示,跨膜区和C 末端SAD 区的突变率和致病风险均最高,应高度警惕上述位置的突变。一项纳入278例LQTS的研究[7]发现,LQT1男性患者在青春期后的QTc间期开始缩短,在12 岁后出现QTc间期明显短于女性患者,提示LQT1发生心律失常的风险不仅与基因突变位置有关,还与性别、年龄相关。此外,也有研究发现,KCNQ1 的常见突变还存在地域差异,南非人群的常见突变A341V 位于KCNQ1的第6次跨膜区,致病性强,患者猝死风险高[8];日本最常见的突变为A344spl,致病性中等[9];瑞典和芬兰的常见突变分别为Y111C和G589D,致病性较弱,心脏事件的发生率低[10-11]。然而,截至目前,我国关于LQT1突变基因的报道多为个案报道或小样本研究,KCNQ1在亚洲人群中的突变规律、致病规律及其与地域、性别、年龄等因素的关系尚无大规模、多中心研究数据报道。
1.2 LQT2
快速激活延迟整流钾通道的结构与IKs相似,α亚单位由KCNH2基因编码,含有1 159个氨基酸,LQT2是编码α亚单位的KCNH2基因突变所致。
我国LQT2发病率为52%,高于LQT1(44%)[5]。LQT2患者检测KCNH2基因的6 个大规模临床研究发现了337个突变位点,跨膜区、C 末端及N 末端的突变比例分别为36%、33%及31%,致病性风险得分最高的是跨膜区。进一步分析发现,C末端环状核苷酸结合域(cyclic nucleotide-binding domain,cNBD)区(742-842 氨基酸)和N 末端PAS/PAC 区(41-70/92-144氨基酸)突变致病性强,其EPVs分别为100%(95%CI: 58%,100%)和100%(95%CI:48%,100%)[4,6],提示KCNH2跨膜区的突变率和致病风险均较高,C 末端和N 末端突变率和致病风险相当,但应特别注意C末端cNBD 区及N 末端PAS/PAC区突变的高致病性。一项纳入278例LQTS的研究发现,LQT2男性患者在青春期前QTc间期进行性延长,在青春期开始后QTc间期缩短;在5岁之前和14~26岁,LQT2男性患者的QTc间期明显短于女性患者,而在5~14岁男性患者的QTc间期明显长于LQT2 女性患者[7]。在另一项纳入154 例QTc间期正常的LQT2 患者的研究中也发现,KCNH2成孔区突变发生心脏事件的风险高于其他区域,且成年女性发生心脏事件的风险明显高于男性(HR=4.09,95%CI: 1.89,8.81,P<0.001)[12]。此外,对316 例LQT1 和LQT2 芬兰儿童平均随访12年,未发生心脏性死亡事件,并且芬兰儿童心脏事件的发生率明显低于其他患者[13]。上述研究结果提示,LQT2患者发生心脏事件的风险不仅与基因突变位置、性别、年龄和生长发育有关,还可能与地域和人种有关,应特别重视青春期后女性患者的管理。
1.3 LQT3
电压门控钠通道由孔道蛋白α亚单位和调节蛋白β亚单位组成,α 亚单位由SCN5A 基因编码的2016个氨基酸组成,其结构较钾通道更复杂,除胞浆侧的N 末端和C 末端外,还有四个跨膜区和三个区间连接器,LQT3是编码α亚单位的SCN5A 基因突变所致。
Kapplinger等[2]对2 888例LQT3患者的基因检测结果分析发现,SCN5A 最常见的突变位点位于Ⅲ~Ⅳ区间连接器(DⅢ/DⅣ),其次是跨膜区的第三至第六次跨膜及第五至第六次跨膜间连接(S3-5+S6)。致病风险分析发现,DⅢ/DⅣ突变的致病风险最高,其EPVs为95%(95%CI: 78%,99%),其次为跨膜区的S3-5+S6,其EPVs 为90%(95%CI:79%,95%),该区常见突变为V411M(DⅠ-S6)、R1623Q(DⅣ-S4)和I1768V(DⅣ-S6),剩余区域的致病风险较低,EPVs为47%(95%CI: 26%,62%)。日本一项纳入116例LQT3患者的多中心回顾性分析发现,SCN5A 跨膜区的S5+S6发生突变,最易发生恶性心律失常事件(HR=4.2,95%CI: 2.09,8.36,P<0.001),且未发现明显的性别差异[7]。此外,SCN5A 突变还可表现为其他类型的心律失常,如Brugada综合征、心脏传导阻滞和窦房结功能不全等。E1784K 为SCN5A 的最常见突变,在SCN5AE1784K 突变阳性患者中发现LQT3、Brugada综合征、心脏传导阻滞及窦房结功能不全[14],这提示当QTc延长、Brugada综合征、心脏传导阻滞和窦房结功能不全等出现家族聚集现象时,应高度警惕SCN5A 突变可能。
2 三种常见LQTS的“假阳性”突变
2011年美国心律学会和欧洲心律学会在《心脏离子通道病与心肌病基因检测专家共识》中指出,经心脏病专家诊断或高度怀疑的LQTS患者均应进行KCNQ1、KCNH2 和SCN5A 基因检测[15]。随着基因检测技术的发展,LQTS基因检测数据的完善,研究者发现,既往报道的LQTS突变基因中,有10%~20%为非致病性突变,即“假阳性”突变[2-4]。主要原因在于,既往研究中,对照组样本量过小,人群数据库更新不及时,错误地把人群中不影响蛋白质结构和功能的背景突变当作LQTS 的致病突变。因此,筛选出LQTS的“假阳性”突变,对疾病的诊断、治疗及预后评估具有重要意义。Ackerman等[15]通过汇总分析LQTS的大规模基因检测数据,以基因组聚合数据库中人群序列为对照组,利用突变基因所出现的频率及8个生信预测软件进行初筛,意义不明确的突变用全细胞膜片钳技术进一步行电生理功能验证,结果发现,LQT1 中有32 个“假阳性”突变,LQT2 中22个,LQT3中8个,详见表1。

表1 三种常见LQTS中已明确的“假阳性”突变
对不明原因猝死的婴儿进行SCN5A 基因检测发现了31个突变,经预测有23个为“假阳性”突变,但未进行功能验证[16]。此外,在7 244 例LQT1-17的全外显子测序中也发现,LQTS相关基因突变为背景突变的比例可能会更高[17]。综上所述,LQTS 基因突变为“假阳性”突变的比例可能高于10%~20%,目前筛选验证的“假阳性”突变只是冰山一角,具体到不同年龄、性别及不同种族的患者是否适用,尚需进一步验证。
3 三种常见LQTS突变基因的致病性评估流程
鉴于LQTS相关基因突变存在“假阳性”突变可能,尤其是错义突变可能漏判或误判,而对每一个新发现的突变基因进行电生理功能验证,耗时长、成本高、技术条件受限,不利于疾病的快速诊断。因此,探索LQTS突变基因的致病性评估流程,对突变基因的功能评估及疾病的快速诊断具有重要意义。Kapplinger等[2]通过总结LQTS基因检测数据,结合实验室经验,探索出SCN5A 阳性突变的诊断流程,如图1所示。

图1 SCN5A 突变的致病性评估流程[2]
该流程中SCN5A 突变基因的致病性风险评估主要包括四步:首先,确定突变是否为激进突变;其次,确定该突变在正常人中是否表达及在LQTS 患者中是否过表达;若前两步无法确定其致病性,则进一步行SCN5A 蛋白的拓扑学分析;最后,对于蛋白拓扑学分析尚无法确定其致病性者,使用生信分析预测软件进行评分;经上述四步仍然无法确定该突变是否致病时,应再次结合患者病史、家族史、心电图等资料评估LQTS的诊断是否成立。
Kapplinger等[2-4,18-21]使用的生信分析预测软件包括Ortholog、Paralog、Grantham、SIFT、Mutation Assesor、PolyPhen2、Condel和KvSNP,每个工具评分为0分或1分,1分提示该突变可能致病,多个评估工具得分相加,根据总分预测致病风险。SCN5A突变风险评估使用前7种评估工具,以4分为界值,若总分≥4 分提示致病可能性大[2]。在Clemens等[3]和Mattivi等[4]关于KCNQ1和KCNH2突变基因致病风险预测中,运用前述8种预测工具,以总分为6~8分提示KCNQ1突变可能致病,而总分为8分提示KCNH2 突变可能致病,如图2、图3 所示。且在Giudicessi等[22]对KCNQ1和KCNH2突变基因进行鉴定时,使用UCSC Conservation、Grantham、SIFT、PolyPhen2四种评估工具,若总分≥3分提示致病可能性大。综上所述,目前,LQTS突变基因的致病性评估流程尚不完善,不同实验室和不同疾病使用预测软件的种类和数量不同,评分标准也不统一,且敏感性和特异性未知,尚无法很好地用于指导临床。
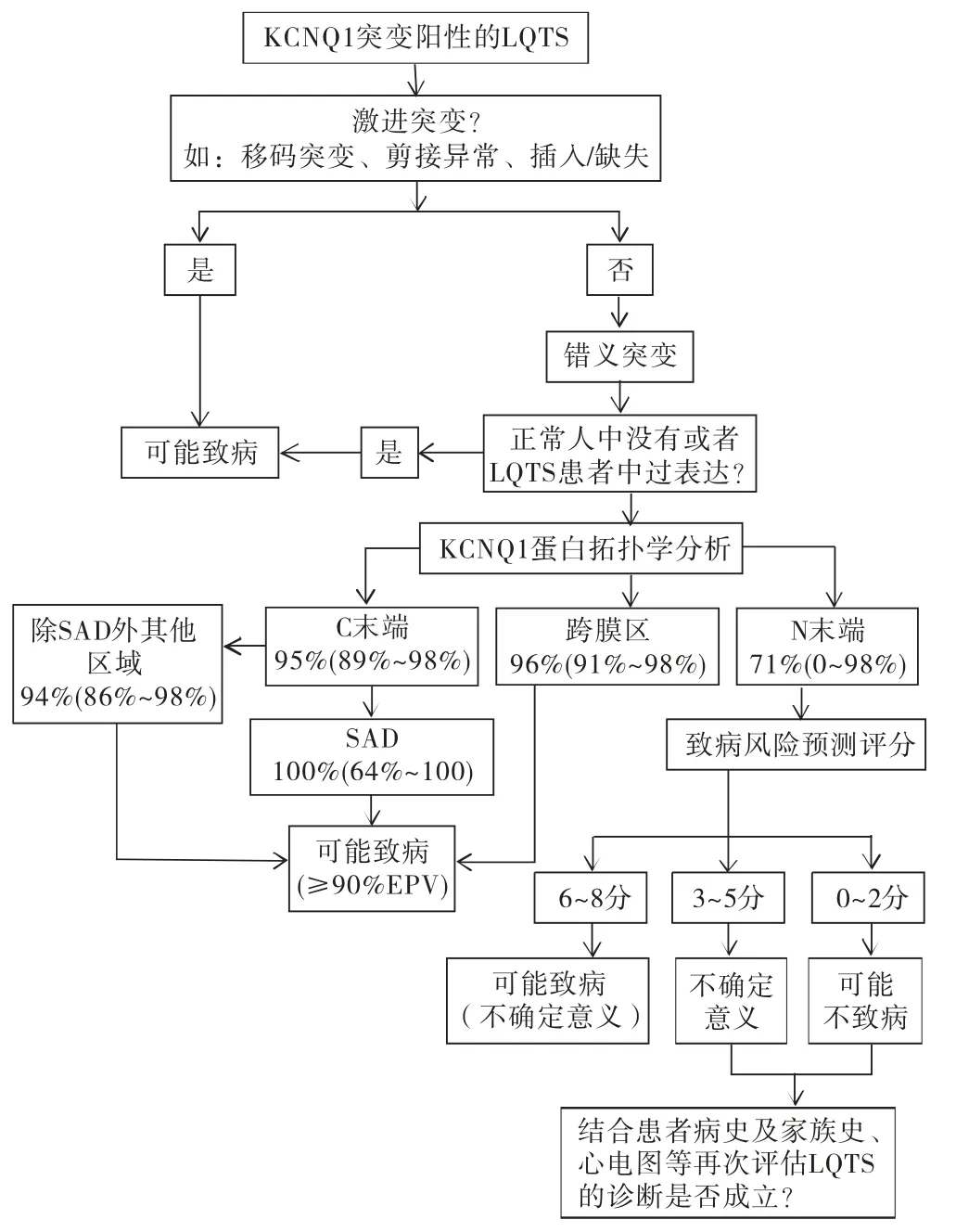
图2 KCNQ1突变的致病性评估流程[3]
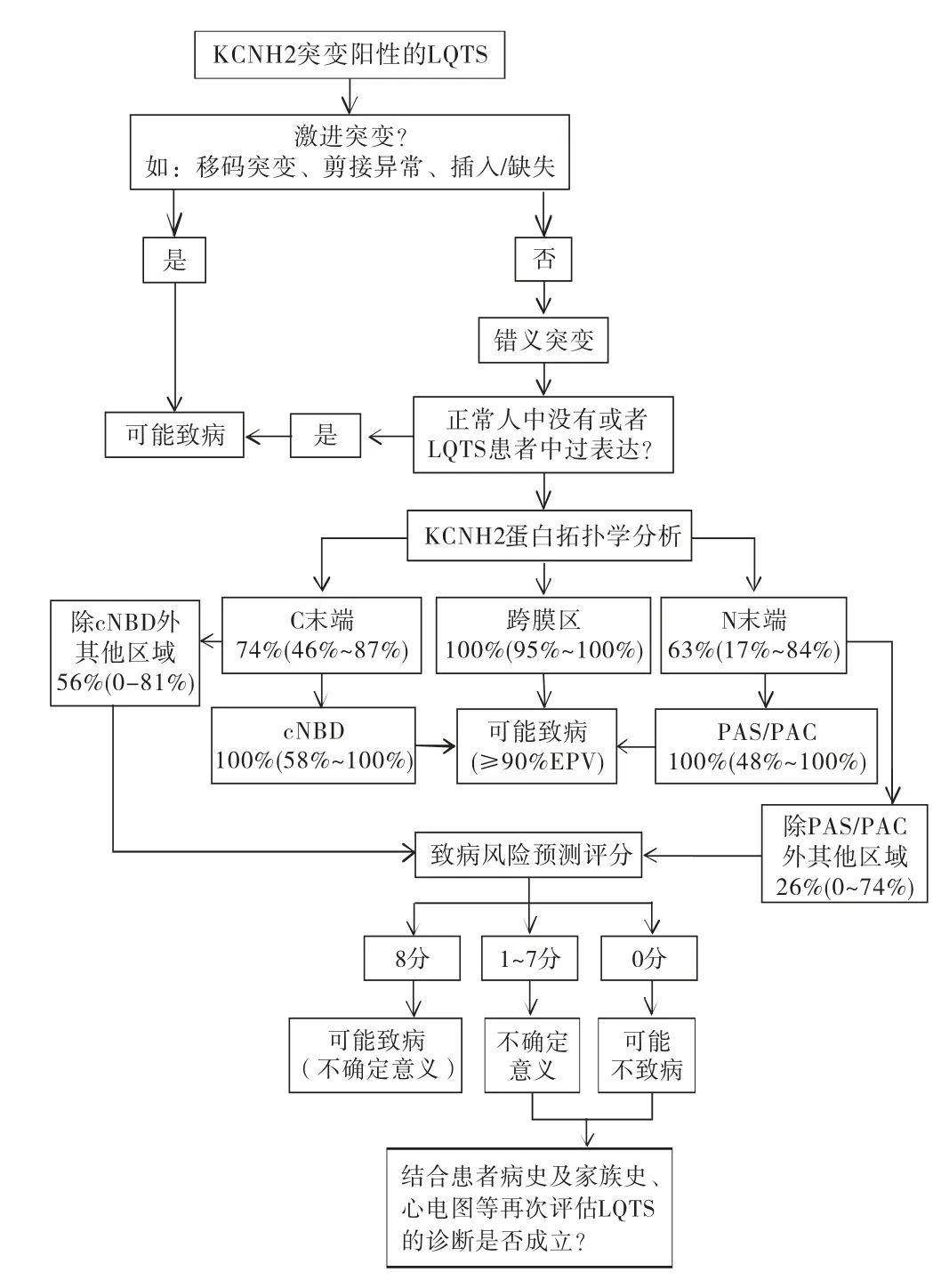
图3 KCNH2突变的致病性评估流程[4]
4 结语
随着基因检测技术的发展,越来越多的LQTS突变基因被发现,促进了LQTS基因诊断的快速发展。目前已发现,LQTS 的不良心脏事件不仅与LQTS分型、基因突变位置有关,还与性别、年龄、种族、地域等因素有关,也明确了LQTS三种常见亚型的高致病性突变区。大数据汇总分析也发现,LQTS基因突变有部分为“假阳性”突变,无致病性,不能作为LQTS 的分型和预后评估的参考标准。目前,LQTS突变基因的致病性评估流程也初见雏形,但不同实验室和不同疾病使用预测软件的种类和数量不同,评分标准也不统一,且敏感性和特异性未知,还无法很好地用于指导临床,尚需大数据进一步验证和完善。此外,由于LQTS 发病率低,漏诊和误诊率高,目前研究进展缓慢,且我国关于LQTS 基因诊断的研究多为小样本研究或个案报道,其突变特点和致病特点如何,现有致病性评估流程是否适用,尚需进一步验证。

