基于“证据推理与模型认知”背景下的沉淀溶解平衡图像分析与突破
李文星
(江苏省徐州市第七中学)
新课程标准对沉淀溶解平衡的要求为认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化.整理近几年的高考题,涉及沉淀溶解平衡图像的高考题多以选择题的形式来呈现,有时也会以填空题的形式呈现.
1 反比例函数沉淀溶解平衡图像分析与突破
例1某温度下,FeS 的水溶液中存在平衡FeS(s)⇌Fe2+(aq)+S2-(aq),其沉淀溶解平衡曲线如图1所示.下列说法正确的是( ).
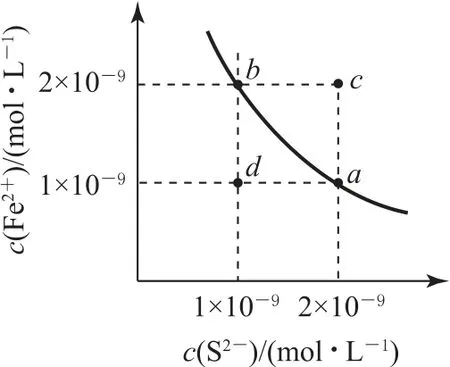
图1
A.可以通过升温实现由c点变到a点
B.d点可能有沉淀生成
C.a点对应的Ksp大于b点对应的Ksp
D.该温度下,Ksp(FeS)=2.0×10-18
从图像可以看出,从c点到a点,c(S2-)不变,c(Fe2+)变小,而温度变化时,c(S2-)与c(Fe2+)同时变化,选项A 错误.沉淀溶解平衡曲线上方表示过饱和溶液,可析出沉淀,曲线下方表示不饱和溶液,所以d点没有沉淀生成,选项B错误.a、b点处于等温线上,温度不变,Ksp不变,选项C 错误.由图知,该温度下,Ksp(FeS)=2.0×10-18,选项D 正确.答案为D.
2 对数直线沉淀溶解平衡图像分析与突破
例2常温下,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0×10-18.RS的沉淀溶解平衡曲线如图2所示(R 表示Ni或Fe).下列说法正确的是( ).

图2
A.图中Ⅱ表示FeS溶解平衡曲线
B.常温下,NiS+Fe2+⇌FeS+Ni2+的平衡常数K=6000
C.常温下,与Q点相对应的NiS的分散系固—液共存
D.常温下,向P点对应的溶液中加适量Na2S固体,可转化成M点对应的溶液
该题是对数直线沉淀溶解平衡图像,要判断曲线Ⅰ和曲线Ⅱ对应的是FeS还是NiS.需要根据Ksp的大小判断,但要注意图像的纵坐标是-lgc(R2+),-lgc(R2+)的值越大,金属离子的浓度越小,-lgc(S2-)的值越大,硫离子的浓度越小,所以曲线Ⅱ的Ksp应该是小的,对应的应该是NiS溶解平衡曲线,选项A 错误.常温下,NiS+Fe2+⇌FeS+Ni2+的平衡常数,选项B 错误.Q点处,平衡常数小于Ksp(NiS),分散系中无固体,选项C错误.P点对应的溶液中加适量Na2S 固体,S2-浓度增大,R2+浓度减小,可使溶液由P点转化成M点对应的溶液,选项D 正确.答案为D.
推理与建模此类试题是把沉淀溶解平衡图像的反比例函数形式变成直线形式,直线上的点是沉淀溶解平衡的点,解题时要看清坐标,注意数值表示形式的不同,应用图像中关键的点进行Ksp的计算.
3 滴定曲线沉淀溶解平衡图像分析与突破
例3室温时,用0.100mol•L-1的标准AgNO3溶液滴定15.00mL 浓度相等的Cl-、Br-和I-混合溶液,通过电位滴定法获得lgc(Ag+)与V(AgNO3)的关系曲线如图3 所示(忽略沉淀对离子的吸附作用).若溶液中离子浓度小于1.0×10-5mol•L-1时,认为该离子沉淀完全.已知Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17.

图3
下列说法不正确的是( ).
A.a点:有AgI沉淀生成
B.原溶液中Cl-的浓度为0.010mol•L-1
C.当Br-沉淀完全时,已经有部分Cl-沉淀
D.b点:
由题意可知,AgI更难溶,a点先生成AgI沉淀,选项A 说法正确.当滴入4.50mLAgNO3溶液时,3种离子完全沉淀,根据3种离子浓度相等,则每种离子完全沉淀消耗1.5mL0.100mol•L-1的标准AgNO3溶液,则氯离子浓度为
选项B 说法正确.当Br-完全沉淀时,Br-的浓度为1.0×10-5mol•L-1,此时溶液中的Ag+浓度为
若Cl-开始沉淀,则此时Cl-的浓度为
小于溶液中Cl-的浓度,说明已经开始沉淀,选项C说法正确.b点时,AgNO3过量,Ag+浓度最大,此时Cl-、Br-和I-完全沉淀,又因为
所以各离子浓度大小关系为
选项D 说法错误.答案为D.
4 其他类型沉淀溶解平衡图像分析与突破
例4常温下,向10.0 mL 浓度均为0.1 mol•L-1的AlCl3和FeCl3混合溶液中加入NaOH 固体,溶液中金属元素有不同的存在形式,它们的物质的量浓度与NaOH 物质的量关系如图4 所示,测得a、b点溶液的pH 分别为3.0、4.3.
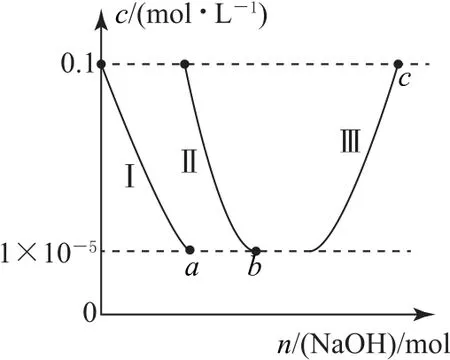
图4
已知:①Ksp[Al(OH)3]>Ksp[Fe(OH)3];
②Al3+(aq)+4OH-(aq)⇌[Al(OH)4]-(aq).
下列叙述正确的是( ).
A.曲线Ⅰ代表Al3+
B.常温下,Ksp[Al(OH)3]=1.0×10-38
C.b点溶液中金属元素主要存在形式为Fe(OH)3和AlO-2
D.Al(OH)3+OH-=[Al(OH)4]-的平衡常数为1.1×10-1.1
根据a点、b点对应的pH,计算溶度积为
根据信息①可知,前者为Fe(OH)3的溶度积,后者为Al(OH)3的溶度积;溶解度小,优先沉淀,故曲线Ⅰ代表Fe3+,曲线Ⅱ代表Al3+,选项A、B 错误.b点恰好2种金属离子完全沉淀,金属元素主要存在形式为Fe(OH)3和Al(OH)3,选项C错误.平衡常数
选项D 正确.答案为D.
沉淀溶解平衡是电解质溶液中离子平衡的重要内容,也是高考经常考查的内容.在备考时涉及沉淀溶解平衡的图像分析应该与盐类的水解与弱电解质的电离平衡一样受到重视.
(完)

