突破水溶液中的离子反应与平衡图像问题
翟金玲
(山东省沂源县第一中学)
高考试题对水溶液中的离子反应与平衡图像考查主要有三个方面:1)宏观考查电离平衡、水解平衡、溶解平衡的移动及平衡常数,体现平衡观;2)微观考查溶液中微粒的浓度,体现变化观、主次观和守恒观;3)数形结合,考查理解与辨析、分析与推测的能力.这类图像题是学生感觉难度较大的高考选择题,情境复杂,图像多变.本文给出思维模型并结合例题进行分析,以帮助学生复习备考.
1 识图、辨图、用图
1)识图思维模型:一面二线三看点→结合情境想规律→针对问题做判断.
2)辨图思维模型:分析离子反应中的物质变化→分析平衡移动产生的物质变化.
3)用图思维模型:定性分析线的变化趋势→定量读取点的坐标.
例1(2021年辽宁卷)用0.1000mol•L-1盐酸滴定20.00mLNa2A 溶液,溶液中H2A、HA-、A2-的分布分数δ随pH 变化曲线及滴定曲线如图1所示.下列说法正确的是( ).

图1
A.H2A 的Ka1为10-10.25
B.c点:c(HA-)>c(A2-)>c(H2A)
C.第一次突变,可选酚酞作指示剂
D.c(Na2A)=0.2000mol•L-1
分析1)识图:明确坐标含义.横坐标从原点向左表示组分分布分数逐渐增大,从原点向右表示HCl溶液体积逐渐增大,纵坐标表示pH.2)辨图:分析物质变化.加入盐酸发生反应:Na2A +HCl=NaCl+NaHA;NaHA+HCl=NaCl+H2A.pH 较大时A2-的分布分数最大,随着pH 的减小,A2-的分布分数逐渐减小,HA-的分布分数逐渐增大,恰好生成NaHA之后,HA-的分布分数逐渐减小,H2A 的分布分数逐渐增大.3)用图:从问题出发思考如何用图.根据H2A的Ka1表达式分析,图中c(HA-)=c(H2A)的交点对应的c(H+)即为Ka1,由图可知d点pH=6.38,故Ka1=10-6.38,选项A 错误.由c点可以直接比较出c(HA-)>c(H2A)>c(A2-),选项B错误.第一次突变终点时的物质为NaCl和NaHA 混合液,利用图中δ(HA-)最大时读取其pH=8.32,溶液呈碱性,选用酚酞作指示剂,选项C正确.根据e点可知,当加入盐酸40mL时,20mL Na2A 恰好完全反应生成H2A:Na2A+2HCl=2NaCl+H2A,计算可知,c(Na2A)=0.1000mol•L-1,选项D 错误.答案为C.
2 微粒关系判断
判断微粒关系的思维模型如下.
例2(2021 年湖南卷)常温下,用0.1000 mol•L-1的盐酸分别滴定20.00mL浓度均为0.2000 mol•L-1的3种一元弱酸的钠盐(NaX、NaY、NaZ)溶液,滴定曲线如图2所示.下列判断错误的是( ).
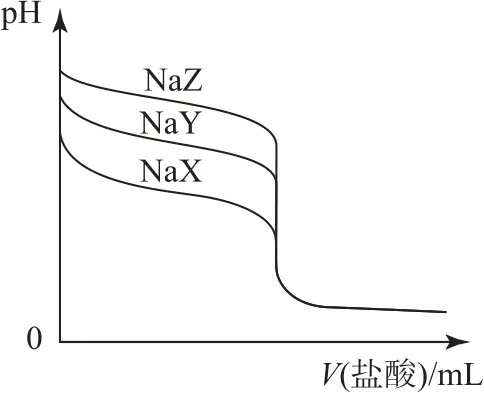
图2
A.该 NaX 溶液中:c(Na+)>c(X-)>c(OH-)>c(H+)
B.3 种一元弱酸的电离常数:Ka(HX)>Ka(HY)>Ka(HZ)
C.当pH=7 时,3种溶液中:c(X-)=c(Y-)=c(Z-)
D.分别滴加20.00mL盐酸后,再将3种溶液混合:c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-)
分析1)确定溶质比大小时,定性分析其主次关系.NaX 溶液中存在反应:NaX=Na++X-(主);X-+H2O⇌HX+OH-(次);H2O⇌H++OH-(再次).分析主次关系可得浓度关系:c(Na+)>c(X-)>c(OH-)>c(H+),选项A 正确.
2)图中滴定终点的pH:NaZ>NaY>NaX,故HX、HY、HZ3 种一元弱酸的酸性依次减弱,可得Ka(HX)>Ka(HY)>Ka(HZ),选项B正确.
3)已知酸碱性的等式关系判断时,优先考虑电荷守恒.pH=7 时,用A-表示X,Y,Z,溶液中存在c(Na+)+c(H+)=c(A-)+c(OH-)+c(Cl-),c(H+)=c(OH-)时c(Na+)=c(A-)+c(Cl-),酸越弱,向盐溶液中加入盐酸的体积越大,酸根离子的浓度越小.选项C错误.
4)判断等式关系时,考虑电荷与物料守恒.滴加20.00mL盐酸均为恰好反应,溶质为等浓度NaCl和HA 的混合溶液,将3种溶液混合后,存在电荷守恒:
物料守恒:c(Na+)=c(Cl-),两式联立约去c(Cl-)可得c(X-)+c(Y-)+c(Z-)=c(H+)-c(OH-),选项D 正确.
综上所述该题选C.
例3人体血液中存在等缓冲对.常温下,水溶液中各缓冲对的微粒浓度之比的对数值或与pH 的关系如图3 所示.已知碳酸pKa1=6.4、磷酸pKa2=7.2(pKa=-lgKa).则下列说法正确的是( ).

图3
C.a→b的过程中水的电离程度逐渐减小
D.c点时,溶液中
分析1)相同变量不同变化趋势时,定性辨图.pH增大,c(OH-)增大,c(H2CO3)减小时,增大,故减小,同理增大,曲线Ⅰ表示与pH的变化关系,选项A 错误.
2)K的表达式中处于分子和分母的溶质微粒,可以借助K恒温为定值,根据图像进行比较.
c点时,pH >7.2,则,即,所以,选项D正确.
综上分析,该题答案为D.
水溶液中的离子反应与平衡图像题还包括图像中常数计算,解题时可采用如下思维模型:求数找点→找明确坐标点(起点、终点、交点等)→结合表达式特点和图像信息找到该点→利用坐标值计算.
(完)

