注重信息处理 剖解粒子曲线
刘树载
(浙江省金华市艾青中学)
图像是高考试题的数字化语言,用图像表述化学反应过程或者呈现信息情境是近年高考化学综合题常见的表达方式.将离子反应与图像有机结合起来进行命题,能很好地考查学生的观察能力、获取信息、采集处理数据的能力、图形转化能力和推理判断能力.
1 中和滴定曲线
在酸碱电离过程中,溶液的pH 会发生变化,对于强酸强碱的反应,开始时由于被中和的酸或碱浓度较大,加入少量的碱或酸对其pH 的影响不大.当反应接近反应终点(pH≈7)时,很少量(1滴,约0.04mL)的碱或酸就会引起溶液pH 突变.酸、碱的浓度不同,pH 突变范围不同.用氢氧化钠溶液滴定等浓度等体积的盐酸、醋酸的滴定曲线如图1所示,用盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线如图2所示.

图1

图2
1)曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高.
2)突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应).
3)室温下pH=7不一定是终点:强碱与强酸反应时,终点时pH=7;强碱与弱酸(强酸与弱碱)反应时,终点时pH≠7(强碱与弱酸反应终点时pH>7,强酸与弱碱反应终点时pH<7).
例1(2023 年湖南卷12)常温下,用浓度为0.0200mol•L-1的NaOH 标准溶液滴定浓度均为0.0200mol•L-1的HCl和CH3COOH 的混合溶液,滴定过程中溶液的pH 随的变化曲线如图3所示.下列说法错误的是( ).

图3
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COOH)+c(CH3COO-)
C.点b:c(CH3COOH)<c(CH3COO-)
D.水的电离程度:a<b<c<d
NaOH 溶液和HCl、CH3COOH 的混合溶液反应时,先与强酸反应,然后与弱酸反应.由滴定曲线可知,a点时NaOH 溶液和HCl恰好完全反应生成NaCl和水,CH3COOH 未发生反应,溶质成分为NaCl和CH3COOH;b点时NaOH 溶液反应掉一半的CH3COOH,溶质成分为NaCl、CH3COOH和CH3COONa;c点时NaOH 溶液与CH3COOH 恰好完全反应,溶质成分为NaCl、CH3COONa;d点时NaOH过量,溶质成分为NaCl、CH3COONa 和NaOH.a点时
选项A 说法正确.a点溶液存在物料守恒:c(Na+)=c(Cl-)=c(CH3COOH)+c(CH3COO-),选项B 说法正确.b点的pH<7,溶液显酸性,说明CH3COOH的电离程度大于 CH3COO-的水解程度,则c(CH3COOH)<c(CH3COO-),选项C 说法正确.c点溶液中CH3COO-水解促进水的电离,d点碱过量,会抑制水的电离,则水的电离程度c>d,选项D说法错误.答案为D.
【解题策略】具体分析如表1所示.
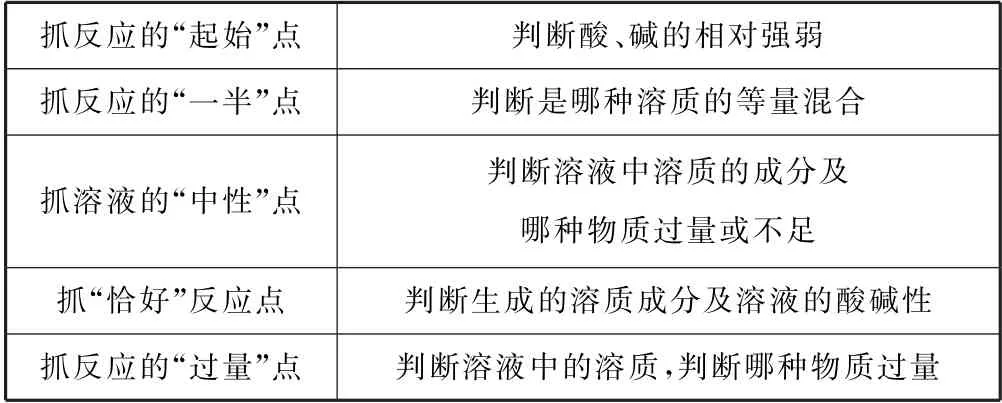
表1
2 对数关系曲线
将溶液中某一微粒的浓度[如c(A)]或某些微粒浓度的比值[如c(A)/c(B)]取常用对数,即lgc(A)或,与溶液中的pH 或溶液的体积等关系作出的图像称为对数图像.常考对数图像的类型如表2所示.

表2
例2(2023年新课标卷13)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应:Ag++NH3⇌[Ag(NH3)]+和[Ag(NH3)]++NH3⇌[Ag(NH3)2]+,lg[c(M)/(mol•L-1)]与lg[c(NH3)/(mol•L-1)]的关系如图4所示(其中M 代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+).

图4
下列说法错误的是( ).
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp(AgCl)=c(Ag+)•c(Cl-)=1.0×10-9.75
C.反应[Ag(NH3)]++NH3⇌[Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol•L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+)
AgCl饱和溶液中c(Ag+)=c(Cl-),向其中滴加氨水,溶液中c(Ag+)减小,c(Cl-)增大、c([Ag(NH3)]+)先增大,继续加入氨水后增大的幅度小于c([Ag(NH3)2]+),c[Ag(NH3)2]+开始时最小,则曲线Ⅰ、Ⅱ、Ⅲ、V 分别表示[Ag(NH3)2]+、[Ag(NH3)]+、Ag+、Cl-的浓度对数随NH3浓度对数变化的曲线.由以上分析可知,选项A 说法错误.由图可知,当氨分子浓度为10-1mol•L-1时,溶液中Ag+和Cl-浓度分别为10-7.40mol•L-1、10-2.35mol•L-1,则氯化银的溶度积常数为10-2.35×10-7.40=10-9.75,选项B说法正确.由图可知,氨分子浓度对数为-1时,溶液中[Ag(NH3)2]+和[Ag(NH3)]+的浓度分别为10-2.35mol•L-1和10-5.16mol•L-1,则[Ag(NH3)]++NH3⇌[Ag(NH3)2]+的平衡常数
选项C说法正确.由图可知c(NH3)=0.01 mol•L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+),选项D 说法正确.答案为A.
【解题策略】1)确定图像的类型是对数图像还是负对数图像.
2)弄清楚图像中横坐标和纵坐标的含义,是浓度对数还是比值对数.
3)抓住图像中的特殊点:如pH=7、lgx=0、交叉点等.
4)厘清图像中曲线的变化趋势及含义,判断线上、线下的点所表示的意义.
5)将图像中数据或曲线的变化与所学知识对接,判断选项的正误.
3 分布系数曲线
分布系数图像简称分布曲线,是指以pH 为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线.如表3所示.

表3
例3H2L 为某邻苯二酚类配体,其pKa1=7.46,pKa2=12.4.常温下构建Fe(Ⅲ)-H2L 溶液体系,其c0(Fe3+)=2.0×10-4mol•L-1,c0(H2L)=5.0×10-3mol•L-1.体系中含Fe物种的分布系数δ与pH 的关系如图5 所示,分布系数δ(X)=,已知lg2≈0.30,lg3≈0.48.下列说法正确的是( ).
图5
A.当pH=1时,体系中c(H2L)>c([FeL]+)>c(OH-)>c(HL-)
B.pH 在9.5~10.5之间,含L的物种主要为L2-
C.L2-+[FeL]+⇌[FeL2]-的平衡常数的lgK约为14
D.当pH=10 时,参与配位的c(L2-)≈1.0×10-3mol•L-1
由图可知,对两曲线的交点横坐标值加和取平均值即为某物种含量最大时的pH.从图中可以看出Fe(Ⅲ)主要与L2-进行配位化合,但在pH=1时,富含L 的物种主要为H2L,此时电离出的HL-较少,根据H2L 的一级电离常数可以简单计算出pH=1时溶液中的c(HL-)≈10-9.46,但pH=1时,c(OH-)=10-13,因此这4种离子的浓度大小为c(H2L)>c([FeL]+)>c(HL-)>c(OH-),选项A错误.根据图示的分布分数图可以推导出,H2L 在pH≈9.9时HL-的含量最大,而H2L 和L2-的含量最少,因此当pH 在9.5~10.5之间时,含L 的物种主要为HL-,选项B 错误.该反应的平衡常数K=,当[FeL2]-与[FeL]+分布分数相等时,可以将K简化为,此时体系的pH=4,可以计算溶液中c(L2-)=5.0×10-14.86,则该配合反应的平衡常数K≈10-14.16,即lgK≈14,选项C正确.根据图像可知,pH=10时溶液中的主要物种为[FeL3]3-和[FeL2(OH)]2-,其分布分数均为0.5,故c([FeL3]3-)=c([FeL2(OH)]2-)=1×10-4mol•L-1,此时形成[FeL3]3-消耗3×10-4mol•L-1的L2-,形成[FeL2(OH)]2-消耗2×10-4mol•L-1的L2-,共消耗5×10-4mol•L-1的L2-,即参与配位的c(L2-)≈5×10-4,选项D 错误.答案为C.
【解题策略】1)解图像:分析两轴意义、关注特殊点(如起点、滴定突跃点、pH=7的点、交点、对数值为0的点等).
2)抓原理:电离平衡、水解平衡、反应比例.
3)找关系:电离常数、水解常数、三个平衡.
4)辨正误:抓住溶质、计算数值、比较浓度等.
4 溶解平衡曲线
近几年沉淀溶解平衡图像这种数形结合的试题频频出现,成了高考的热点题型.以此考查沉淀溶解平衡原理,分析图像中离子浓度的关系、Ksp的计算等.
1)阳离子—阴离子单曲线图.
以“BaSO4(s)⇌Ba2+(aq)+(aq)”为例,图像如图6所示,具体分析如表4所示.

图6
2)阴阳离子浓度—温度双曲线图:横、纵坐标分别为阳离子或阴离子,两条曲线为不同温度,BaSO4曲线如图7所示,由图可知以下信息.

图7
①每条曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液.
②由a或b点可以计算出T1温度下的Ksp.
③比较T1和T2大小:因沉淀溶解平衡大部分为吸热,可知T1<T2.
3)对数(pM-pR)曲线:横、纵坐标分别为阳离子或阴离子的负对数,如图8所示.
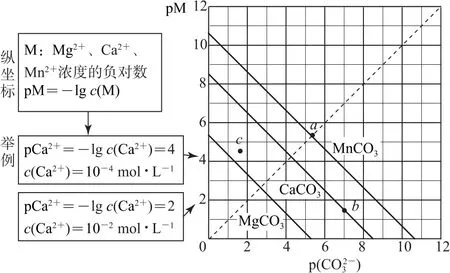
图8
由图可知以下信息:
②直线上的任何一点为饱和溶液;直线上方的点为不饱和溶液;直线下方的点为过饱和溶液,有沉淀生成.例如,c点,相对于MgCO3来说,处于直线上方,为不饱和溶液;相对于CaCO3来说,处于直线下方,为过饱和溶液,此时有CaCO3沉淀生成.
③由曲线上面给定数据可以计算出相应的Ksp.
④Ksp(MgCO3)>Ksp(CaCO3)>Ksp(MnCO3).
例4已知SrF2属于难溶于水、可溶于酸的盐.常温下,用HCl调节SrF2浊液的pH,测得在不同pH条件下,体系中pSr[pSr=-lgc(Sr2+)]或pF[pF=-lgc(F-)]与的关系如图9所示(不考虑HF的挥发等).下列说法不正确的是( ).

图9
A.曲线Ⅰ代表pSr与pX 的变化曲线
B.常温下,Ksp(SrF2)=10-8.4
C.c点溶液中存在:c(Sr2+)>c(Cl-)>c(H+)
D.d点溶液中存在:2c(Sr2+)=c(F-)+c(HF)
SrF2难溶于水,可溶于酸,一般可用平衡原理进行解释,SrF2浊液中存在溶解平衡:SrF2(s)⇌Sr2+(aq)+2F-(aq).用HCl调节溶液,存在平衡:H++F-⇌HF,促进溶解平衡正向移动;随着增大,pX=减小,H++F-⇌HF逆向移动,F-浓度增大,pF=-lgc(F)变小.由分析可知,曲线Ⅰ代表pSr与pX 的变化曲线,选项A正确.pX=为-1时,-lgc(Sr2+)=4.0,c(Sr2+)=10-4mol•L-1,-lgc(F-)=2.2,c(F-)=10-2.2mol•L-1,Ksp(SrF2)=10-4×(10-2.2)2=10-8.4,选项B 正确.c点处c(Sr2+)=c(F-),结合SrF2物料守恒可知,c(Sr2+)=c(F-)=c(HF),由电荷守恒得2c(Sr2+)+c(H+)=c(Cl-)+c(OH-)+c(F-),则c(Sr2+)+c(H+)=c(Cl-)+c(OH-),溶液呈酸性,得c(Cl-)>c(Sr2+),c点对应值大于0,则,即c(HF)>c(H+),故溶液中存在c(Cl-)>c(Sr2+)=c(HF)>c(H+),选项C错误.由物料守恒可知,d点的溶液中存在关系:2c(Sr2+)=c(F-)+c(HF),选项D 正确.答案为C.
【解题策略】1)明确图像中横、纵坐标的含义.横、纵坐标通常是难溶物溶解后电离出的离子浓度或其对数或其负对数.
2)理解图像中线上点、线外点的含义.曲线上任意一点都达到了沉淀溶解平衡状态,此时Qc=Ksp.在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线外.
当横、纵坐标为离子浓度或其对数时,则:
a)曲线上方区域的点均为过饱和溶液,此时Qc>Ksp.
b)曲线下方区域的点均为不饱和溶液,此时Qc<Ksp.当横、纵坐标为离子浓度负对数时,则刚好与上述情况相反.
c)抓住Ksp的特点,结合选项分析判断.
溶液在蒸发时,离子浓度的变化分两种情况:①原溶液不饱和时,离子浓度都增大;②原溶液饱和时,离子浓度都不变.溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同.
(完)
——饱和溶液与不饱和溶液

