石蒜碱对宫颈癌HeLa细胞PI3K/Akt信号通路的调控作用研究①
徐振宇,卢林侠,吉夫次里,王佩珊,赵 勇,张小萌,李卓尔
(佳木斯大学,黑龙江 佳木斯 154007)
宫颈癌是最常诊断的癌症之一,同时也是女性癌症死亡的常见原因之一[1]。且近年来发病率呈不断上升趋势,并逐渐向年轻化发展,严重威胁女性身体健康[2]。同时,由于人口老龄化的加速以及性观念的改变,宫颈癌的防控形势愈加严峻。石蒜碱属于异喹啉类生物碱,作为传统的药用植物,具有抗炎,抗病毒等多种生物活性,且对多种肿瘤具有较好的抑制作用[3]。体外实验表明,石蒜碱对非小细胞肺癌[4],人结直肠癌细胞[5],前列腺癌[6]等都有明显的抑制作用。然而,石蒜碱对宫颈癌的作用未见报道。PI3K/Akt/mTOR信号通路的激活可参与多种肿瘤的病理发生过程,肿瘤细胞在PI3K活化后,通过激活下游的Akt,对凋亡的诱导产生耐受,异常增加细胞的生长代谢。在卵巢癌和乳腺癌病理过程中,可引起肿瘤细胞的迁移、加速细胞周期、减少细胞凋亡。在宫颈癌细胞中PI3K/AKT可影响其增殖凋亡,因此本实验通过体外实验加入石蒜碱并对各项指标测定,探讨石蒜碱抗宫颈癌HeLa细胞影响及其作用机制。
1 材料与方法
1.1 Hela细胞
人宫颈癌Hela细胞由佳木斯大学生命科学实验中心提供。
1.2 药物及试剂
石蒜碱(成都曼思特生物科技有限公司,HPLC≥98%),采用含有0.1% DMSO的DMEM配置成不同浓度;培养基、血清购自Gibco公司; CCK8、BCA试剂盒购自碧云天生物技术有限公司; PI3K、P-PI3K、AKT、P-AKT、Cleaved Caspase-3、β-actin抗体购自美国Santa公司;Annexin V-FITC/7AAD凋亡检测试剂盒购自美国BD公司。
1.3 CCK-8法检测细胞活力
将Hela接种在96孔板中,待细胞融合至80%时,换无血清培养液饥饿处理24h。按空白对照组、细胞对照组和溶剂对照组的分组并加入相应药物培养24h,向每孔中加入CCK8试剂10μL,培养2h,酶标仪检测450nm波长处各孔的光密度(OD)值,以其表示细胞增殖活性。每组设5个复孔,实验重复3次。细胞增殖抑制率 = (细胞对照组OD值-给药组OD值)/(细胞对照组OD值-空白对照组OD值)×100%。
1.4 划痕实验的测定
将Hela接种到6孔板中,待细胞贴壁生长至密度70%~80%时更换为无血清培养液饿处理24h。使用200μL的无菌枪头直在细胞板上均匀划线造成几条划痕。PBS洗涤3次去除划的细胞加含体积分数10%胎牛血清的DMEM培养液制备不同浓度的石蒜碱溶液,将石蒜碱溶液加入划痕区域的细胞中,每个划痕组设置不同浓度的石蒜碱。加入相应药物每隔12h显微镜下观察细胞划痕开口率并采集图像。每组设3复孔,三次独立实验。
1.5 流式细胞术检测人宫颈癌Hela细胞的凋亡
从待检测的细胞中抽取样本,在显微镜下观测其生长发育情况,确保无环境污染,细胞覆盖率到达90%之上。然后弃掉旧液,进行常规清洗、消解、离心,吸出上清液,最后加入PBS进行细胞沉积2遍。采取适当的动作,以免损害细胞,影响实验结果。然后将500μLBinding Buffer加入细胞悬液中,轻柔搅拌,然后加入5μL Annexin V和5μL 7-AAD染液,在室温下避光染色15min,以获得最佳的染色效果。完成后,1h内送流式细胞仪上机检测细胞调亡。记录检测数据,计算凋亡细胞的比例,并加以数据分析,以便描绘图形。
1.6 Western blot 法
使用BCA法进行蛋白定量,5×上样缓冲液与样品蛋白以1:4的比例混匀,100℃煮沸15min。配制电泳胶凝胶后,蛋白样品上样、电泳,转膜,5%脱脂奶粉(或5%BSA),37℃水浴摇床封闭1h。TBST洗膜5次,一抗4℃过夜。使用TBST洗膜5次,每次6min。二抗37℃孵育1h,TBST洗膜5次,每次6min。进行化学发光显影。
1.7 统计学方法
采用SPSS23.0统计服务软件对数据进行统计及处理,多样本均数对比采用单因素方差分析(ANVOA)。P<0.05为差异有统计学意义。
2 结果
2.1 石蒜碱对Hela增殖的抑制作用
不同浓度石蒜碱作用Hela细胞可降低人宫颈癌细胞增殖率。细胞增殖率随着药物浓度增加和作用时间延长逐渐降低。与对照组比较石蒜碱作用Hela细胞24h、48h、72h的细胞活力从1.25μM开始的差异有统计学意义(P<0.05),见图1。
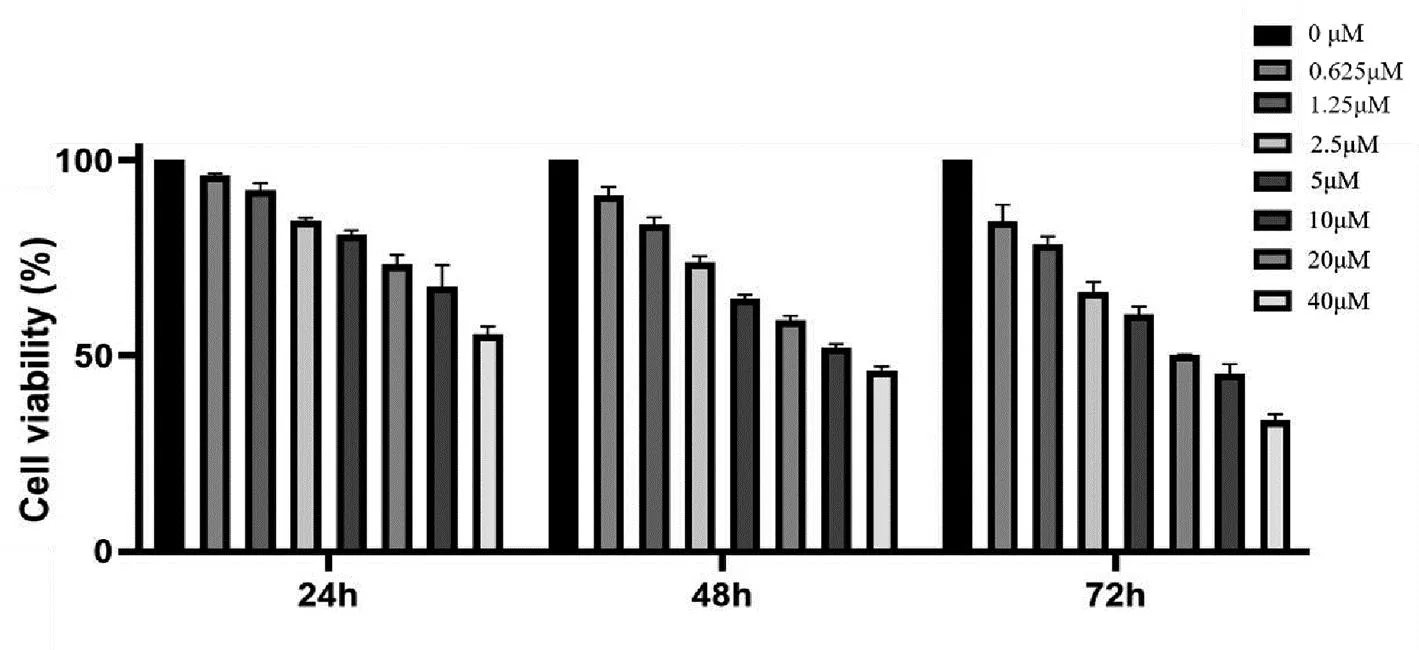
图1 石蒜碱对Hela细胞增殖的影响
2.2 石蒜碱对Hela细胞迁移能力影响
与对照组组比较,随着石蒜碱浓度的升高细胞迁移数显著降低(P<0.01)。与此同时,随着石蒜碱浓度作用时间延长细胞迁移数也显著降低,见图2。
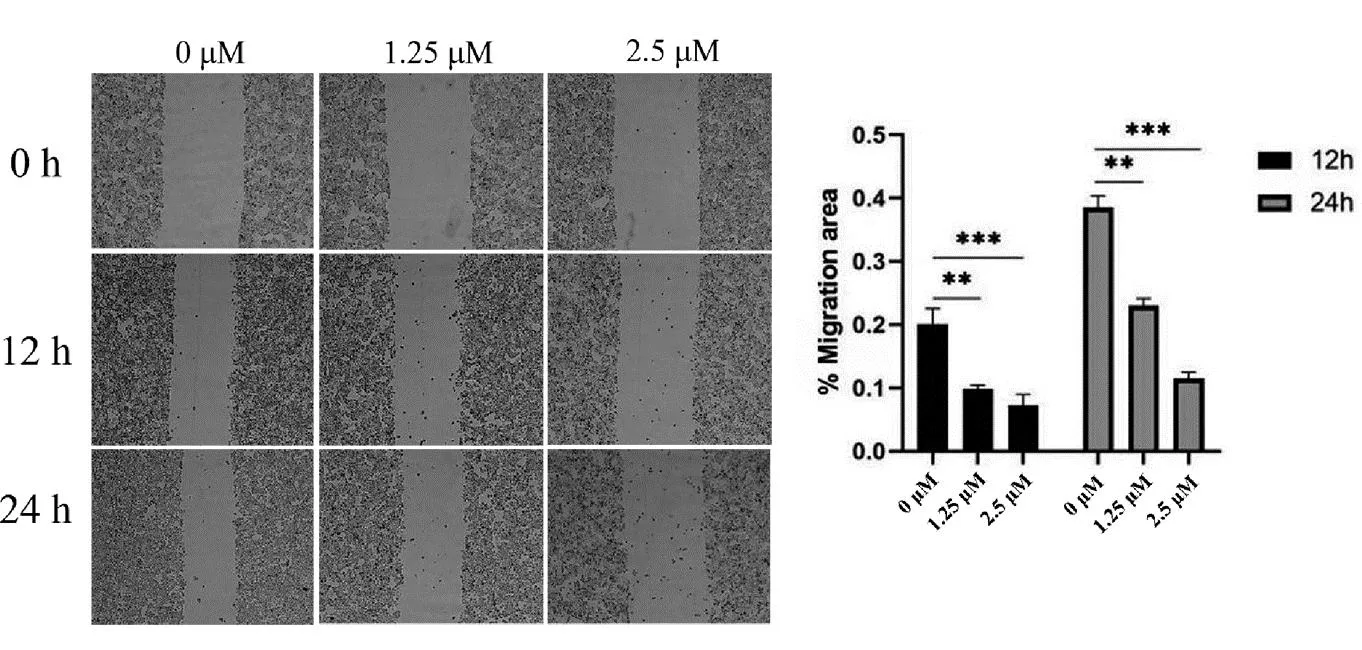
图2 石蒜碱对Hela细胞迁移能力的影响
2.3 石蒜碱诱导Hela细胞的凋亡
不同浓度的石蒜碱(0、1.25、2.5μM)作用于人宫颈癌Hela细胞24h后,经流式细胞术检测结果细胞调亡率随着石蒜碱给药浓度的增加而增加,且呈剂量依赖性关系,各给药组细胞调亡率与阴性对照组比较有显著性差异,有统计学意义(P<0.01),见图3。
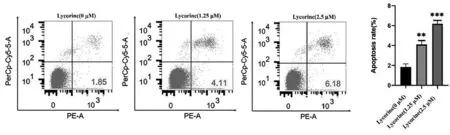
图3 石蒜碱对Hela细胞凋亡的影响
2.4 石蒜碱抗宫颈癌Hela细胞对PI3K/Akt通路的影响
不同浓度的石蒜碱(0、1.25、2.5μM)作用于人宫颈癌Hela细胞24h后,经Western Blot检测,与对照组相比,随着石蒜碱浓度的升高,PI3K、AKT蛋白不变,P-PI3K、P-AKT蛋白水平逐渐降低,凋亡相关蛋白Cleaved caspase-3蛋白逐渐升高,差异有统计学意义,见图4。
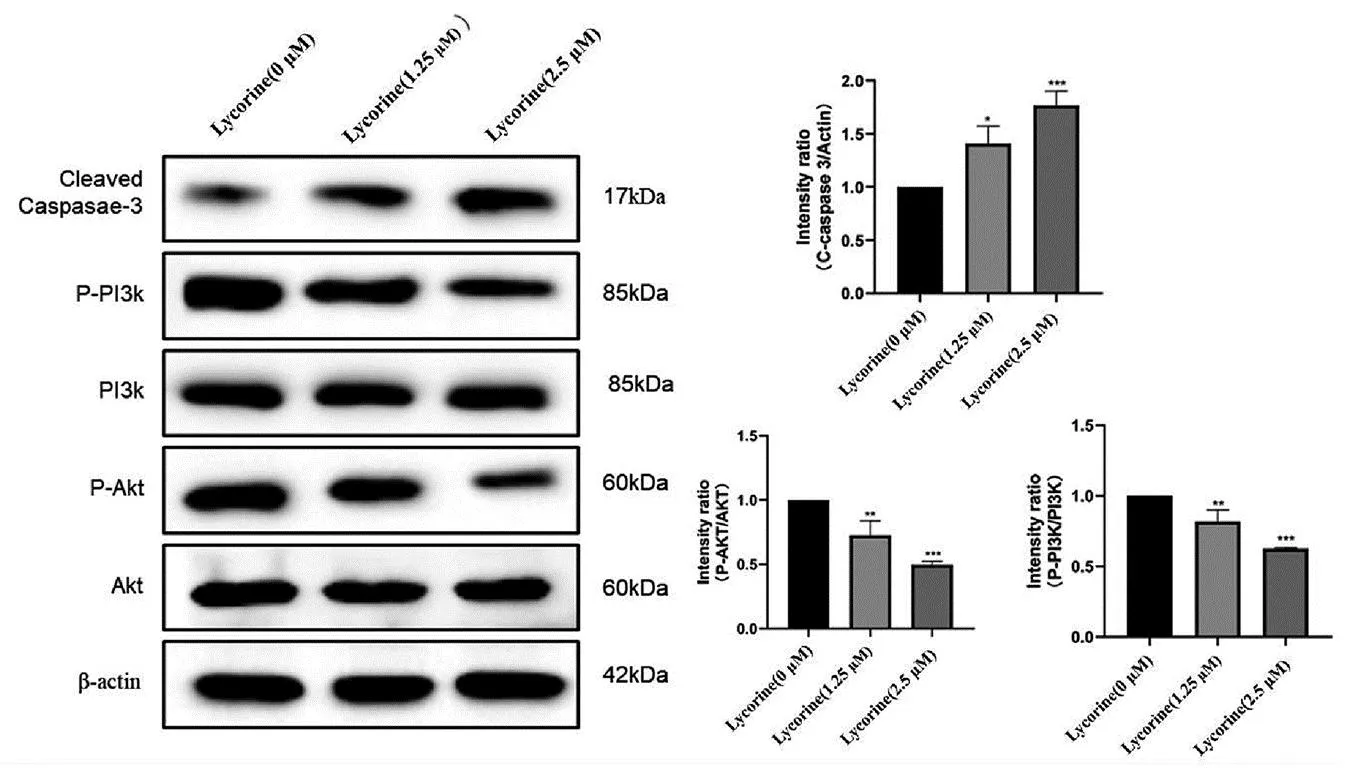
图4 石蒜碱对Hela细胞PI3K/AKT信号通路及凋亡相关蛋白的影响
3 讨论
宫颈癌在发展中国家其发病率高居第一位[7]。每年全世界约有46.5万人罹患宫颈癌疾病,我国新增病例占其中30%,约13.15万,死亡数约为5万。在我国由于经济等因素影响,80%的患者确诊时已是浸润癌,而且出现了患病逐渐年轻化的趋势[8-9]。宫颈癌中晚期主要以泰素及铂类的化疗作为主要的治疗手段,但化疗不敏感是导致治疗失败的重要因素,使得宫颈癌的治疗处于瓶颈阶段。寻找新的治疗方法和有效的治疗药物成为宫颈癌研究关键的问题之一,从中药中寻找有效抗癌成分为化疗药物的研究热点。
石蒜碱(lycorine)具有独特的结构和丰富的药理活性,是从我国广泛分布的草本植物石蒜鳞茎中分离出的一种化学单体。研究发现石蒜碱对多种肿瘤细胞株均显示良好的抗肿瘤活性[10],且作用机制与其抗增殖、细胞凋亡诱导作用有关。然而,石蒜碱对宫颈癌细胞的影响却留有空白,因此本实验以此为出发点,开展石蒜碱对宫颈癌细胞增殖凋亡的研究。本实验分别在24h、48h、72h检测不同浓度的石蒜碱对宫颈癌细胞的活力,发现宫颈癌发现石蒜碱的作用时间和作用浓度与宫颈癌细胞的存活率相关。石蒜碱作用时间延长或作用浓度增加可使宫颈癌细胞增殖率逐渐降低。与此同时,通过划痕实验,我们证实了石蒜碱抑制宫颈癌细胞的迁移。基于以上石蒜碱对宫颈癌的影响,我们进一步采用流式细胞术检测石蒜碱对宫颈癌细胞凋亡的影响,发现随着石蒜碱浓度的增加,宫颈癌细胞的凋亡逐渐增强。
由于石蒜碱对宫颈癌细胞的增殖、凋亡、迁移都产生了影响,他们共同的上游通路成为我们的研究目标。在非小细胞肺癌细胞(NSCLC)中,PI3K/AKT信号的激活抑制NSCLC的增殖、迁移和侵袭[11];在皮肤鳞状细胞癌中,miR-20a通过靶向CCND3的水平抑制PI3K/AKT信号通路的激活,抑制细胞增殖、侵袭和迁移,促进细胞凋亡[12]。因此,PI3K/AKT可对癌细胞的增殖、凋亡、迁移都可产生影响。在宫颈癌细胞中,大量研究表明PI3K/AKT信号通路可影响宫颈癌细胞的生长:黏蛋白家族基因CDH3通过激活PI3K/AKT促进宫颈癌细胞增殖、迁移和侵袭[13];右美托咪定通过PI3K/AKT对宫颈癌细胞凋亡产生影响[14]。在肝癌细胞中,石蒜碱也可通过影响AKT的磷酸化从而对凋亡产生影响[15]。综合分析,一方面,PI3K/AKT作为与癌症发展相关的重要通路,在宫颈癌细胞中也被证实可发挥作用;另一方面,石蒜碱也可通过AKT的磷酸化发挥抗癌作用,因此我们试图研究石蒜碱能否通过PI3K/AKT信号通路影响宫颈癌的发生发展。我们采用不同浓度的石蒜碱作用于宫颈癌细胞24h后,Western Blot检测证实随着石蒜碱浓度的增加,P-PI3K、P-AKT蛋白水平逐渐降低,凋亡相关蛋白Cleaved caspase-3蛋白逐渐升高,表明石蒜碱可能通过抑制PI3K/AKT信号通路抑制宫颈癌细胞的凋亡。
综上所述,石蒜碱可降低宫颈癌Hela细胞活力,抑制细胞增殖、迁移并增加细胞凋亡。石蒜碱抗宫颈癌的功效可能与PI3K/AKT信号通路的下调有关,但其中的下游调控机制还需进一步实验研究。

