低温炖煮燕窝增强免疫功能研究
阴佳璐,袁满,鄂敬文,周时蒙,张悦,王东亮
1.河北省燕窝鲜炖技术创新中心(廊坊 065700);2.中国检验检疫科学研究院综合检测中心(北京 100176)
免疫包含先天性免疫和适应性免疫,是人体重要的保护性生理功能[1]。免疫力低下容易受到外界病原体的感染,从而更容易患上各种疾病,因此增强免疫有助于预防感染性疾病、恶性肿瘤和自身免疫性疾病的发生,对维持人体健康具有重要意义[2-3]。免疫系统由免疫器官、免疫细胞和免疫因子三部分组成,这些指标的变化代表机体免疫功能的改变[4]。现代科学研究表明,功能性食品在增强人类健康状况、降低患病风险方面起着重要作用,可作为满足消费者提升免疫需求首要选择[5]。
燕窝是金丝燕利用其唾液分泌物与羽毛或草屑而制成的巢穴,作为传统中式滋补品,距今有600多年食用历史[6]。燕窝因其营养价值、药用价值和经济价值,已成为我国重要的产业,据统计2021年燕窝行业总销售额已突破400亿元。燕窝主产地分布在印度尼西亚、马来西亚、泰国等东南亚地区[7]。现代科学研究显示,燕窝中含有蛋白质、唾液酸、矿物质等多种营养成分。蛋白质作为燕窝的主要成分,其含量可达到燕窝干重的42%~63%。此外,唾液酸在燕窝的生物活性中也起着重要作用,含量占比一般为7%~12%[8-10]。古籍记载燕窝具有润肺滋阴、调补虚劳、化痰止咳、益气补中、润肠开胃等效用[11]。随着现代科学技术的发展,研究显示燕窝具有调节免疫、抗病毒、改善皮肤、抗氧化、促进神经发育、维护骨骼和关节健康等多种作用[12-13]。
体外及体内的研究表明,干燕窝可通过调节巨噬细胞、脾淋巴细胞等免疫细胞功能,以及调节IFN-γ、TNF等免疫因子水平起到增强免疫作用[14-17]。但仍缺乏对炖煮燕窝调节免疫作用相关研究,并且缺乏有效剂量证明。因此,采用正常小鼠模型进行试验,探讨低温炖煮燕窝体内免疫调节作用,可为低温炖煮燕窝进一步作为增强免疫功能性食品的开发和应用提供理论依据。
1 材料与方法
1.1 材料与仪器
低温炖煮燕窝(北京小仙炖生物科技有限公司提供,经冻干处理后得到冻干粉)。超净工作台(苏州安泰有限公司);二氧化碳培养箱(上海一恒有限公司);离心机(sigma有限公司);恒温水浴锅(力辰科技有限公司);酶标仪(赛默飞有限公司);绵羊红细胞(SRBC)、鸡红细胞、生理盐水、Hank’s液(pH 7.2)、RPMI-1640培养液、小牛血清、青链霉素、刀豆蛋白A(ConA)、1%冰醋酸、1mol/L的HCl、异丙醇、琼脂糖、YAC-1细胞、MTT、PBS缓冲液、补体(豚鼠血清)、SA缓冲液、乳酸锂、碘硝基氯化四氮唑、吩嗪二甲酯硫酸盐、氧化型辅酶Ⅰ、Tris-HCl、文齐氏试剂、1% NP40、印度墨汁、0.1%Na2CO3、Giemsa染液等:所有试剂均采购自上海麦克林生化科技股份有限公司。
试验使用体重18~22 g的SPF级雌性ICR小鼠[许可证号SCXK(京)2021-0006,北京维通利华实验动物技术有限公司]。小鼠饲养期间自由摄入食物及饮水,饲料喂以块状标准(SPF级)饲料,动物饲料来自北京科澳协力饲料有限公司[许可证号SCXK(京)2019-0003]。动物房温度恒定在20~26 ℃,湿度维持在40%~70%。
试验设置空白对照组及低、中、高剂量低温炖煮燕窝组。采用经口灌胃的方式进行,低、中、高剂量设为人体推荐低温炖煮燕窝食用量的5,10和30倍,即0.188,0.375和1.125 g/kg。按0.2 mL/(10 g·Bw)给予灌胃。连续灌胃30 d,每周根据体重调整灌胃量。选用正常动物模型,随机选取192只ICR小鼠,平均分为4个免疫指标组。免疫指标1组进行迟发型变态反应试验、脏器/体重比值、半数溶血值测定和抗体生成细胞检测;免疫指标2组进行碳廓清试验;免疫指标3组进行巨噬细胞吞噬鸡红细胞能力试验;免疫指标4组进行ConA诱导小鼠淋巴细胞转化试验和NK活性测定试验。
1.2 试验方法
1.2.1 小鼠脏器/体重比值测定
小鼠称重后颈椎脱臼处死,取脾脏和胸腺,去尽筋膜,用滤纸吸干脏器表面血污,称重,计算脾脏/体重比值和胸腺/体重比值。
1.2.2 足跖增厚法测定迟发型变态反应
取新鲜的脱纤维羊血,生理盐水洗涤3次,每只小鼠腹腔注射0.2 mL 2%(V/V,用生理盐水配制)SRBC,致敏后4 d测量左后足跖部厚度,同一部位测量3次,取平均值。在测量部位皮下注射20 μL 20%(V/V,用生理盐水配制)SRBC,注射后于24 h测量左后足跖部厚度,同一部位测量3次取平均值,以攻击前后足跖厚度的差值表示迟发型变态反应的程度。
1.2.3 ConA诱导的小鼠淋巴细胞转化试验
小鼠处死后在75%酒精的烧杯中灭菌10 min后,无菌取脾,置于装有高压灭菌的3 cm×3 cm的4层纱布的无菌平皿中,加入适量无菌Hank’s液,用纱布将脾包住,用弯头镊轻轻将脾磨碎,制成单细胞悬液,用Hank’s液洗3次,每次按1 000 r/min离心10 min,计数活细胞数,调整细胞浓度2×107个/mL,取0.4 mL细胞悬液分两孔加入24孔板中,总体积每孔1 mL,其中一孔加入75 μL ConA液,另一孔作为对照,置于5% CO2,37 ℃培养72 h。在培养结束前4 h,每孔轻轻吸取0.7 mL上清液,加入0.7 mL不含小牛血清的RPMI1640培养液,同时每孔加入50 μL 5 mg/mL MTT,继续培养4 h。培养结束后,每孔加入1 mL酸性异丙醇,吹打均匀,使紫色结晶完全溶解。移入96孔板中,在酶标仪上进行测定,波长为570 nm。
1.2.4 抗体生成细胞检测试验
取新鲜的脱纤维羊血,用生理盐水洗涤3次,每只小鼠腹腔注射0.2 mL 2%(V/V,用生理盐水配制)SRBC,致敏后4 d处死小鼠,取全脾制成细胞悬液,加入8 mL Hank’s溶液。将表层培养基加热溶解后,与等量双倍Hank’s液混合,分装小试管,每管0.5 mL,向管内加50 μL 10%(V/V,用SA缓冲液配制)压积SRBC和20 μL脾细胞悬液,迅速混匀,倾倒至已刷琼脂糖薄层的玻片上;待琼脂凝固后,将玻片水平扣放在片架上,放入CO2培养箱中继续孵育1.5 h,用SA缓冲液稀释的补体(1︰8)放入玻片架凹槽内,继续孵育2.0 h,计数溶血空斑数。
1.2.5 血清溶血素半数溶血值(HC50)的测定
取新鲜的脱纤维羊血,用生理盐水洗涤3次(2 000 r/min,10 min),每只鼠腹腔注射0.2 mL 2%(V/V,用生理盐水配制)压积SRBC,致敏后4 d,摘除眼球取血于1.5 mL离心管内,放置约1 h,使血清充分析出,按2 000 r/min离心10 min,收集血清。用SA缓冲液稀释300倍,将0.1 mL稀释后的血清置96孔板内,依次加入0.05 mL 10%(V/V)SRBC和0.1 mL(用SA缓冲液按1︰8稀释)补体,置于37 ℃恒温水浴保温30 min,冰浴终止反应。按1 500 r/min离心10 min,取0.05 mL上清液,加0.15 mL文齐氏试剂,同时,取0.012 5 mL 10%(V/V,用SA缓冲液配制)压积 SRBC,加文齐氏试剂至0.2 mL,至另一96孔板,充分混匀。放置10 min后,在540 nm波长下,用酶标仪分别测定各孔光密度。溶血素的量以半数溶血值(HC50)表示。
1.2.6 小鼠碳廓清试验
给予小鼠尾静脉注射用生理盐水4倍稀释的印度墨汁,待墨汁注入后,立即计时。分别在注入墨汁后的2 min和10 min后,从眼内眦静脉丛取20 μL血,并将其加到2 mL 0.1% Na2CO3溶液中,用酶标仪在600 nm波长处测定光密度,以Na2CO3溶液作空白对照,其中注入墨汁后的2 min所取血标本光密度记为OD1,注入墨汁后的10 min所取血标本光密度记为OD2。小鼠称重处死后取肝脏、脾脏称重。根据动物体重、肝重和脾重计算吞噬指数。按式(3)和(4)计算吞噬指数a。
1.2.7 小鼠腹腔巨噬细胞吞噬鸡红细胞试验
每只小鼠腹腔注射1 mL 5%压积鸡红细胞悬液。间隔2.5 h,颈椎脱臼处死动物,将其仰位,正中剪开腹壁皮肤,经腹腔注射2 mL生理盐水,转动小鼠1 min。吸出1 mL腹腔洗液,平均分滴于2片载玻片上,放入垫有湿纱布的搪瓷盒内,移至37 ℃孵箱孵育30 min。孵毕,于生理盐水中漂洗,以除去未贴片细胞,晾干。以1︰1丙酮-甲醇溶液固定(V/V,1︰1配制),经4%(V/V)Giemsa-磷酸盐缓冲液染色3 min,用蒸馏水漂洗晾干。油镜下计数吞噬鸡红细胞的巨噬细胞数及被吞噬的鸡红细胞总数,每张片计数100个,按式(5)和(6)计算吞噬百分率和吞噬指数。
1.2.8 NK细胞活性测定试验
前24 h将靶细胞YAC-1进行传代培养,用前以Hank’s液洗3次,用含10%胎牛血清的RPMI1640完全培养液调整细胞浓度为4×105个/mL。小鼠颈椎脱臼处死,无菌取脾,制成脾细胞悬液,用Hank’s液洗3次,按1 000 r/min离心10 min,用1 mL含10%小牛血清的RPMI1640完全培养基重悬,用台盼蓝活细胞染色计数(活细胞数应在95%以上),调整细胞浓度为2×107个/mL,使效靶比50︰1。取靶细胞和效应细胞各100 μL,加入U型96孔培养板中,靶细胞自然释放孔加靶细胞和培养液各100 μL,靶细胞最大释放孔加靶细胞和1% NP40各100 μL,上述均设3个平行孔,在37 ℃,5% CO2培养4 h,将96孔培养板以1 500 r/min离心5 min,每孔吸取100 μL上清液置平底96孔培养板中,同时加入100 μL LDH基质液,避光反应10 min,每孔加入30 μL 1 mol/L的HCl溶液终止反应,在酶标仪492 nm处测光密度。NK活性按式(7)计算。
1.3 数据处理
试验所得数据均采用GraphPad Prism 9.4数据处理系统进行统计学分析。数据以“平均值±标准差”(Mean±SD)的形式表示。组间比较采用LSD检验。
2 结果与分析
2.1 低温炖煮燕窝对小鼠免疫脏器/体重比值的影响
低温炖煮燕窝对小鼠胸腺及脾脏质量比值的影响如表1所示。胸腺和脾脏是机体重要的免疫器官,可通过调节免疫反应在机体免疫功能中发挥重要作用,它们的质量比值在一定程度上表明机体先天免疫的能力[4]。试验中,经口给予小鼠不同剂量低温炖煮燕窝30 d,与空白对照组相比,小鼠胸腺/体重比值和脾脏/体重比值无显著性差异(P>0.05),表明低温炖煮燕窝对免疫器官指数无影响。
表1 低温炖煮燕窝对小鼠脏器/体重比值的影响(±SD,n=12)
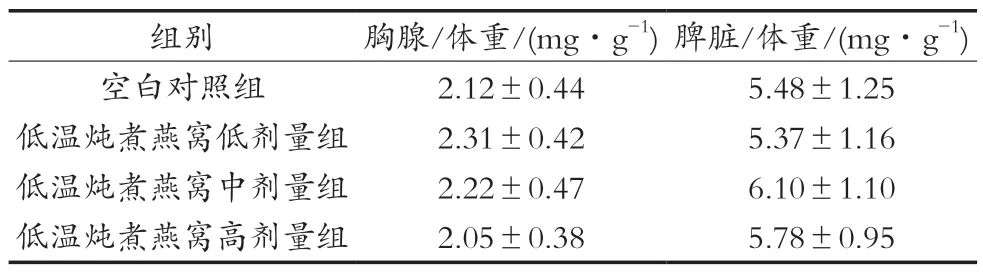
表1 低温炖煮燕窝对小鼠脏器/体重比值的影响(±SD,n=12)
2.2 低温炖煮燕窝对小鼠细胞免疫功能的影响
迟发型变态反应是由于抗原进入机体后,细胞在局部接受抗原信息转化为致敏淋巴细胞。致敏淋巴细胞再次接触相同抗原时,释放出多种淋巴因子,促使血流中单核细胞向局部聚集和吞噬抗原。迟发型变态反应是以淋巴细胞和单核-巨噬细胞浸润为主的渗出性炎症,因此可通过测量皮肤再次受相同抗原刺激后的肿胀厚度反映细胞免疫功能的强弱[18]。试验结果如表2所示,小鼠足趾肿胀度在各剂量组与对照组间比较无显著性差异。
表2 低温炖煮燕窝对小鼠足趾肿胀和ConA诱导的小鼠淋巴细胞转化试验的影响(±SD,n=12)
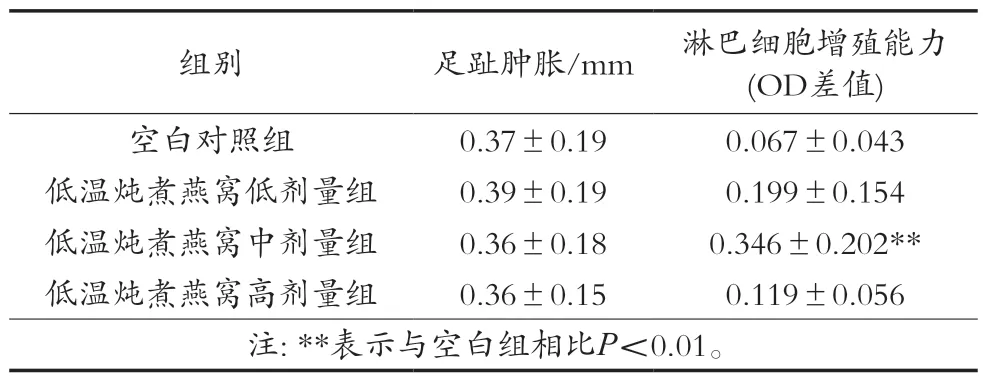
表2 低温炖煮燕窝对小鼠足趾肿胀和ConA诱导的小鼠淋巴细胞转化试验的影响(±SD,n=12)
淋巴细胞是适应性免疫反应的关键参与细胞,主要负责激活抗原呈递和有丝分裂原刺激过程。脾脏淋巴细胞增殖是激活细胞和体液免疫反应的重要生物标志物,而这种活性是由有丝分裂原ConA诱导,通常用于评估T或B淋巴细胞活性[19-22]。低温炖煮燕窝对小鼠淋巴细胞增殖试验结果如表2所示,低温炖煮燕窝中剂量组可以显著促进ConA刺激的脾淋巴细胞增殖(P<0.01)。
2.3 低温炖煮燕窝对小鼠体液免疫功能的影响
溶血空斑试验是一种定量测量样品增强体液免疫反应的方法,可用于检测和计数产生IgM及其他类型免疫球蛋白的抗体生成细胞(浆细胞),溶血空斑数即为抗体生成细胞数,可用于表征体液免疫功能强弱[23]。低温炖煮燕窝对小鼠抗体生成细胞数如表3所示,各剂量组均可以显著增加小鼠抗体生成细胞数(P<0.01)。此外,血清溶血素水平作为体液免疫的重要指标,可以反映B细胞与特定抗原接触后分泌溶血素的能力[24]。小鼠半数溶血值(HC50)在高、中、低剂量与对照组间比较均无显著性差异(P>0.05)。
表3 低温炖煮燕窝对抗体生成细胞数和HC50的影响(±SD,n=12)
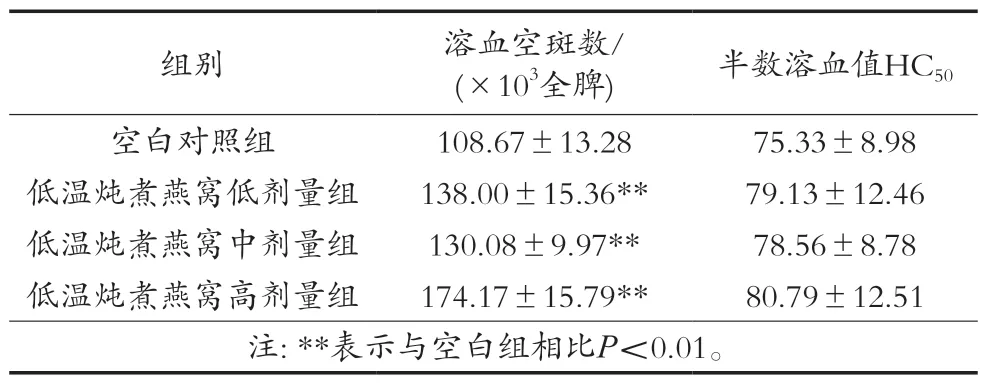
表3 低温炖煮燕窝对抗体生成细胞数和HC50的影响(±SD,n=12)
2.4 低温炖煮燕窝对小鼠单核-巨噬细胞吞噬功能的影响
碳廓清试验可以评估样品对网状内皮系统(reticuloendothelial system,RES)的影响,RES是由吞噬细胞组成的弥散系统,RES细胞在从血流中清除颗粒方面起着至关重要的作用[25]。当小鼠静脉注射含有胶体碳的墨水时,巨噬细胞会吞噬墨水中的碳颗粒,墨水(碳颗粒)从血液中清除的速度称为吞噬指数,吞噬细胞在宿主防御中起着不可或缺的作用[26]。如表4所示,高剂量组低温炖煮燕窝增加血液中胶体碳的清除率,显著提高吞噬指数,这可能是因为高剂量组低温炖煮燕窝组小鼠RES活性增加所致。
表4 低温炖煮燕窝对小鼠单核-巨噬细胞碳廓清能力和小鼠巨噬细胞吞噬鸡红细胞能力的影响(±SD,n=12)
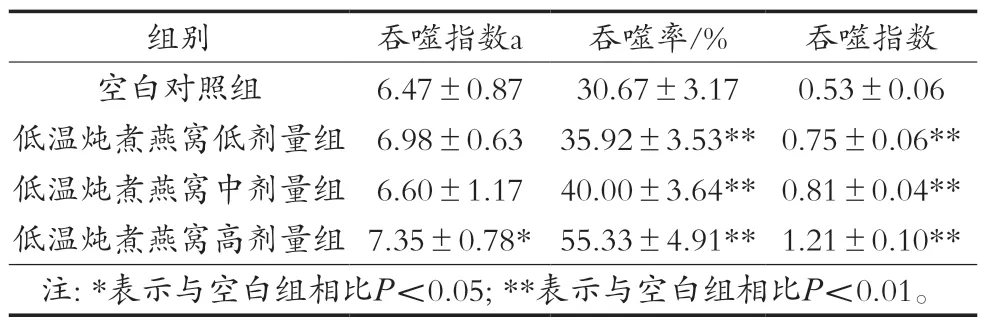
表4 低温炖煮燕窝对小鼠单核-巨噬细胞碳廓清能力和小鼠巨噬细胞吞噬鸡红细胞能力的影响(±SD,n=12)
吞噬细胞包括单核巨噬细胞和中性粒细胞,具有对颗粒性异物进行吞噬和消化的功能,在机体固有性免疫中发挥重要作用。小鼠腹腔注射鸡红细胞后,会被腹腔中的巨噬细胞吞噬。因此通过计算腹腔巨噬细胞吞噬百分率和吞噬指数,可有效评估小鼠吞噬细胞的吞噬功能[27]。试验结果如表4所示,各剂量组低温炖煮燕窝均可以显著提高小鼠巨噬细胞吞噬率及吞噬指数(P<0.01)。
2.5 低温炖煮燕窝对小鼠NK细胞活性的影响
NK细胞处于保护机体免受病原体侵袭和感染的第一道防线,以非特异性杀死病原体和受感染细胞而闻名,证明NK细胞在免疫系统的早期阶段控制感染中发挥作用[28-29]。NK细胞还可通过释放免疫调节细胞因子和趋化因子、调节DC活性及粒细胞生长和分化调节免疫反应,NK细胞在先天性免疫反应中发挥重要作用,并起到从先天性免疫反应到适应性免疫反应的桥梁作用[30]。
因此为确定低温炖煮燕窝对NK细胞活性影响,测定从共培养的脾细胞和YAC-1细胞获得的上清液中乳酸脱氢酶(LDH)的相对量。试验结果如表5所示,与空白对照组相比,低中剂量组低温炖煮燕窝的NK细胞活性无显著性影响,而高剂量组低温炖煮燕窝可以显著促进NK细胞活性(P<0.05),表明低温炖煮燕窝具有通过NK细胞自身诱导的调节机制来改善免疫系统的潜力。
表5 低温炖煮燕窝对小鼠NK细胞活性的影响(±SD,n=12)

表5 低温炖煮燕窝对小鼠NK细胞活性的影响(±SD,n=12)
3 结论
综上所述,试验揭示低温炖煮燕窝的免疫调节功能。依据动物试验结果,低温炖煮燕窝不仅可以显著提高小鼠抗体生成细胞数,增强小鼠腹腔巨噬细胞吞噬鸡红细胞能力,还可有效提升NK细胞活性,结果表明低温炖煮燕窝可作为一种增强免疫功能性食品。试验结果进一步为燕窝保健食品开发利用提供科学的参考依据。

