热处理对杏仁分离蛋白结构及热稳定性的影响
王彦惠,吴清浊,孙瑜彤,刘星雨,陈振家
山西农业大学食品科学与工程学院(太谷 030800)
杏仁属蔷薇科植物[1],可药食两用,富含44%~61%的脂肪、16%~26%的蛋白质、较低含量的碳水化合物[2]及多种矿物元素和维生素[3],具有丰富的营养价值和药用作用[1-4]。杏仁蛋白富含人体必需的8种氨基酸[5],与总氨基酸的比值(EA/TAA)接近于国际参考模式(FAO/WHO)[4-6],是良好的食用蛋白资源。近年来,随着现代社会对健康饮食需求的增加,消费者对以“健康、天然、营养”为品类特征的植物蛋白饮品表现出极大兴趣。杏仁中含有18%~24%的水溶性蛋白,在植物蛋白饮品方面具有较大的发展空间。
杏仁乳经过热处理后,蛋白质结构会发生变化,进而影响到其热稳定性和消化性。Devnani等[7]研究热处理(45~90 ℃,30 min)对杏仁奶蛋白结构的影响,结果表明,55~75 ℃的中等温度处理会导致杏仁蛋白发生变性和部分聚集,85~95 ℃的较高温度则会引起更广泛的变性和凝胶化,并形成自支撑的弱絮状颗粒凝胶结构。继续研究pH和加热程度对杏仁蛋白结构和性质的影响[8],结果表明在不同pH条件下,加热处理会使得杏仁蛋白产生不同的微观结构凝胶强度。
国内关于热处理对API结构和特性的影响研究鲜有报道。试验分析不同热处理对API结构变化和聚集特性规律的影响,以确保高品质杏仁乳的生产。
1 材料与方法
1.1 材料
杏仁(市售)。
1.2 试剂
电泳试剂(AMRESCO分装);考马斯亮蓝G-250、牛血清蛋白(上海生工生物工程技术服务有限公司);低分子量标准蛋白(上海生物化学研究所)。
1.3 主要仪器与设备
T18-basic高速剪切仪(德国艾卡设备有限公司);FD-1冷冻干燥机(北京博医康技术公司);YS-04A小型高速粉碎机(北京燕山正德机械设备有限公司);UV-1200紫外可见分光光度计(上海美谱达仪器有限公司);RF5301PC荧光分光光度计(日本岛津公司);Cary 60紫外可见分光光度计(美国安捷伦科技公司);ZS90纳米激光粒度仪(英国马尔文帕纳科公司)。
1.4 方法
1.4.1 API制备
将新鲜杏仁高速粉碎5 min,料液比1︰5(g/mL)加入石油醚,室温下搅拌4 h,待石油醚挥发干净后得脱脂杏仁粉。采用碱提酸沉法制备API,在50 ℃恒温水浴下调节pH 9.0溶出分离蛋白,取上清液,调节pH 4.5使杏仁蛋白沉淀,中和溶液pH后经真空冷冻干燥得到API[9]。参考GB 5009.5—2016《食品中蛋白质的测定》对API进行测定,杏仁蛋白质含量=总氮含量×5.18,经检验,制备的API含量为57.766 9%,符合国标标准[10-11]。
1.4.2 API热处理
配制3%的API溶液,室温下搅拌1 h后离心(4 000 r/min、15 min),取上清液完成后续试验。未经热处理的作为对照组,试验组分别放于水浴锅(65 ℃、30 min,90 ℃、15 min)和油浴锅(121 ℃、3 min)进行热处理,将热处理后的样品进行离心操作(10 000 r/min、15 min)并进行理化指标的测定。
1.4.3 API溶解度测定
参照Bradford法[12]测定上清液蛋白溶解度。
1.4.4 聚丙烯酰胺(SDS-PAGE)凝胶电泳的测定
参考Laemmli[13]的SDS-PAGE法对API进行分析。取上述不同处理蛋白样品中的上清液和底部沉淀制备电泳样品,上清液和沉淀的添加量不超过1 mg/mL(m蛋白︰m电泳液)。制得的浓缩胶浓度5%、分离胶浓度12%、样品上样量6 μL。电泳前设置恒压进行电泳[14-15]。电泳结束后,电泳胶片先固定3 h后用考马斯亮蓝G-250染色2.5 h,过夜脱色后扫描成像,此为非还原SDS-PAGE。还原SDS-PAGE需添加2%β-巯基乙醇做还原处理进行对比[16]。
1.4.5 游离巯基和总巯基测定
游离巯基的测定:定量API加入反应缓冲液A(0.1 mol/L pH 8.0磷酸钠缓冲液,含1 mmol/L EDTA),室温下搅拌2 h,10 000×g离心10 min,取5.5 mL上清液加入0.1 mL Ellman’s试剂溶液,混合均匀后室温避光放置15 min,在波长412 nm下测量吸光度;空白加5.5 mL反应缓冲液A;根据标准曲线换算表面巯基含量。总巯基测定与游离巯基的测定类似,只需将反应缓冲液换为缓冲液B(0.1 mol/L、pH 8.0磷酸钠缓冲液,含1 mmol/L EDTA,8 mol/L尿素),其他步骤同游离巯基的测定[17]。
1.4.6 荧光光谱分析
对热处理后的API上清液进行测定。设置荧光光谱激发波长295 nm,发射光谱扫描范围为300~400 nm,激发狭缝和发射狭缝宽均为3 nm[18]。
1.4.7 红外光谱分析
参考Qi等[19]的方法,对热处理离心后的白色沉淀冻干物进行红外测定。取5 mg冻干样品与500 mg溴化钾混合研磨(1︰100),压片机压成薄片。设置红外光谱仪的分辨率4 cm-1,波数范围400~4 000 cm-1,扫描次数32次。采用Peakfit 4.12(Systat Software,Inc.,San Jose,USA)软件对酰胺Ⅰ区进行拟合分析,用高斯解卷积方法对峰进行处理并进行2阶导数拟合。
1.4.8 粒径、电位测定
用Zetasizer Nano ZS90 instrument对热处理离心后的API上清液进行测定[20]。测定前用0.45 μm水系微孔滤膜过滤。
1.4.9 紫外分析
在近紫外光区对热处理离心后的API上清液进行扫描测试,扫描速度210 nm/min,对吸收曲线求2阶倒数,得到相应导数光谱[21]。
1.4.10 数据分析
所有试验均设3次重复,数据进行均值与方差分析并以平均值±标准差表示。通过单因素方差分析对试验数据进行差异显著性分析。所使用的分析软件为SPSS 18.0,作图软件为Origin 8.0。
2 结果与分析
2.1 杏仁分离蛋白溶解度
图1是不同热处理条件下的API溶解度的变化情况。65 ℃、30 min处理的杏仁蛋白溶解度显著上升,而121 ℃、6 min处理的蛋白溶解度显著下降(P<0.05),这是因为加热温度超过变性温度,蛋白发生变性聚集[22],同时蛋白亚基在热作用下发生解离并选择性进行疏水缔合,导致蛋白聚集沉淀,从而导致溶解度下降[17,23]。
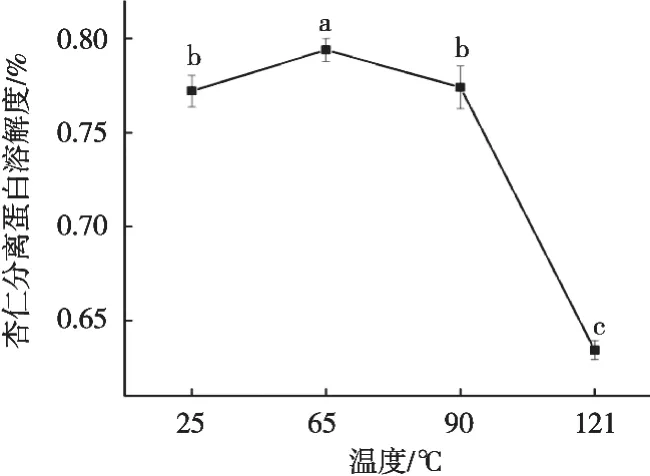
图1 不同热处理条件下API溶解度
2.2 SDS-PAGE凝胶电泳分析
由图2和图3可知,热处理API上清液和沉淀的非还原和还原电泳图谱有明显差异,这说明API亚基结构中存在分子间二硫键,还原剂β-巯基乙醇的加入致使二硫键被打断进而造成亚基分布的差异。由图2(a)可知,90 ℃、15 min和121 ℃、3 min处理使得亚基间同时发生解离和缔合,其中65.3,62.8和36.6 kDa条带颜色变浅,部分消失并形成数条新的电泳条带(97.4,41.2和66.2 kDa)。这说明部分亚基间二硫键断裂的同时又形成新的分子间二硫键。由图2(b)可知,还原电泳条带基本相似,这说明热处理虽然改变亚基间二硫键的形成方式和模式,但并未改变亚基组成也未造成亚基间的共价结合。图3(a)则表明虽然热处理同样改变聚集并发生沉淀的杏仁蛋白亚基间的二硫键作用,但其影响程度小于可溶蛋白,这说明蛋白的聚集沉淀减弱了热处理效应。对比图2(b)和图3(b)可知,热处理造成API沉淀的亚基组成相似,但亚基比例含量有较大差异且温度呈正相关。其中,38.9 kDa和41.2 kDa这2个条带在上清液中较宽且颜色很深,而在图3(b)中变细,且随温度升高逐渐变浅。62.8 kDa和65.3 kDa这2个条带在121 ℃、3 min时甚至全部消失。这说明API亚基受热处理的影响不同,相比22 kDa亚基,38.9,41.2,62.8和65.3 kDa在热处理过程中更易发生聚集沉淀。同时随温度上升,所造成亚基参与数量越多且聚集程度越高。
某公路在2002年开始通车,运营了16年,现阶段,已经完全进入到大修时期,在这16年期间,该公路总共经历数次保小修与中修,路面状况比较差,使得养护维修难度不断增强,再加上该公路路面宽度大,养护过程之中,需要耗费许多人力与物力。为了保证该公路大中修工程养护效率得到全面提升,养护单位需要仔细分析公路路面基础信息数据,并且结合公路施工技术指标,包括公路路面结构特性与以往的养护情况等,对需要养护的路段进行全面勘察,结合公路大中修养护管理单位提供的意见,了解公路养护需求,组织专业的养护人员实施养护。
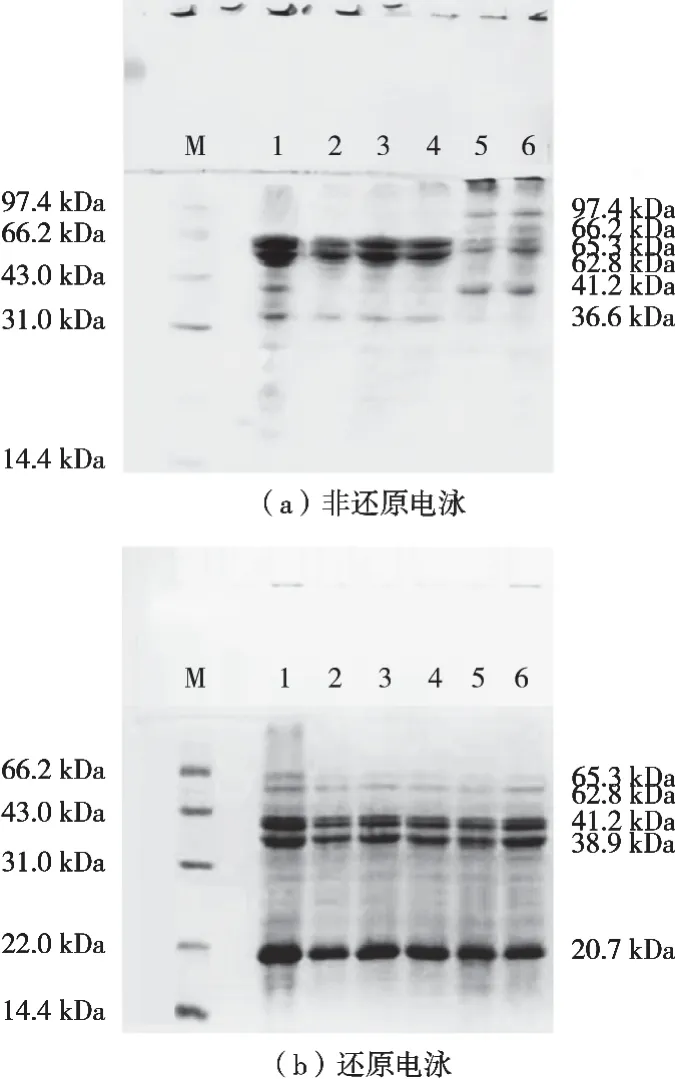
图2 不同热处理条件下上清液API非还原(N)和还原(R)SDS-PAGE
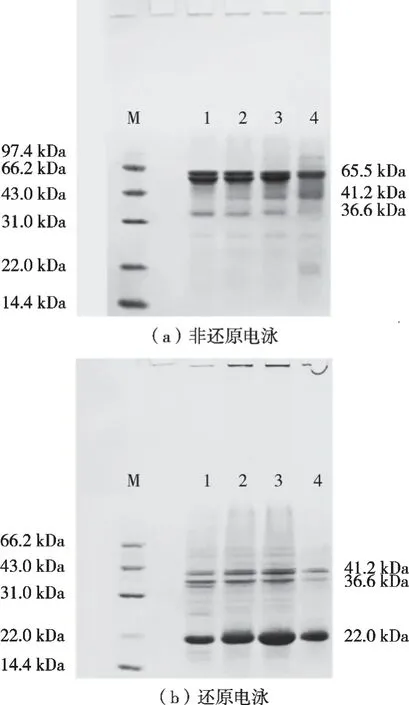
图3 不同热处理条件下沉淀API非还原(N)和还原(R)SDS-PAGE
2.3 总巯基和游离巯基测定
总巯基包括游离巯基和埋藏在蛋白质内部的巯基[24],巯基是形成二硫键的官能团,而二硫键是维持蛋白质分子三级结构的重要作用力[25]。由图4可知,65 ℃、30 min处理下API游离巯基含量最高,且随着热处理组别温度的升高,API游离巯基含量显著下降(P<0.05)。这可能是因为低温加热导致原本存在的二硫键断裂或嵌入分子中的巯基被释放,蛋白质分子发生重链解折叠[26-27]。总巯基在65 ℃、30 min处理下含量最低。游离巯基与总巯基的比值能够反映蛋白质三级结构的解折叠程度,比值越大,蛋白的解折叠程度越强[28-29]。图4表明65 ℃、30 min处理下,API三级结构的解折叠程度最大,分子舒展。随着温度的升高,总巯基含量明显增加,维系蛋白质亚基间的二硫键断裂,这本应同时增加游离巯基的数量,但变性后的蛋白亚基在疏水作用的推动下发生大量聚集,使得已暴露的游离巯基重新被包埋,API的解折叠程度降低。热处理导致二硫键形成的游离巯基大多会形成新的二硫键以推动聚集体的形成[17]。
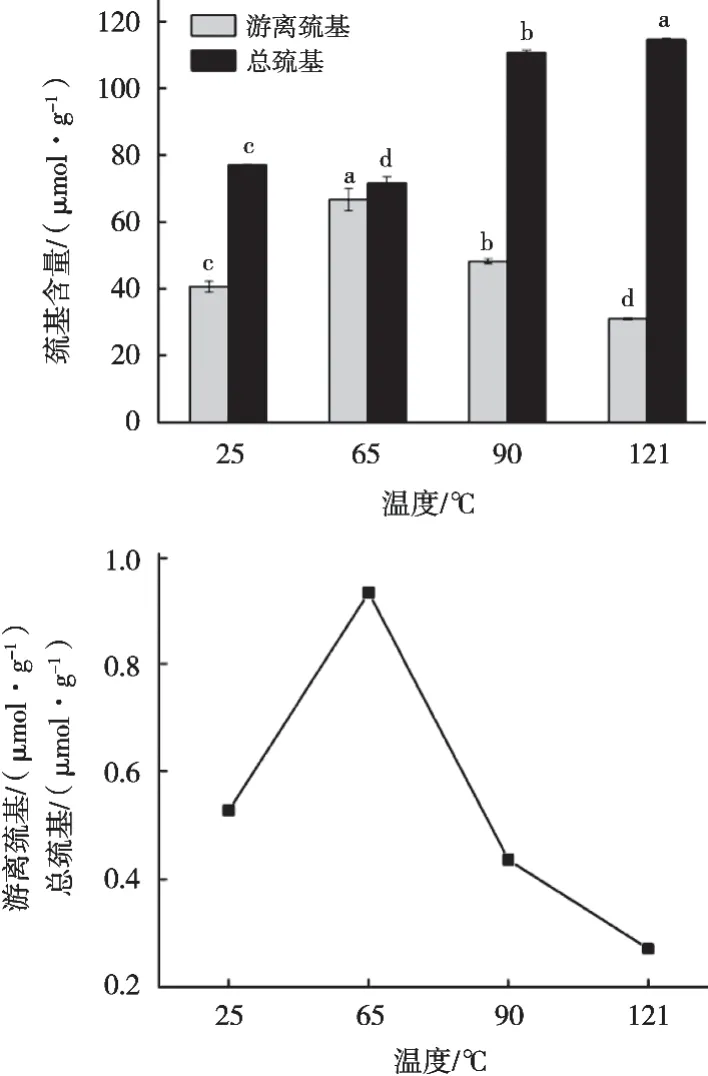
图4 不同热处理条件下API总巯基和游离巯基的含量和比例
2.4 内源性荧光光谱分析
内源性荧光光谱主要用于检测蛋白质的三级结构变化[30]。由图5可知,随着热处理温度的升高,API内源性最大荧光峰位从波长347 nm红移到波长353 nm,这说明65 ℃、15 min和90 ℃、3 min的热处理导致杏仁蛋白质分子在溶液中的暴露程度增加,芳香残基从蛋白质内部的疏水环境转移到分子表面极性较强的环境中[17,31]。121 ℃、3 min时最大荧光峰位蓝移,说明API中色氨酸残基微环境非极性增强[32-33],这可能与高温热处理诱导色氨酸残基通过疏水侧链的蛋白质聚集有关[34]。
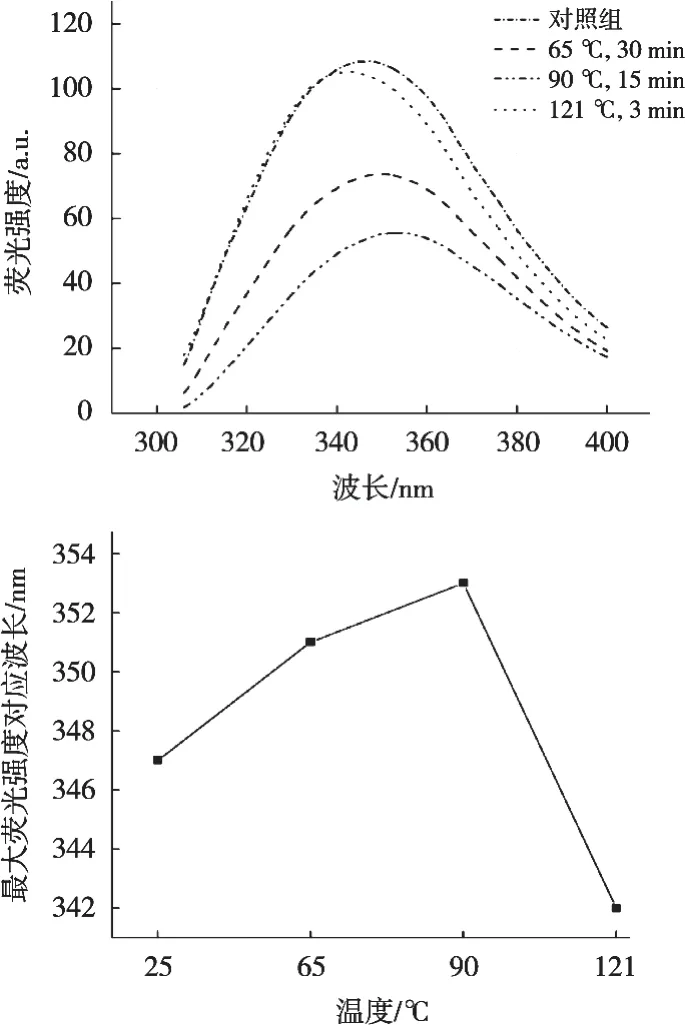
图5 不同热处理条件下API的内源荧光发射图谱
2.5 红外光谱分析
酰胺Ⅰ区常被用于分析蛋白质的二级结构变化。参考Long等[35]的研究方法对酰胺Ⅰ带进行各峰归属,1 600~1 625 cm-1为分子间β-折叠,1 626~1 640 cm-1为分子内β-折叠,1 641~1 650 cm-1为无规则卷曲,1 651~1 660 cm-1为α-螺旋,1 661~1 685 cm-1为β-转角,1 686~1 700 cm-1为反向平行β-折叠[36-37]。
由图6可知,不同热处理条件下蛋白质的吸收光不同,有波数的变化也有波峰的偏移,说明API的二级结构确实发生相应的变化。从图7可知,PI的二级结构主要为β-折叠和β-转角。65 ℃、30 min,90 ℃、15 min和121 ℃、3 min的热处理导致API出现无规则卷曲,这表明热处理条件下API的二级结构稳定性下降,β-折叠等结构被破坏[38],蛋白质从有序结构向无序转变[39]。且β-折叠结构变化较为复杂,包括分子内、分子间和方向平行等多种形式。结合图7可知,对照组中的β-折叠主要以反向平行β-折叠为主。随着处理组别温度的升高,反向平行β-折叠显著减少并转化为分子间和分子内的平行β-折叠。总之,热处理使得维持APIβ-折叠结构中氢键断裂,由相对有序的β-折叠结构逐渐转变为无序的β-转角和无规则卷曲结构,API变性。
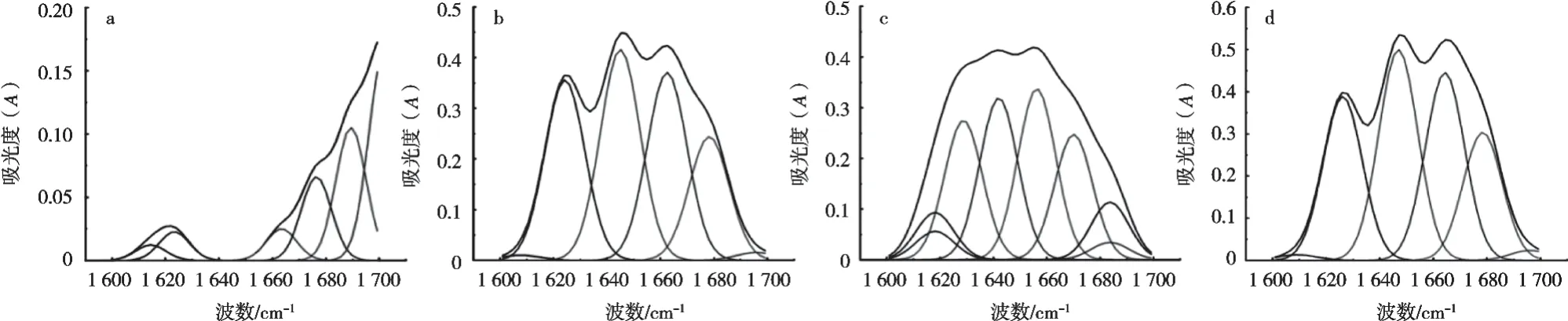
图6 不同热处理后API的酰胺I带曲线拟合图谱
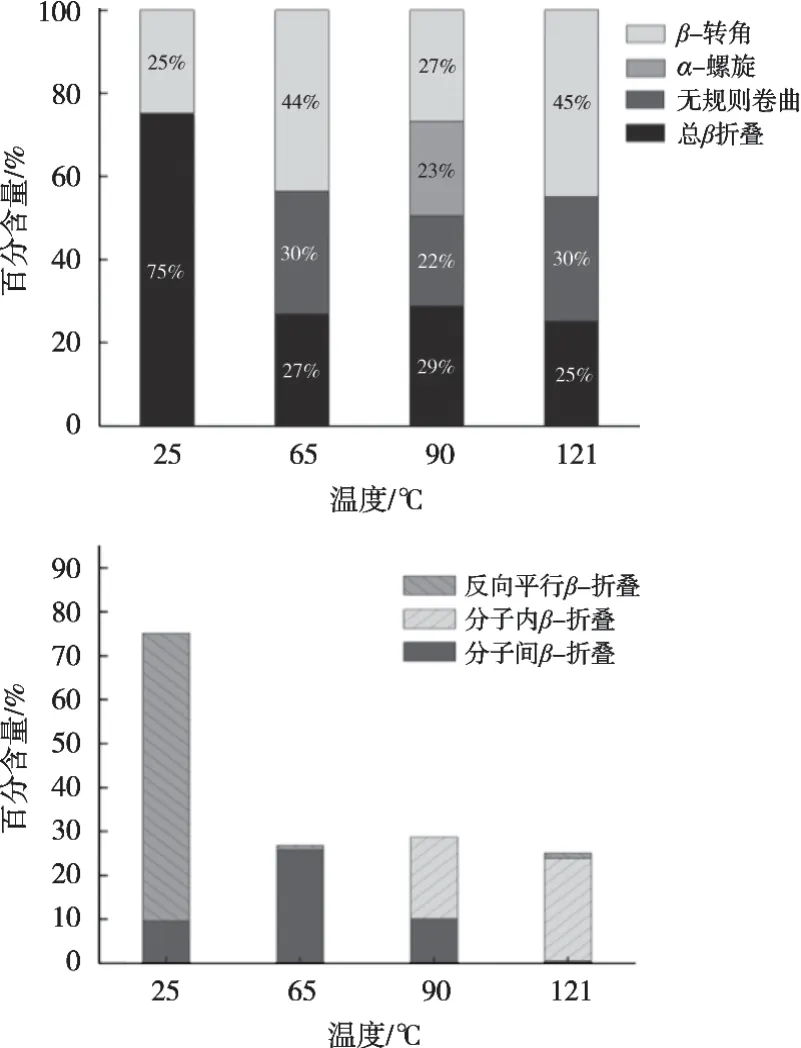
图7 不同热处理后API二级结构的含量变化
2.6 Zeta电位分析
Zeta电位的绝对值大小直接关系静电排斥相互作用的强弱及溶液中颗粒之间的空间大小[40]。Zeta电位的绝对值越高,溶液体系越均匀稳定[41-42]。绝对值越低则表明悬浮颗粒易于凝结或絮凝[43]。由图8可知,热处理条件为90 ℃、30 min和121 ℃、3 min时,Zeta电位绝对值小于30 mV,蛋白表面所带的同性电荷较少,分子间存在聚集沉淀趋势[44],这可能是因为热处理使蛋白质结构发生去折叠,原本暴露在表面的带电氨基酸随蛋白质结构的改变而发生内折,表面静电荷密度减小[45]。

图8 不同热处理条件下API电位的变化
2.7 粒径分析
乳液的稳定性在很大程度上受平均粒径的影响,通常情况下,乳液粒径越小越稳定[46]。API粒径的变化主要是由热处理导致蛋白质分子内的交联和聚集引起的[47-48]。由图9可知,对照组和65 ℃、30 min处理的API只出现有一个波峰,位于100~1 000 nm之间,平均粒径分别为198.3 nm和183.6 nm。而90 ℃、15 min和121 ℃、3 min处理下API表现出多峰结构且分布范围变宽,这表明升温处理导致蛋白质解离破碎成更小的聚集体,且当热处理条件为121 ℃、3 min时,API的平均粒径显著增大至393.0 nm(P<0.05),这是因为新形成的聚集体在热力学上并不稳定,表面基团在疏水推动力和高温作用下重聚的可能性增加[24]。

图9 不同热处理条件下API粒径分布和平均粒径图
2.8 紫外吸收光谱分析
紫外吸收光谱可以反映蛋白质近紫外区域的三级结构和聚集状态,用于研究蛋白质构象变化[49]。与25℃对照组相比,65 ℃、30 min和90 ℃、15 min下的表征色氨酸和酪氨酸残基的紫外吸收峰均发生红移,这表明疏水区域的芳香族氨基酸发生不同程度的暴露,部分酪氨酸残基转移到极性微环境中[50]。由图10可知,121 ℃、3 min时紫外吸光度基本消失,这可能是因为蛋白质高度折叠变性,生色基团被完全包裹或热处理导致生色氨基酸基团发生氧化。
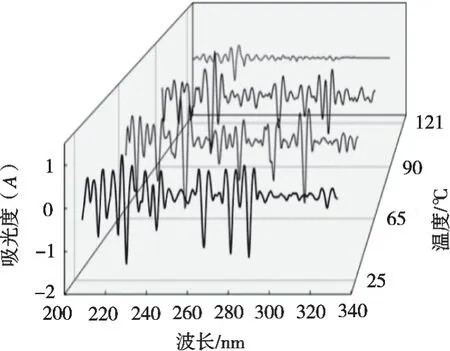
图10 不同热处理条件下杏仁蛋白的紫外2阶导数光谱
3 结论
热处理对杏仁蛋白的结构及热稳定性有较大影响。121 ℃、3 min的超高温热处理会导致杏仁分离蛋白发生不可逆变性,β-转角和无规则卷曲含量增加,粒径变大,溶解度降低。而65 ℃、15 min模拟巴氏加热的热处理方式可通过使杏仁分离蛋白三级结构发生一定程度解折叠,从而提高其热稳定性。虽然不同热处理方式改变亚基间二硫键的形成方式和模式,但实际上并未改变亚基组成也未造成亚基间的共价结合。试验结果为实践中生产杏仁蛋白乳制品提供理论基础。

