调强放射治疗未分化型鼻咽癌的疗效及治疗前后血清sE-cad与PDGF水平变化探讨
冯谢敏,宋炜,马军伟,史磊
(延安大学附属医院 1.肿瘤科一病区;2.肿瘤放射治疗科, 陕西 延安 716000)
鼻咽癌(nasopharyngeal carcinoma,NPC)属头颈部常见恶性肿瘤,其分布特点为地域差异明显,主要分布在东南亚地区,此疾病会导致患者出现持续性疼痛,降低生存质量[1]。NPC病理组织类型以低分化鳞状细胞癌为主,未分化癌仅占3%~5%,但未分化NPC恶性程度较高,治疗效果往往较差[2]。由于鼻咽部解剖结构复杂,发生癌变后易出现局部浸润或淋巴结转移,手术治疗难度较大,而NPC对放疗敏感性较高,故放疗成为NPC的主要治疗方式[3]。NPC患者早期予以放疗可取得较好的疾病控制率,既往常规放疗技术虽可使患者生存时间延长,但其放射野面积较大,可能损伤正常组织,引发并发症,降低患者生存质量[4]。随放疗技术发展,三维放疗技术通过影像学技术将肿瘤结构实施三维重建,准确找寻病灶位置,使靶区照射剂量提升,降低正常组织照射剂量,从而有助于降低放疗毒副作用,提升治疗效果[5]。三维适形放射治疗(3-dimensional conformal radiation therapy,3DCRT)、调强放射治疗(intensity-modulated radiation therapy,IMRT)均属于三维放疗技术,在NPC的治疗中具有重要意义[6]。但临床对于3DCRT、IMRT在未分化型NPC中的疗效如何尚未有相关报道。研究指出,上皮型钙黏蛋白(serum epithelial cadherin,sE-cad)、血小板源性生长因子(platelet-derived growth factor,PDGF)在NPC的发生、发展中具有重要作用,通过检测其水平可评估治疗效果及预后[7]。基于此,本研究选取我院未分化型NPC患者,对比分析3DCRT、IMRT对其疗效及血清sE-cad、PDGF水平的影响。现总结报道如下。
1 资料和方法
1.1 临床资料
本研究经我院医学伦理委员会审核。选取2019年6月—2021年6月收治的84例未分化型NPC患者,按照随机数字表法按1∶1比例分为观察组和对照组,每组41例。两组一般资料比较,差异无统计学意义(P均>0.05),具体数据见表1。
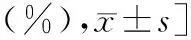
表1 两组患者临床资料比较 [例
纳入标准:①均符合NPC诊断标准[8],并经病理组织检查确诊,且均为未分化型;②首次确诊,无放化疗治疗史;③预计生存期超过6个月;④依从性良好,均配合完成相关检查、治疗;⑤卡氏(KPS)评分>60分;⑥均知情同意本研究。
排除标准:①合并严重感染;②发生远处转移;③合并其他恶性肿瘤;④存在治疗禁忌证。
1.2 方法
所有患者均予以含铂类的化疗方案治疗,第1天,静滴紫杉醇(北京协和药厂有限公司,国药准字H20083786)135 mg/m2,第3天,静滴洛铂(海南长安国际制药有限公司,国药准字H20080359)50 mg/m2,4周为1个周期,治疗3~6个周期。所有患者在化疗后第2个周期进行放疗。两组患者治疗7周后取晨起空腹静脉血4 mL,离心15 min(3 500 r/min,8 cm),分离血清,采用电化学发光法(试剂盒购自上海美轩生物公司)测定肿瘤标志物水平血清角蛋白19片段21-1(keratin 19 fragment 21-1,CYFRA21-1)、癌胚抗原(carcinoembryonic antigen,CEA)水平;采用化学发光免疫分析法(试剂盒购自广州健仑生物公司)测定血清鳞状细胞癌相关抗原(squamous cell carcinoma-associated antigen,SCC-Ag)水平;采用放射性免疫法(试剂盒购自上海信帆生物公司)测定两组患者治疗前和治疗7周后纤维化指标透明质酸(hyaluronic acid,HA)、层黏连蛋白(laminin,LN)、Ⅲ型前胶原(procollagen type Ⅲ,PCⅢ);采用酶联免疫吸附法(试剂盒由上海酶联生物公司提供)测定两组患者治疗前和治疗7周后血清sE-cad、PDGF水平。
1.2.1 对照组 采用3DCRT治疗,取仰卧位,将头颈部以U形面罩固定,采用模拟定位机对患者头部进行扫描,分别采用平扫、增强扫描从头顶一直扫描到锁骨头下3 cm,再结合MRI检查图像大体勾画病灶范围,再根据融合后图像标出原发肿瘤、转移淋巴结边界以及重要器官,将数据输入到仪器,对病灶处、上颈部、头面部以共面野静态照射,下颈部、锁骨处以常规放疗方法照射;剂量设置:病灶区65~70 Gy,预防照射区50~55 Gy,每周5次,治疗7周。
1.2.2 观察组 采用IMRT治疗,设计出调强放疗范围,常规颈前半野照射下颈部、锁骨上区,调强照射鼻咽癌靶区、上颈部。原发病灶GTV1中位剂量72.13 Gy/34f,颈部转移淋巴结区域GTV2中位剂量70 Gy/33f,高危预防区CTV1剂量56 Gy/28f,低危预防区CTV2剂量50 Gy/28f;每周5次,治疗7周。
1.3 疗效评估标准
以实体瘤疗效评价标准[9]对疗效进行评估,病灶消失1个月以上为完全缓解;肿瘤缩小≥30%1个月以上为部分缓解;肿瘤缩小<30%或增大<20%为稳定;肿瘤增大≥20%为病灶进展。
1.4 观察指标
①比较两组患者治疗7周后的疗效。②比较两组患者治疗前和治疗7周后肿瘤标志物CEA、SCC-Ag、CYFRA21-1水平。③比较两组患者治疗前和治疗7周后生活质量核心量表QLQ-C30评分,分值为28~112分,分值越高,生活质量越差。④比较两组患者治疗前和治疗7周后纤维化指标HA、LN、PCⅢ。⑤比较两组患者治疗前和治疗7周后血清sE-cad、PDGF水平。⑥比较两组患者治疗期间并发症发生率,根据CTCAE4.0版[10]并发症评价标准评估。
1.5 统计学方法
2 结果
2.1 疗效
治疗7周后,观察组疾病控制率95.24%,显著高于对照组(80.95%),两组差异具有统计学意义(χ2=4.086,P<0.05),见表2。
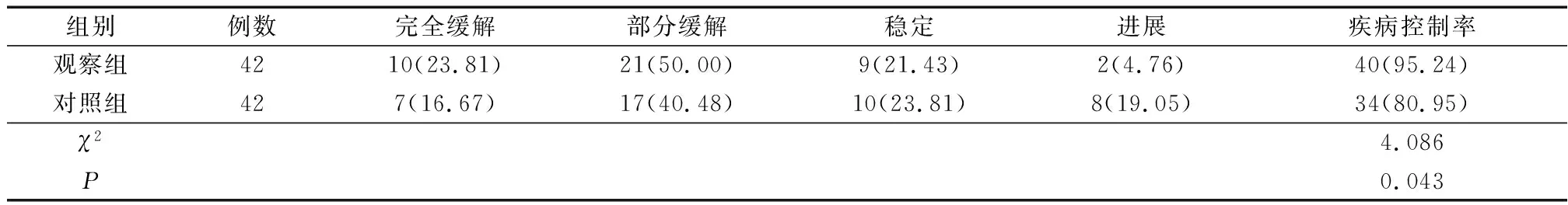
表2 两组患者治疗7周后疗效比较 [例(%)]
2.2 肿瘤标志物
治疗前两组患者血清CEA、SCC-Ag、CYFRA21-1水平比较,差异无统计学意义(t=0.733、0.482、1.152,P>0.05);治疗7周后两组患者血清CEA、SCC-Ag、CYFRA21-1水平均较治疗前降低,且观察组较对照组低(t=3.301、4.067、4.231,P<0.05),见表3。

表3 两组患者治疗前后肿瘤标志物比较
2.3 生活质量
治疗前两组患者QLQ-C30评分比较,差异无统计学意义(t=0.976,P>0.05),治疗7周后两组患者QLQ-C30评分较治疗前降低,且观察组较对照组低(t=21.038、14.708、4.810,P<0.05),见表4。

表4 两组患者治疗前后生活质量比较
2.4 纤维化指标
治疗前两组患者血清HA、LN、PCⅢ水平比较,差异无统计学意义(t=0.552、0.920、0.688,P>0.05),治疗7周后两组患者血清HA、LN、PCⅢ水平均较治疗前升高,但观察组较对照组低(t=3.464、2.266、3.152,P<0.05),见表5。
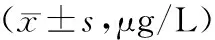
表5 两组患者治疗前后纤维化指标
2.5 血清sE-cad、PDGF水平
治疗前2组血清sE-cad、PDGF水平比较,差异无统计学意义(t=0.489、1.309,P>0.05),治疗7周后2组血清sE-cad、PDGF水平均较治疗前降低,且观察组较对照组低(t=4.876、11.396,P<0.05),见表6。

表6 两组患者治疗前后血清sE-cad、PDGF水平比较
2.6 并发症发生率
观察组并发症发生率较对照组低(χ2=6.604,P<0.05),见表7。

表7 两组患者并发症发生率比较 [例(%)]
3 讨论
NPC为我国常见高发恶性肿瘤之一,源于鼻咽腔上皮组织,我国NPC发生率约为10/10万,较世界平均水平高[11]。未分化型NPC往往恶性程度较高,在疾病进展过程中易出现转移、侵袭,因此对于未分化型NPC更加需要实施积极有效治疗。
由于NPC位置特殊,手术治疗往往难度较大,而其对放疗敏感性较高,因此放疗常作为NPC的重要手段及主要方法[12]。放疗中通过放射射线,可与癌细胞间发生能量传递,使癌细胞结构及细胞活性发生变化,从而抑制癌细胞增殖、转移,进而消灭癌细胞,延长患者生存时间[13]。NPC放疗照射野早期为面颈分野,但在照射过程中靶区常出现剂量重叠和、漏现象,而面颈联合野可有效避免,成为NPC标准放疗方式[14]。常规放疗由于等中心照射视野呈方形,对NPC适形度不高,肿瘤控制率并不理想,且正常组织仍存在一定程度过度照射,从而引发一系列不良反应,使患者生存质量明显降低[15]。因此优化放疗方案对提升NPC患者治疗效果及生存质量十分重要。近年来,随相关影像学技术、计算机技术发展,立体适形放疗技术逐渐应用于NPC放疗治疗中,其是在常规放疗的基础上发展的新型放疗技术,通过CT模拟定位及治疗计划系统,改善照射剂量分布,优化放射生物效应,可明显降低正常组织损伤,不仅能提升疗效,还可降低放疗毒副作用,安全性更高[16-18]。3DCRT、IMRT均属立体适形放疗技术,对NPC的治疗均有一定帮助,但在未分化型NPC的治疗中效果如何临床尚缺乏相关报道。基于此,本研究对未分化型NPC分别采用3DCRT、IMRT治疗,对比发现,IMRT疾病控制率显著高于3DCRT,且可有效提升患者生存质量,且安全性更高。分析原因在于通过射线照射可使癌细胞吸收辐射能量,对其细胞内部结构发挥作用,从而直接或间接损伤癌细胞,使癌细胞死亡;同时射线还可使人体组织间液电离,生成自由基,产生的自由基可与生物大分子产生作用,发生不可逆损伤,从而使癌细胞死亡,因此放疗可从多方面杀伤癌细胞,发挥抗肿瘤作用[19]。肿瘤放疗原则为降低正常组织照射量,提升靶区剂量,IMRT通过多个野共面或非共面照射,能很好地做到在给予靶区高剂量的同时,更多的危及器官得到很低剂量的照射,从而周围正常组织得到保护,提高了治疗增益比,且IMRT还具有逆向治疗计划系统,根据近期结果对剂量调整,以确保最优方案[20]。而3DCRT为人工优化正向治疗计划系统,治疗效果受医生经验影响,治疗计划可能并非最有方法,而是可接受方案,尤其是遇到需较多射野数时,人工优化更为困难[21]。因此采用IMRT技术效果更佳。肿瘤标志物为肿瘤疾病发生、发展过程中直接生成的与肿瘤紧密相关的活性物质,其中CEA、SCC-Ag、CYFRA21-1均为NPC常见肿瘤标志物,其水平变化可用于评估治疗效果[22]。本研究数据显示,治疗后观察组血清CEA、SCC-Ag、CYFRA21-1水平较对照组低,证实IMRT治疗的良好疗效。
研究指出,放疗作为细胞损伤性治疗方式,在消灭肿瘤细胞的同时,还会损伤正常组织,从而引发一系列并发症,其中间质纤维组织增生为NPC常见并发症,表现为上肢、颈部运动受限、颈部僵硬等,且纤维化程度与正常组织受到放射剂量有关,当间质纤维组织增生发生后,可使胶原、糖蛋白等间质成分增多,导致血清HA、LN、PCⅢ水平增加[23]。本研究通过分析治疗前后血清HA、LN、PCⅢ水平变化发现,两种治疗方式治疗后血清HA、LN、PCⅢ水平均有一定程度增加,但采用IMRT治疗以上血清水平增加较常规放疗少。由此说明IMRT可减轻颈部纤维化程度,这也说明IMRT可减少正常组织照射剂量,从而减轻颈部纤维化程度。此外,肿瘤的增殖分化受多种因素影响,血管新生在其增殖、转移、侵袭中发挥重要作用[24]。PDGF为酪氨酸蛋白激酶家族成员,肿瘤细胞可通过释放PDGF诱导血管内皮及血管新生,从而促使肿瘤细胞生长,抑制其凋亡;sE-cad作为一种高分子质量多肽,其在肿瘤的发生、侵袭、转移过程中具有重要作用[25]。李勇等[26]学者指出,sE-cad、PDGF可作为评估NPC生长、侵袭的指标,同时也是判断预后及复发的重要预测因子。本研究数据显示,治疗后观察组血清sE-cad、PDGF水平较对照组低,可知IMRT可通过增强病灶区域照射剂量,使肿瘤内部微环境发生改变,从而减少sE-cad、PDGF分泌,有助于抑制血管生成、肿瘤侵袭、转移,从而提升治疗效果。但具体相关机制尚未完全明确,可作为后续研究重点。
综上所述,与3DCRT相比,采用IMRT治疗未分化型NPC效果相当,但可有效降低肿瘤标志物及血清sE-cad、PDGF水平,提高生活质量,对正常组织影响更小,安全性高。

