持续高糖状态对Kv11.1离子通道蛋白表达的影响
韩稳琦,王 毅,陈海潮,尤红俊,邓纪钊,祁 杰
(陕西省人民医院心血管内二科,陕西 西安 710068)
长QT综合征(Long Q-T Syndromes,LQTS)可由快速延迟整流钾电流(Rapid component of delayed rectifier potassium current,IKr)的降低引起,IKr是人类ether-á-go-go相关基因(the human Ether-à-go-go-Related Gene,hERG)编码的心脏快速延迟整流钾通道(Kv11.1)α亚单位[1-4]。Ikr是动作电位复极期重要的外向离子流,各种因素及药物致Kv11.1表达减少及通道异常使IKr振幅减低导致QT间期异常易引起心肌心内外膜和M层细胞复极不均一,从而发生尖端扭转性室速(Torsade de pointes,TdP),甚至猝死[5-8]。研究发现糖尿病患者心脏中hERG通道的表达显著下调,这种下调是糖尿病复极减慢和QT间期延长的关键因素[9-10]。然而,对糖尿病诱导的IKr/hERG功能障碍的认识尚不完全,然而,目前尚不清楚不同葡萄糖浓度hERG的表达及蛋白转运是否发生改变。
本研究构建了以EGFP为报告基因的增强子真核表达重组质粒,脂质体转染构建HEK239T模型,以期通过EGFP 的自发荧光特点对HERG蛋白表达进行实时定量检测。本研究通过脂质体转染EGFP标记得HERG基因在HEK239T模型中明确地证明pEGFP-N1-HERG在不同浓度葡萄糖干预后KV11.1的表达,为糖尿病患者长期高糖状态时KV11.1通道异常导致QT间期延长的分子学机制提供科学依据。
1 材料和方法
1.1 实验材料 pcDNA3-HERG-C2质粒(氨苄青霉素抗性)由Wisconsin大学BD Anson教授赠予,pEGFP-N1质粒(卡那霉素抗性)购自Sigma公司,EcoRI和HindⅢ限制性内切酶、BamHⅠ限制性内切酶及500~15000 bp DNA分子量标准ladder购自Fermentas公司,T4-DNA Ligase购自Invitrogen公司,DNA转染试剂、质粒提取试剂盒均为Roche公司产品,DMEM培养基及胎牛血清为西安沃尔森公司产品,核酸染料和DH5α大肠杆菌购自西安昕泰生物公司,卡那霉素购自西安沃尔森生物公司。2000型凝胶成像系统:美国Biotech公司,HEK293T细胞株取自我校心脏离子通道病教育部重点实验室,葡萄糖粉购自sigma公司,流式细胞仪(FALS CALIBAR BD公司),常用试剂为本实验室配制。
1.2 实验方法
1.2.1 真核表达载体pEGFP-N1-HERG的构建和扩增:利用HERG在GenBank基因序列基因两侧单一的EcoRI和HindⅢ限制性内切酶双酶切pcDNA3-HERG及pEGFP-N1,同时进行琼脂糖凝胶电泳验证条带位置,T4 DNA连接酶将含有HERG的片段和pEGFP-N1片段连接起来,重组成pEGFP-N1-HERG绿色荧光真核表达载体并进行碱基序列测序。新构建质粒采用大肠杆菌DH5α进行转化,LB-卡那霉素培养基筛选新构建产物,37 ℃培养温箱孵育20 h后挑选单菌落于25 ml LB-卡那霉素培养液中进行扩增,细胞裂解法提取质粒后再次将新构建真核表达载体pEGFP-N1-HERG送上海生工生物有限公司进行碱基序列测序验证。
1.2.2 HEK293T细胞(Human embryo kidney cell)培养及质粒转染:将HEK293T细胞置于37 ℃、5%CO2条件培养箱中用含10%胎牛血清的DMEM低糖培养基中培养。转染前均匀种植于六孔培养皿中,24 h后待细胞贴壁生长至50%~70%时,采用脂质体转染法。预混物包括无血清DMEM 100 μl、转染剂4 μl,pEGFP-N1-HERG 3 μg。
1.2.3 葡萄糖干预及融合蛋白表达鉴定:质粒转染4 h后给予不同浓度葡萄糖(5、17.5、30 mmol/L)干预细胞,24 h后换液再次给予以上浓度葡萄糖序贯干预细胞,48 h后PBS收获细胞行流式细胞术检测转染效率及荧光强度参数进行分析HERG绿色荧光融合蛋白表达。每个样品的质粒表达效率鉴定以流式细胞仪在488 nm波长激发下,于530 nm处获取1×104个细胞的平均绿色荧光值进行分析。

2 结 果
2.1 绿色荧光表达载体pEGFP-N1-HERG的构建 用HindⅢ和EcoRI限制性内切酶双酶切pcDNA3-HERG和pEGFP-N1。琼脂糖凝胶电泳定位,pEGFP-N1为一条目的条带,约4000 bp和5000 bp Marker之间;pcDNA3-HERG被切成很接近的两条目的条带,琼脂糖电泳如图1所示,与预计大小相同。将pcDNA3-HERG的小片段基因条带和pEGFP-N1端基因条带通过T4 DNA连接酶进行基因融合,重组成pEGFP-N1-HERG绿色荧光真核表达载体。与预期的pEGFP-N1和结合蛋白目的基因片段长度一致(图1)。
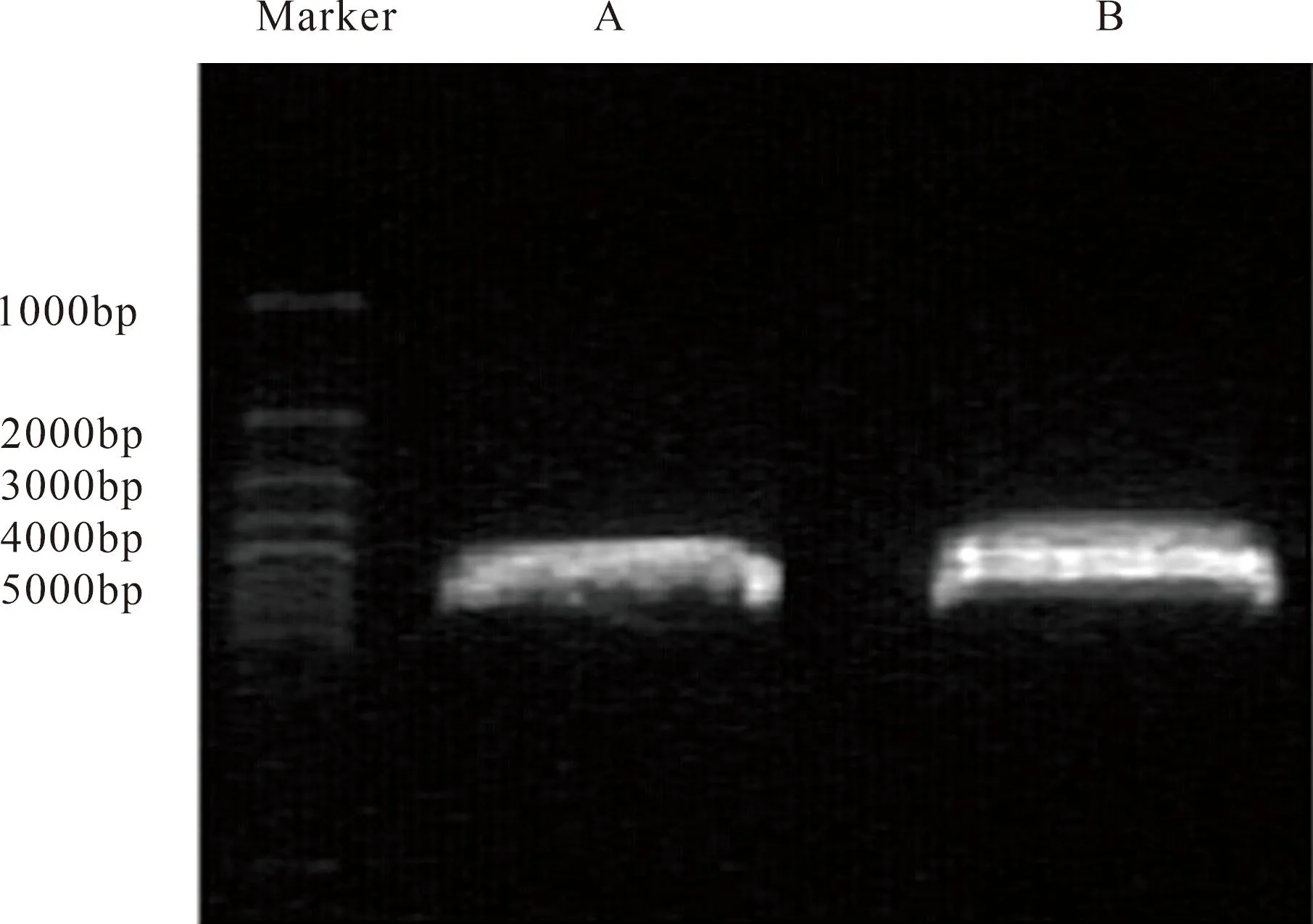
图1 质粒pcDNA3-HERG和pEGFP-N1的双酶切电泳图
2.2 绿色荧光表达载体pEGFP-N1-HERG的鉴定
2.2.1 酶切鉴定:由于目的基因HERG和pEGFP-N1载体基因序列中均有一处BamHⅠ酶切位点,因此重组真核表达载体pEGFP-N1-HERG可被BamH Ⅰ酶切成4000 bp和5000 bp两条带,与预计大小相同(图2)。

图2 质粒pEGFP-N1-HERG酶切电泳图
2.2.2 测序分析鉴定:将HERG基因成功连接到pEGFP-N1载体上,pEGFP-N1-HERG测序行双向测通后的测序结果与美国国立卫生图书馆Genebank中HERG基因碱基序列进行匹配比对,结果示pEGFP-N1-HERG载体中插入的HERG基因碱基序列与Genebank中的序列匹配一致,保证了正常HERG蛋白的表达及通道功能的实现。
2.2.3 荧光显微镜观察细胞pEGFP-N1-HERG表达:pEGFP-N1-HERG转染后荧光显微镜下可见融合有绿色荧光蛋白的目的蛋白在HEK293T细胞中的表达(图3)。

图3 转染后HEK293T细胞荧光表达(脂质体染色,×10)
2.3 EGFP表达的流式细胞仪分析 流式细胞仪分析表明三组转染质粒pEGFP-N1-HERG的HEK293T细胞经不同糖浓度(5、17.5、30 mmol/L)干预后EGFP转染阳性效率分别为(69.29±6.05)%、(68.74±11.37)%和(73.92±12.11)%,转染效率比较无统计学差异(均P>0.05),而HEK293细胞EGFP相对平均荧光强度分别为209.18±9.99、187.11±11.43和124.47±27.30,比较差异有统计学意义(P< 0.05)。见表1(图4)。

表1 葡萄糖干预48 h后流式计数pEGFP-N1-HERG的阳性细胞百分比和平均荧光强度

A:葡萄糖5 mmol/L;B:葡萄糖17.5 mmol/L;C:葡萄糖30 mmol/L
3 讨 论
HERG基因编码心肌细胞快速延迟整流电压门控钾通道(Kv11.1)α亚单位,是心肌动作电位复极期重要的外向电流,各种因素致Kv11.1通道异常使IKr振幅减低,导致LQTS,从而诱发尖端扭转性室速(TdP),增加心律失常和猝死的风险[11-13]。并且Kv11.1是多种药物致QT间期改变甚至诱发心律失常的结合位点,同时也是抗心律失常药治疗的重要靶点区域[14]。
pEGFP-N1是一种小分子量并优化的突变型增强GFP,蛋白大小约26.9kDa,其具有更高的灵敏度和荧光强度,且荧光性质稳定,没有物种特异性,对细胞的生长和功能无显著的影响,可行活细胞检测[15]。近年大量研究广泛采用将目的基因重建到携带荧光蛋白基因的pEGFP-N1表达载体中构建成表达绿色荧光融合目的蛋白细胞模型,在荧光显微镜下根据绿色荧光强弱及位置反映目的蛋白表达量及转运定位,且EGFP对靶基因产物的空间构象和功能没有影响,它已成为检测目的基因表达方式的最佳报告基因[16-19]。此目的蛋白自带增强荧光的细胞模型在研究蛋白表达及定位较免疫荧光法更加方便快捷,简化和节省了免疫荧光后期的抗体孵育及显色时间;还可在不需要额外荧光抗体标记的情况下快速进行精确的流式细胞学研究[20]。
QT间期异常延长是糖尿病(DM)患者最显著的心电障碍,同时LQTS患者也表现出更高的糖尿病负荷。众所周知,hERG编码快速延迟IKr,HERG通道易受遗传缺陷和环境因素的影响,在大多数情况下会导致HERG功能的抑制[21]。事实上,大多数长QT综合征的病例都归因于HERG通道的功能障碍,尤其是治疗药物引起的功能障碍[22-23]。可以推测,HERG的改变也可能参与了高血糖诱导的QT延长,在糖尿病心肌病中,hERG通道的表达严重下调,这种下调是减慢复极和延长QT间期的关键因素。本研究发现在高糖处理的hERG-hek细胞中,hERG蛋白的表达随高糖浓度依赖性降低,和SHI研究结果一致[24]。既往研究发现高糖通过影响Hsp90的表达及其与hERG的相互作用抑制hERG通道的生成。此外,高糖诱导的hERG通道抑制可以通过上调激活转录因子-6和内质网伴侣蛋白calnexin的表达水平来激活未折叠蛋白应答,表明抑制非成熟hERG蛋白转运是糖尿病心肌病中hERG缺乏的潜在机制[24]。同时还发现在胰岛素存在下,由高糖引起的Hsp90的抑制显著恢复,Hsp90的表达增加,这些结果表明胰岛素通过降糖可以上调hERG通道的表达,并拯救高糖引起的hERG通道蛋白缺失。还有研究报道高糖诱导的hERG通道缺乏是由于抑制了蛋白在内质网的折叠和转运,此外也证实胰岛素可促进hERG通道的表达,改善高糖诱导的hERG通道抑制的潜在机制[25]。还有些研究报道hERG蛋白表达减少是由氧化应激引起的,可能由高糖刺激导致的活性氧自由基(ROS)参与的氧化应激所致,而胰岛素具有抗氧化特性并降低细胞内ROS水平[25]。此外,胰岛素通过其抗氧化作用改善糖尿病模型家兔IKr/hERG功能,该研究也证实胰岛素显著增加了Kv11.1蛋白和Ikr电流的表达。此外,高糖诱导的Kv11.1蛋白和Ikr电流的降低可以通过胰岛素来改善,源于胰岛素可抑制高糖条件下Kv11.1通道蛋白表达减少的作用。上述研究均证实高糖诱导的Kv11.1功能障碍是可预防和可逆的,而胰岛素在治疗这些糖尿病患者心电问题中是非常有效的。
本研究证明在高糖处理的hERG-HEK293T细胞中,hERG蛋白表达随高糖浓度依赖性降低。既往研究发现高糖通过抑制Hsp90和hERG/Hsp90复合物的表达,诱导hERG通道转运缺陷,随后,内质网应激反应和增加的蛋白质降解在高糖处理的hERG-HEK293细胞中被激活。此外,研究还证实应用胰岛素可以恢复hERG蛋白的表达和hERG电流。这些发现表明,抑制转运是糖尿病心肌病中hERG缺乏的潜在机制。
综上所述,本研究证实持续高糖状态通过抑制hERG的表达导致Kv11.1蛋白生成减少,致使IKr门控离子通道功能异常,导致K+外流减少,复极时间延长,在心电图上表现为QT间期延长,易诱发尖端扭转型室性心动过速。这一发现阐明了糖尿病诱导的hERG通道表达缺陷的一种细胞内机制。这些发现将极大地改善目前对糖尿病心肌病中hERG蛋白表达降低的认识,为进一步研究高糖在hERG细胞中的作用奠定了基础,并可能为糖尿病患者的长期高糖状态下QT间期延长提供有效的研究基础。

