SDC-1 调控TGF-β1/THBS1 信号通路对肝纤维化进程的影响
羊 丹 田婉婷 徐 菁
乙型肝炎是全球范围内的重要公共卫生问题。《2022 中国卫生健康统计年鉴》[1]发布的数据显示,2021年中国新发乙型肝炎97.68 万例,相较于2020年(90.63 万例)增加了8%,距离WHO 提出的2030年消除乙型肝炎的目标仍有一定差距。乙型肝炎是由HBV 感染引起的肝脏疾病,大多数HBV感染者经治疗后在短期内能够痊愈,但5%~10%的成年患者无法清除病毒,可能进展为慢性乙型肝炎[2]。慢性乙型肝炎患者通常无明显症状,但可能引起肝纤维化改变,进而导致肝硬化和肝细胞癌(HCC)发生,威胁患者的生命健康[3]。多配体蛋白聚糖-1(SDC-1)是一种位于细胞表面的糖蛋白,可参与调控细胞黏附、细胞外基质的组装、细胞信号转导、细胞迁移等多种生物学过程。近年来的研究发现,HCC 细胞中SDC-1 表达显著上调,可能发挥促进肝纤维化进展的作用[4]。转化生长因子-β1(TGF-β1)是TGF-β 超家族的多肽成员之一。既往研究表明,肝脏受损后,炎症反应和纤维化的激活可导致TGF-β1 释放,TGF-β1 则可与肝星状细胞(HSC)表面受体结合,激活下游信号转导通路,进而促使HSC 转化为纤维化细胞,参与肝纤维化进程[5]。血小板反应蛋白1(THBS1)属于THBS 家族,在肝脏等组织中表达。Reszegi 等[6]的研究发现,THBS1 与TGF-β1 在肝纤维化进程中存在相互作用,且SDC-1 在此过程中发挥重要的调控作用。目前关于SDC-1 的表达与肝纤维化的关系,以及其对于HSC 及细胞周期作用机制的报道较少。本研究对此进行了分析,旨在为肝纤维化的临床诊治提供参考依据。
1 研究对象与方法
1.1 研究对象
选择2021年4月至2023年4月于三二〇一医院住院治疗并行肝穿刺活体组织病理检查的102 例慢性乙型肝炎患者作为研究对象,其中男性58 例,女性44 例,年龄32~76 岁,平均年龄为(58.35±10.21)岁,BMI 为22~26 kg/m2,平均BMI 为(24.36±2.14)kg/m2;参照《肝纤维化诊断及治疗共识(2019年)》[7]中的肝纤维化分期标准,S0 期22 例,S1 期19 例,S2 期24 例,S3 期21 例,S4 期16 例。纳入标准:(1)18~80 岁;(2)符合《慢性乙型肝炎防治指南(2015年版)》[8]中的诊断标准;(3)尚未接受抗病毒治疗;(4)患者及家属签署知情同意书。排除标准:(1)合并其他类型的肝炎病毒感染;(2)合并药物性、酒精性、自身免疫性、胆汁淤积性和遗传代谢性等肝病;(3)合并恶性肿瘤;(4)近6 个月内曾接受抗病毒或抗炎保肝治疗;(5)有心、脑、肾等重要器官功能不全。本研究经医院医学伦理委员会审核通过(批件号20210623)。
1.2 方法
1.2.1 血清SDC-1 表达水平检测 采用ELISA 法检测受试者血清SDC-1 的表达水平。于患者入院时,采集清晨空腹状态下的外周静脉血5 mL,3 500 r/min 离心5 min,取上清液,使用全自动生物化学分析仪检测血清SDC-1 的表达水平,试剂盒购自武汉伊莱瑞特生物科技股份有限公司(货号E-EL-H1298c)。
1.2.2 LX-2 细胞的培养和活化 将人HSC 系LX-2(购自上海雅吉生物科技有限公司)置于10%高糖DMEM 培养基内,于37 ℃、5% CO2环境中培养;待细胞融合度达80%时,弃去培养液,用无菌PBS溶液冲洗;之后更换为无血清DMEM 培养基,将细胞随机分为2 组,其中1 组加入TGF-β1 溶液(质量浓度为10 ng/mL)后继续培养24 h,设为TGF-β1组;另1 组不作处理,设为阴性对照(NC)组。
1.2.3 SDC-1 敲低实验 本研究中的SDC-1 小干扰RNA(siRNA)由上海吉玛制药技术有限公司设计并合成,正向序列为5'-CCACCAAACAGGAGG AAUUTT-3',反向序列为5'-UUCCUCCUGUUUGGU GGTT-3'。取TGF-β1 组中对数生长期的细胞,以1×106个/孔接种于6 孔板上,加入不含抗生素的DMEM 培养基培养24 h,之后随机分为2 组,其中1 组转染随机排序的小片段siRNA,设为NC siRNA 组;另1 组转染SDC-1 siRNA,设为SDC-1 siRNA 组。以上步骤均按照LipofectamineTM2000转染试剂盒(购自英国Invitrogen 公司)说明书进行操作,之后将细胞置于Opti-MEM 培养基中转染12 h,后更换为无胎牛血清的DMEM 培养基,于37 ℃、5% CO2环境中培养48 h。
1.2.4 α-平滑肌肌动蛋白、SDC-1 和THBS1 蛋白表达水平检测 采用蛋白质印迹法测定α-平滑肌肌动蛋白(α-SMA)、SDC-1 和THBS1 蛋白表达水平。取1.2.3 中转染48 h 后的细胞,弃去旧培养基,用预冷的PBS 溶液冲洗3 次;滴加RIPA 裂解液(购自北京伊塔生物科技有限公司,货号SY4680)裂解细胞,冰上反应10~30 min;4 ℃下12 000 r/min离心15 min,取上清液,使用BCA 蛋白定量试剂盒(购自上海信帆生物科技有限公司,货号YX3763)测定α-SMA、SDC-1 和THBS1 蛋白的表达水平。具体步骤:取蛋白样品进行SDS-PAGE,湿法转至PVDF 膜;用快速封闭液[购自翌圣生物科技(上海)股份有限公司]封闭抗体,依次滴加兔抗α-SMA 多克隆抗体(购自上海远慕生物科技有限公司)、兔抗SDC-1 多克隆抗体和兔抗THBS1多克隆抗体(均购自上海酶联生物科技有限公司),按1 ∶1 000 比例稀释,4 ℃孵育过夜;用TBST 溶液冲洗3 次,滴加二抗(购自上海烜雅生物科技有限公司),按1 ∶5 000 比例稀释,37 ℃孵育1 h;用TBST 溶液冲洗3 次,采用ECL 法(试剂盒购自北京索莱宝科技有限公司)曝光显影;使用凝胶成像系统观察条带,应用ImageJ 软件进行灰度值分析,以β-actin 作为内参,实验重复3 次。
1.2.5α-SMA、SDC-1 和THBS1 mRNA 表达水平检测 采用实时荧光定量PCR 法检测α-SMA、SDC-1和THBS1 mRNA 的表达水平。取1.2.3 中转染48 h后的细胞,用PBS 溶液冲洗2 次;滴加TRIzol 试剂(购自南京森贝伽生物科技有限公司)提取总RNA,冰上孵育10 min;用移液枪吹打5 min,转移至EP 管内;滴加预冷的氯仿,4 ℃下12 000 r/min 离心15 min,取上层水相置于新的EP 管内,滴加异丙醇沉淀DNA;4 ℃下12 000 r/min 离心15 min,弃上清,加入预冷的75%乙醇洗涤沉淀;4 ℃下7 500 r/min 离心5 min,弃上清;使用紫外可见分光光度计(购自美国Thermo Fisher Scientific 公司)测定波长260 nm 和280 nm 处的光密度(OD)值,检测RNA 纯度(R),公式:R=OD260/OD280,取R值在1.8~2.0 间的RNA 样品,并测定RNA 浓度;按照反转录试剂盒[购自优利科(上海)生命科学有限公司]说明书操作,将RNA 反转录为cDNA。引物由生工生物工程(上海)股份有限公司设计并合成,引物序列见表1。PCR 反应条件:94 ℃预变性5 min;之后94 ℃ 30 s,55 ℃退火45 s,72 ℃ 60 s,共35 个循环;最后72 ℃延展10 min。取PCR 扩增产物,经2%琼脂糖凝胶电泳,使用凝胶成像系统分析结果;以GAPDH 为内参,采用2-ΔΔCt法计算α-SMA、SDC-1 和THBS1 mRNA 的相对表达量。
1.2.6 细胞增殖情况检测 采用CCK-8 法检测细胞增殖情况。取1.2.3 中转染48 h 后的细胞,用胰酶消化细胞,制备细胞悬液;以2×103个/孔接种于96 孔板,在37 ℃、5% CO2环境下培养4 h;待细胞贴壁后每孔加入10 μL 的CCK-8 溶液(购自上海烜雅生物科技有限公司),在37 ℃、5% CO2环境下培养2 h,使用酶标仪(购自美国Thermo Fisher Scientific 公司)测定波长450 nm 处的OD 值,实验重复3 次。
1.2.7 细胞周期检测 采用流式细胞术检测细胞周期。取1.2.3 中转染48 h 后的细胞,用胰酶消化细胞,1 000 r/min 离心5 min,弃上清;用预冷的PBS 溶液冲洗,加入无水乙醇,4 ℃孵育过夜;1 000 r/min离心5 min,吸出乙醇,用PBS 溶液清洗2~3 次,加入2 μL 的RNA 酶及0.5 mL 的PI 溶液[购自弗元(上海)生物科技有限公司,货号FY600002],室温避光染色30 min;用300 μm 尼龙网膜过滤,转移至新的含PBS 溶液的EP 管内,使用流式细胞仪(购自美国BD 公司)检测细胞周期。
1.3 统计学分析
应用SPSS 20.0 软件对数据进行统计学分析。符合正态分布的计量资料以均数±标准差(x±s)表示,2 组间比较采用独立样本t检验;多组间比较采用单因素方差分析,两两比较采用SNK-q检验。计数资料以例(%)表示。P<0.05 为差异有统计学意义。
2 结果
2.1 不同肝纤维化分期的慢性乙型肝炎患者血清SDC-1 的表达水平比较
如表2 所示,随着肝纤维化程度逐渐加重,慢性乙型肝炎患者的血清SDC-1 表达水平呈升高趋势,S4 期高于S3 期,S3 期高于S2 期,S2 期高于S1 期,S1 期高于S0 期,差异均有统计学意义(P均<0.05)。
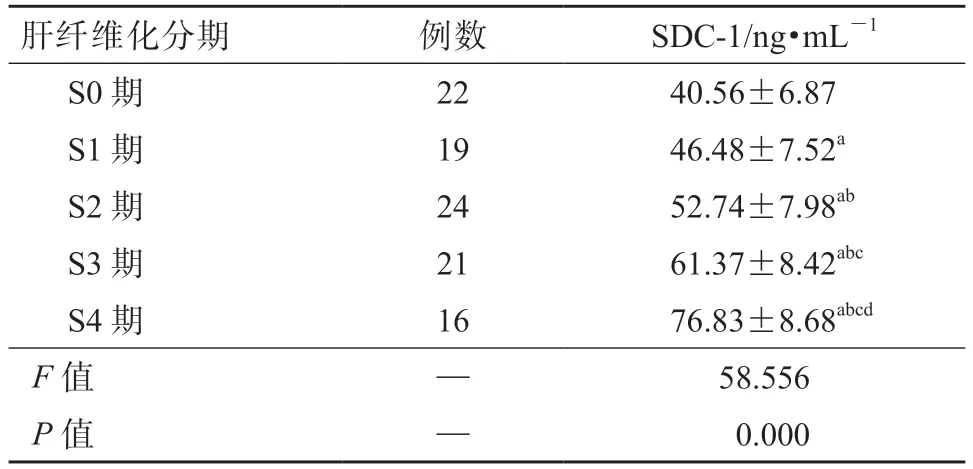
表2 不同肝纤维化分期的慢性乙型肝炎患者血清SDC-1 的表达水平比较
2.2 LX-2 细胞活化鉴定
NC 组中α-SMA 蛋白及α-SMAmRNA 的相对表达量分别为0.67±0.12 和1.13±0.16,TGF-β1 组中α-SMA 蛋白及α-SMAmRNA 的相对表达量分别为2.85±0.56 和3.72±0.61。与NC 组相比,TGF-β1组中α-SMA 蛋白及α-SMAmRNA 的相对表达量均显著升高(P均<0.05)。
2.3 经TGF-β1 诱导活化的LX-2 细胞中SDC-1 表达水平的变化
NC 组中SDC-1 蛋白及SDC-1 mRNA 的相对表达量分别为1.36±0.24 和1.21±0.18,TGF-β1 组中SDC-1 蛋白及SDC-1 mRNA 的相对表达量分别为2.63±0.52 和1.89±0.23。与NC 组相比,TGF-β1 组中SDC-1 蛋白及SDC-1 mRNA 的相对表达量均显著升高(P均<0.05)。
2.4 敲低SDC-1 表达对活化LX-2 细胞中α-SMA、TGF-β1 及THBS1 表达水平的影响
NC siRNA 组 中α-SMA、TGF-β1 和THBS1 蛋白的相对表达量分别为2.63±0.59、5.72±1.36 和5.84±1.43,而α-SMA、TGF-β1 和THBS1 mRNA 的相对表达量分别为2.34±0.52、5.43±1.21 和5.67±1.36;SDC-1 siRNA 组中α-SMA、TGF-β1 和THBS1 蛋白的相对表达量分别为1.46±0.37、3.11±1.25 和2.58±1.14,而α-SMA、TGF-β1和THBS1 mRNA 的相对表达量分别为1.53±0.35、2.79±1.28 和2.53±1.34。与NC siRNA 组相比,SDC-1 siRNA 组中α-SMA、TGF-β1、THBS1 蛋白及其mRNA 的相对表达量均显著降低,2 组的差异均有统计学意义(P均<0.05)。
2.5 敲低SDC-1 表达对活化LX-2 细胞增殖的影响
如图1 所示,与NC 组相比,TGF-β1 组的细胞增殖活性显著增强(P<0.05);与NC siRNA 组相比,SDC-1 siRNA 组的细胞增殖活性显著减弱(P<0.05)。

图1 敲低SDC-1 表达对活化LX-2 细胞增殖的影响
2.6 敲低SDC-1 表达对活化LX-2 细胞周期的影响
如图2 所示,与NC 组相比,TGF-β1 组中G1期细胞占比显著降低,S 期和G2期细胞占比显著升高(P均<0.05);与NC siRNA 组相比,SDC-1 siRNA 组中G1期细胞占比显著升高,S 期和G2期细胞占比显著降低(P均<0.05)。
3 讨论
研究表明,1990年至2019年中国的乙型肝炎疾病负担虽呈下降趋势,但离2030年消除HBV 的目标仍存在差距,据贝叶斯模型预测,2020年至2030年中国的乙型肝炎的发病患者约为1 486.56万例,死亡患者约为11.18 万例,这提示仍需强化防控措施[9]。肝纤维化是多种慢性肝病的共同病理特征,在中国肝纤维化主要是由慢性乙型肝炎所致[10]。SDC-1 是一种细胞表面蛋白,参与了细胞-基质的相互作用及信号转导[11]。近年来的研究表明,SDC-1 在肝纤维化的进程中可能发挥着重要作用[5]。研究发现,肝癌细胞表面表达的SDC-1是阻止肝癌细胞迁移的重要因素[12]。因此,探究SDC-1 表达与肝纤维化之间的关系,以及其在肝纤维化进程中的作用机制,对于阻止肝纤维化进展具有重要意义。本研究发现,随着肝纤维化程度逐渐加重,慢性乙型肝炎患者血清SDC-1 的表达水平呈升高趋势,这表明慢性乙型肝炎患者血清SDC-1 表达显著上调,且其与肝纤维化进程相关,其有可能成为评估乙型肝炎患者肝纤维化程度的血清学标志物。
HSC 是肝纤维化进程中的重要角色。正常情况下,HSC 处于静止状态,位于肝小叶之间的腔隙中,当肝脏受到损伤或炎症反应刺激时,HSC可被激活并转化为成纤维细胞样细胞,并通过合成和分泌细胞外基质蛋白,参与肝脏细胞外基质重塑,导致肝组织纤维化及瘢痕形成[13]。因此,抑制HSC 的活化和增殖并诱导其凋亡,是目前抗纤维化治疗的重要策略[14]。TGF-β1 是肝纤维化形成的关键因子[15]。本研究使用TGF-β1 诱导LX-2细胞活化,结果发现与NC 组相比,TGF-β1 组中α-SMA 蛋白及α-SMAmRNA 的相对表达量均显著升高,这符合以往的研究结果[16]。此外,本研究发现,与NC 组相比,TGF-β1 组中SDC-1 蛋白及SDC-1 mRNA 的相对表达量均显著升高,进一步证实TGF-β1 在诱导HSC 活化过程中可促使细胞内SDC-1 表达上调,这提示SDC-1 与TGF-β1 可能存在相互作用。基于此,本研究利用siRNA 技术引导内源性核酸酶切割携带互补序列的靶向RNA,结果发现转染SDC-1 siRNA 后,经TGF-β1 诱导的LX-2 细胞中α-SMA 蛋白及α-SMAmRNA 的相对表达量均显著降低,这提示敲低SDC-1 表达可抑制经TGF-β1 诱导的LX-2 细胞活化。肝脏中的THBS1 主要由HSC 合成及分泌[17]。近年来的研究发现,TGF-β1 与THBS1 存在相互作用,THBS1 可通过调节TGF-β1/α-SMA/胶原相关信号通路抑制人心脏成纤维细胞的增殖及胶原合成,进而改善由心脏成纤维细胞中细胞外基质增多所引起的纤维化改变[18]。本研究结果显示,转染SDC-1 siRNA后经TGF-β1 诱导活化的LX-2 细胞中TGF-β1、THBS1 蛋白及其mRNA 的相对表达量均显著降低,这提示敲低SDC-1 表达可抑制TGF-β1/THBS1 信号转导。此外,本研究结果显示,敲低SDC-1 表达后,经TGF-β1 诱导活化的LX-2 细胞的增殖活性显著减弱,G1期细胞占比显著升高,S 期和G2期细胞占比显著降低,这提示敲低SDC-1 表达可抑制HSC 的活化及增殖,阻滞HSC 由G1期进入S 期和G2期。因此,通过干扰SDC-1 表达,可抑制HSC活化并减轻纤维化程度,SDC-1 有望成为抗纤维化治疗的潜在靶点。
综上所述,敲低SDC-1 表达可能通过调控TGF-β1/THBS1 信号通路,抑制HSC 的活化及增殖,阻滞HSC 由G1期进入S 期和G2期,进而发挥抑制肝纤维化进展的作用。SDC-1 与TGF-β1/THBS1信号通路间的调控作用有待今后开展更深入的研究揭示,同时动态监测SDC-1 的表达水平变化也有可能成为评估肝纤维化程度的方法。

