锂锰摩尔比对水热法制备Li 1.6 Mn1.6 O4 的影响
刘 肖, 李凤华, 李英楠, 樊瑞, 陈晓志
(东北大学 冶金学院, 沈阳 110819)
锂及其化合物是一种重要的战略资源,被广泛应用在航空航天、军事、冶炼及能源等领域[1].锂资源通常存在于锂辉石、锂云母,以及海水与盐湖卤水中.由于矿石提锂存在锂矿品位低、能耗高等问题,而我国海水和盐湖中液态锂资源储量相对丰富[2],故发展溶液提锂是一条实现社会可持续发展的途径[3].
锂离子筛材料[4]对溶液中的锂离子具有特殊选择性,其吸附量大且无污染,是近年来最具发展前景的液态提锂技术.MnO2·0.5H2O 离子筛的理论吸附量为72.29 mg/g[5],是目前吸附量最大的锰系离子筛, 它由前驱体锂锰氧化物Li1.6Mn1.6O4经酸浸后脱锂生成.制备纯净且结晶度高的Li1.6Mn1.6O4锂锰氧化物前驱体是获得吸附容量大、循环次数多的离子筛的关键步骤[6].Li1.6Mn1.6O4前驱体不能一步合成,通常只能先制备正交型LiMnO2(o-LiMnO2)中间产物,再利用低温焙烧o-LiMnO2获取.而在Li-Mn-O 化合物中,o-LiMnO2和单斜型LiMnO2(m-LiMnO2)被认为是亚稳态的物质,当采用高温固相法[7]、溶胶-凝胶法[8]、熔盐 法[9]等方 法合成 时,常 会有MnO2,LiMn2O4等杂质出现,不易获得纯相.
大量研究表明,采用水热法极易制备出单相o-LiMnO2,且晶粒尺寸均一、结晶度高.但水热法体系复杂,其温度、时间和体系浓度均会对结果产生较大影响,其中锂锰比(Li 和Mn 的摩尔比,下同)是决定所制备晶体结构的关键因素.Kim等[10]研究表明:在MnSO4+H2O2+LiOH 水热体系中,当锂锰比分别为2,2.5,3 时,产物组成为Li1.1Mn1.77O4,Li1.33Mn1.67O4和Li1.6Mn1.6O4;随着锂锰比的逐渐增加,更多的Li 占据16 d 位置,锂锰氧化物中四价锰会增多,这对抑制锰的溶损有重要意义.王禄等[11]同样发现在MnCl2+H2O2+LiOH 体系中,随锂锰比的增加,物相组成的变化较大.Xie 等[12]研究表明,锂锰比从10 增至30 的过程中,o-LiMnO2纳米颗粒结晶度的增加逐渐缓慢.Zhang 等[13]利 用 MnCO3固 相 焙 烧 得 到Mn2O3,再以此为锰源制备Li1.6Mn1.6O4.他们发现1.05,1.1,1.25,1.2 这4 种锂锰比均可制得纯Li1.6Mn1.6O4,但当锂锰比为1.1 时,产物具有最低的溶解率(1.62%).孟庆祥等[14]先利用KMnO4和乙醇制备出γ-MnOOH,再采用水热合成法与LiOH 制备出Li1.6Mn1.6O4,发现当锂锰比为3 时,所得的离子筛吸附效果最好.此外,锰源对制备纯相o-LiMnO2也有较大影响.Hayashi 等[9]分别以MnO,MnCO3和Mn(NO3)2为锰源,采用熔融法制备MnO2·0.5H2O 离子筛,发现仅有MnO 源在1 000 ℃下可以合成LiMnO2.Yang 等[15]分别以γ-MnO2,β-MnO2,α-MnO2,δ-MnO2为锰源,采用熔融法制备Li1.33Mn1.67O4,发现不同锰源下产物的酸性位点分布差异极大.
水热法主要包括以MnSO4可溶性锰盐为锰源的一步合成法与先合成锰氧化物再水热合成的分步法,目前关于这2 种方法的比较研究鲜有报道.因此,本文中限定温度、水热时间、体系浓度等因素,以MnSO4为基础锰源,分别采用3 种路径(MnSO4+KMnO4+LiOH 一 步 水 热 法; 自 制MnOOH/Mn3O4+LiOH 分 步 水 热 法) 制 备o-LiMnO2,然后在400 ℃下焙烧6 h 获得富锂锰氧化物Li1.6Mn1.6O4,比较这2 种方法产物的组成与形貌,并探究锂锰比对一步法及分步法水热合成Li1.6Mn1.6O4的影响,以期为制备Li1.6Mn1.6O4离子筛前驱体提供参考路径.
1 实 验
1.1 一步水热法制备Li1.6Mn1.6O4
按照n(Li) ∶n(Mn)=x(x=1,2,4,8,20)和n(Mn2+) ∶n(MnO4-)=4 的比例,称取LiOH·H2O,MnSO4·H2O 和KMnO4(均购于国药集团化学试剂有限公司).先将KMnO4与LiOH 溶解在小烧杯中,再将该混合物逐滴加入MnSO4溶液中,然后将反应产物转移至100 ml 水热釜中,溶液填充量约为水热釜内胆的50%,其中c(Li+)=4 mol/L.在160 ℃下加热8 h,冷却至室温,过滤洗涤干燥,即可得到不同锂锰比下的水热产物,记为A-LMO0-x.取适量水热产物放置于石墨坩埚中,在400 ℃下焙烧6 h,可得到A-LMO-x,如图1 路径A所示.
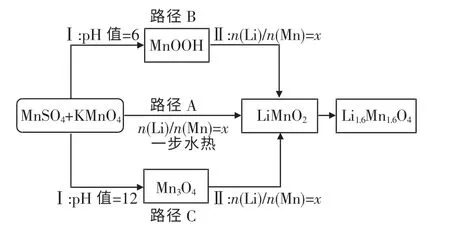
图1 水热法制备Li1.6Mn1.6O4 的技术路线Fig.1 Hydrothermal approaches of preparing Li1.6Mn1.6O4
1.2 分步水热法制备Li1.6Mn1.6O4
将MnSO4和KMnO4按照4 ∶1 的摩尔比称量,混合后放置于水热釜内胆中,分别使用H2SO4和NaOH(均购于国药集团化学试剂有限公司)调节pH 值.在pH 值=6 的酸性条件下制得MnOOH,在pH 值=12 的碱性条件下制得Mn3O4.
称取MnOOH/Mn3O4,按照n(Li) ∶n(Mn)=x(x=4,8,20,28)分别与LiOH 混合置于水热釜中,在160 ℃下反应8 h 后,冷却至室温,过滤洗涤干燥,可得到不同锂锰比下的水热产物,分别记为B-LMO0-x和C-LMO0-x.取适量水热产物放置于石墨坩埚中,400 ℃下焙烧6 h,可得到B-LMO-x和C-LMO-x,如图1 路径B 和C 所示.
本实验中使用X 射线衍射分析仪(XRD-7000,日本岛津仪器有限公司)表征样品的物相组成,使用扫描电镜(Aprea 2c,赛默飞世尔科技有限公司)表征样品的表面形貌.
2 结果与讨论
2.1 一步法水热产物物相组成
图2 为一步水热法合成产物的XRD 图谱.由图可知,当锂锰比为1 和2 时,主要产物为Mn3O4,所有衍射峰的位置和相对强度与Mn3O4(ICDD:01-001-1127)的(112),(103),(211),(321),(224)晶面相符合,在2θ=18.80°上有1个杂峰,与Li1.27Mn1.17O4匹配度高.这说明此时KMnO4可以将MnSO4氧化至Mn3O4,但由于锂势较低,只能出现少量锂锰氧化物.
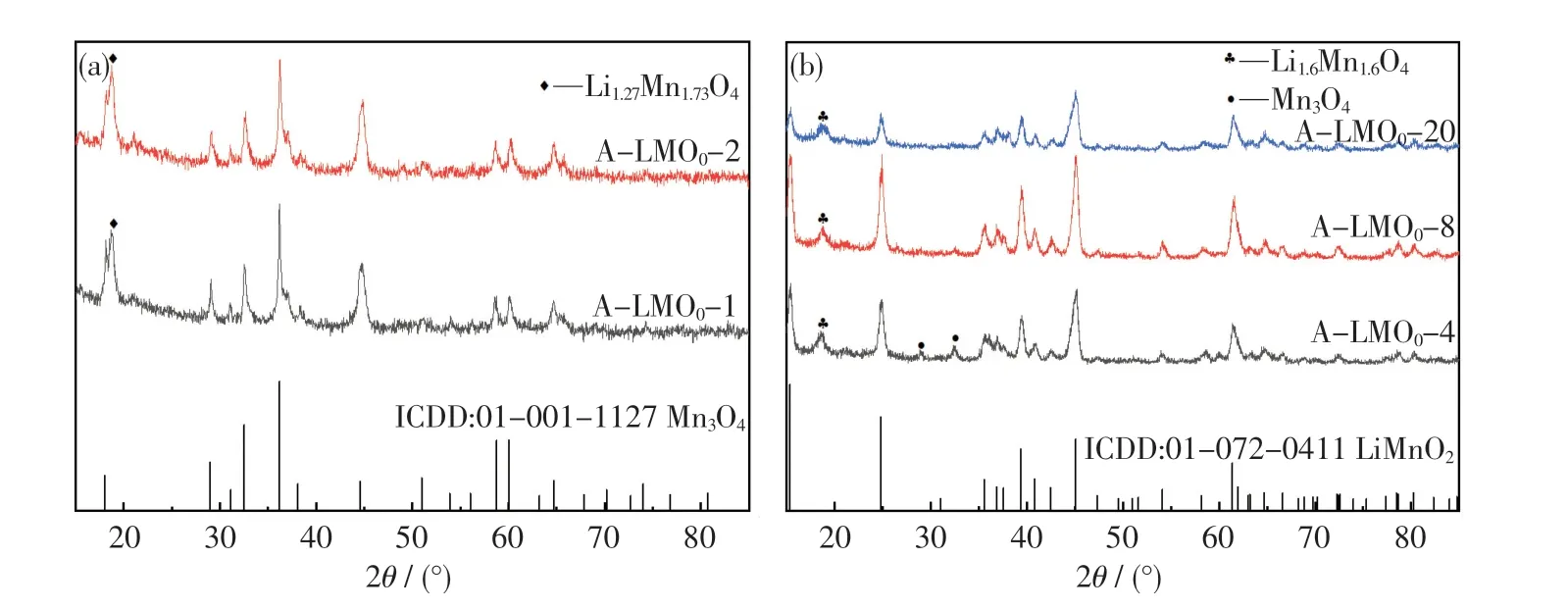
图2 一步水热法在不同锂锰比下所得水热产物的XRD 图Fig.2 XRD patterns of hydrothermal products prepared by one-step hydrothermal method under different molar ratios of lithium vs manganese
当锂锰比提升至4,8,20 时,产物的物相发生转变,主要产物为LiMnO2,如图2(b)所示.可以发现,产物的XRD 衍射峰与LiMnO2(ICDD:01-027-0411)的(010),(011),(002),(120),(122)晶面特征峰相匹配,这说明充足的锂势是形成锂锰氧化物的必备条件.由图2(b) 还可知,在2θ=18.80°时,有Li1.6Mn1.6O4杂相的存在.这是因为溶液体系的氧化性较强,锂含量较多时会形成四价锂锰氧化物.当锂锰比为4 时,在2θ=28.99°,32.47°时,有Mn3O4杂峰,应该是残存的Mn3O4;而当锂锰比为20 时,产物的结晶度明显下降,可能是因为过高的锂势加大了成核速率,使产物中出现更多的无序状态[12,16],而且较小的粒子间距易导致团聚形成[17].综上可知,锂锰比为8 是一步水热法合成o-LiMnO2的最佳条件.一步水热法合成LiMnO2的反应如式(1)所示.
2.2 分步法水热产物物相组成
从图3 中可以看出:当KMnO4+MnSO4体系的pH 值调至6 时,第一步水热过程的产物基本为MnOOH(ICDD:00-041-1379);当pH 值调至12时,产物主相为Mn3O4(ICDD:00-001-1127).其反应原理如式(2)和(3)所示:在弱酸性条件下,水热产物主要为MnOOH;而在强碱性条件下,水热产物为不溶性锰氧化物.
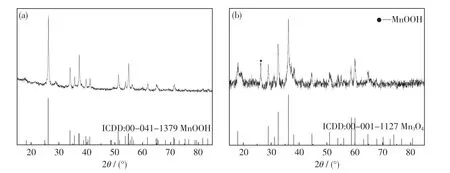
图3 分步法第一步水热产物的XRD 图Fig.3 XRD patterns of hydrothermal products in the first step prepared by two-step method
自制MnOOH 与LiOH 分别在锂锰比4,8,20的条件下进行水热反应,合成产物XRD 见图4(a).从图中可以看出,该产物的XRD 衍射峰均与LiMnO2(ICDD:01-072-4111)的特征衍射峰相匹配,在2θ=18.80°时也出现了Li1.6Mn1.6O4特征峰,而21.29°处的衍射峰表明有Li2MnO3生成.由此可见,氧化性强和锂势充足均有利于LiMnO2向锰价态更高、锂锰比更多的Li1.6Mn1.6O4转变.但本实验结果与文献[9,18]的结果一致,LiMnO2并不能全部转变为Li1.6Mn1.6O4,可能会产生Li2MnO3等杂相.当锂锰比为28 时,在30.67°和31.87°衍射峰处出现了更多未知的杂相.总体而言,当MnOOH 与LiOH 反应时,在锂锰比为4 的条件下可获得较纯的LiMnO2.
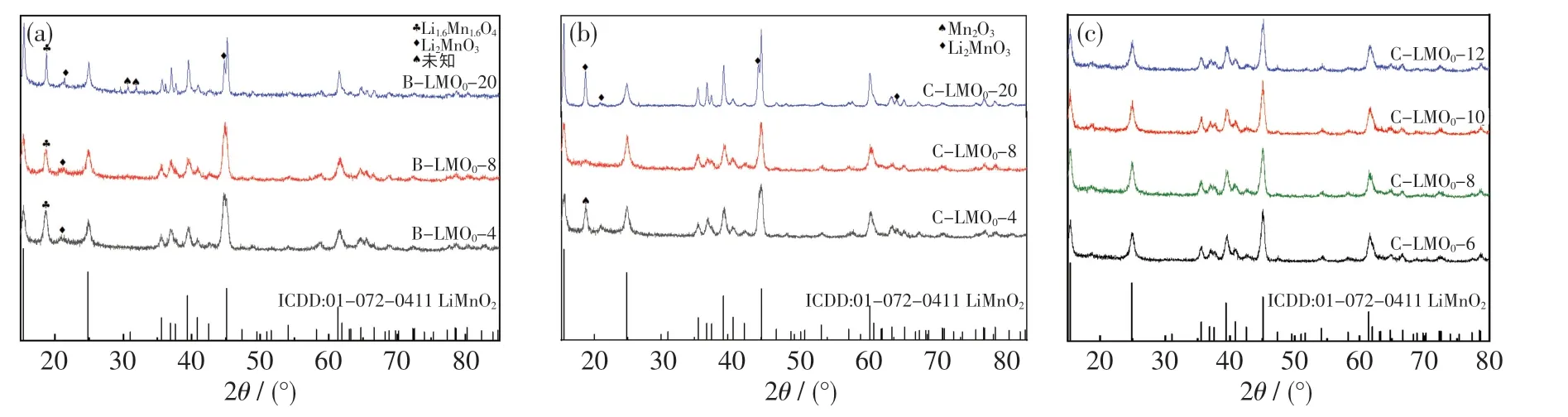
图4 分步水热法第二步水热过程所得产物的XRD 图Fig.4 XRD patterns of hydrothermal products in the second hydrothermal step prepared by two-step method
图4(b)示出了自制Mn3O4与LiOH 水热反应合成产物的XRD 图.由图可知,在锂锰比为4,8,20 的条件下,均可获得LiMnO2.当锂锰比为4时,18.80°衍射峰处有杂相出现.王禄等[11]认为该杂相为碱性环境中的Mn(OH)2被H2O2氧化为MnO2所致,而本实验中氧化剂KMnO4在碱性条件下氧化性弱于H2O2,因此可能是形成了Mn2O3杂相.
当锂锰比升高至8 时,18.80°处杂相突然消失,产物基本无杂峰,衍射峰与o-LiMnO2相匹配.为寻求最佳锂锰比条件,分析杂质消失原因,增加锂锰比为6,10,12 的水热反应实验,结果如图4(c)所示.由图可知,当锂锰比为6,8,10,12 时,在18.80°均未观测到杂峰,这说明锂锰比由4 增至20 的过程中存在杂质的相转化.当锂锰比为6 时,可满足最低转化条件.随着锂锰比的增加,锂势增大,更多锂与Mn2O3结合生成o-LiMnO2,产物纯净.但当锂锰比增至20 时,水热体系中锂势过大,过量的LiOH 会在具有氧化性的水热体系下,与o-LiMnO2生成Li2MnO3杂质.这与文献[12]中的实验现象一致,当锂锰比为50 时,18.8°处出现强且尖 锐 的Li2MnO3杂 峰.Li 等[19]分 析 认 为,Li2MnO3杂相的产生主要是o-LiMnO2与过量的LiOH,O2反应的结果.
图5(a)与(b)为采用分步水热法分别以自制MnOOH 和自制Mn3O4制备的o-LiMnO2的扫描电子显微镜图.从图中可以看出,在这2 种水热路径下,LiMnO2颗粒细小均匀,均达到纳米级.其中路径B 下,颗粒呈立方形貌,粒径的大小在30~70 nm;而路径C 下,部分颗粒明显呈棒状形貌,棒状颗粒直径为20 ~30 nm、长度为100 ~120 nm.这说明在相同的温度、时间和锂锰比下,不同的锰源会造成产物形貌的不同.
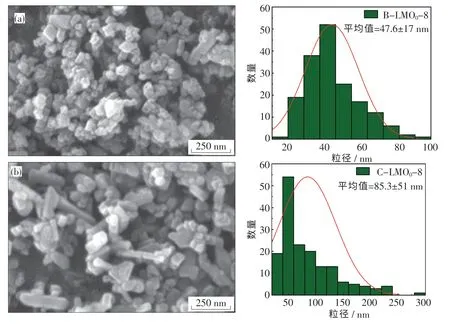
图5 分步水热法制备的o-LiMnO2 的SEM 图及粒径分布图Fig.5 SEM patterns and size distribution of o-LiMnO2 particles prepared by two-step hydrothermal method
2.3 焙烧产物的物相组成
图6 示出了3 种路径制备的LiMnO2样品最终焙烧后所得产物的XRD 图.从图中可以看出,在2θ为18.80°,36.56°,44.53°,58.93°,64.68°处的衍射峰,分别与立方尖晶石结构Li1.6Mn1.6O4(ICDD:00-052-1841)的(111),(311),(400),(511),(440)晶面相对应.这3 种路径均能将水热产物LiMnO2焙烧合成较纯的Li1.6Mn1.6O4,说明一步水热法和分步法均具备合成Li1.6Mn1.6O4的有利条件.在一步法中,当锂锰比为8 时,所得产物的结晶度最高;在分步法的第二步水热过程中, 将 锂 锰 比 控 制 在 4, 即 可 获 得 较 纯的Li1.6Mn1.6O4.
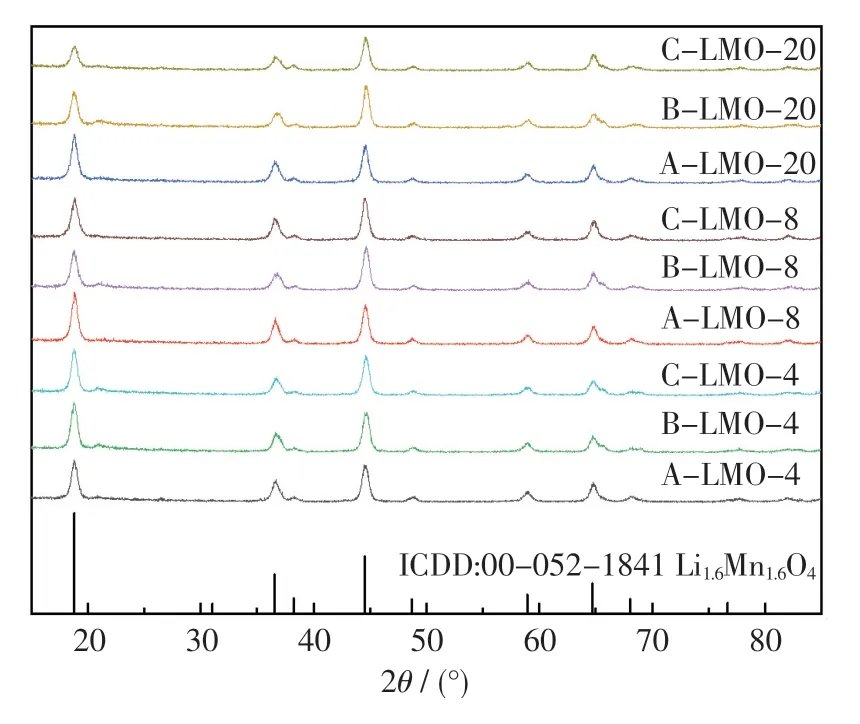
图6 一步法和分步水热法最终焙烧产物的XRD 图Fig.6 XRD patterns of final sintering products by three routes of A, B, C
图7 示出了一步法在锂锰比为8 的条件下所制备 的Li1.6Mn1.6O4电 镜 图.可 以 看 出, 此 时Li1.6Mn1.6O4粉末颗粒细小均匀,粒径分布在40 ~80 nm,呈均匀的立方形貌.与分步法制备的Li1.6Mn1.6O4相比,由于团聚现象的出现,细小颗粒更加集中在一起.
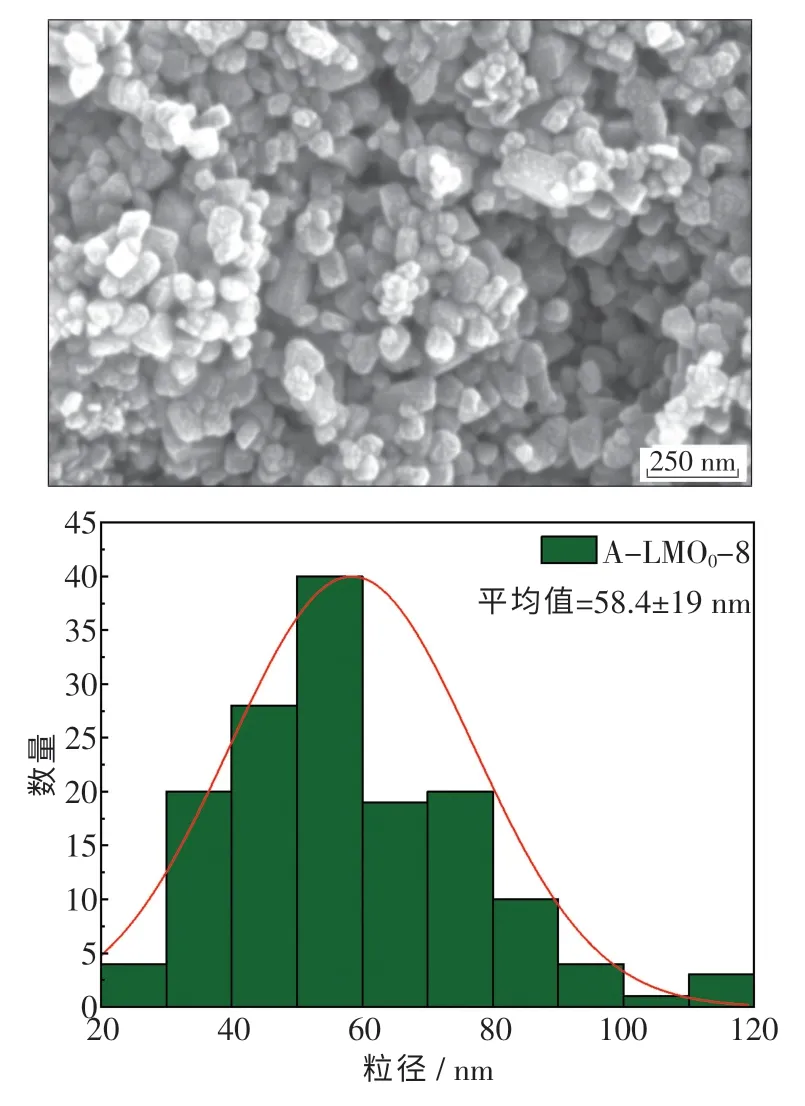
图7 一步法在锂锰比8 条件下制备的Li1.6Mn1.6O4 SEM 图及粒径分布图Fig.7 SEM and particle size distribution of Li1.6Mn1.6O4 prepared by one-step method with lithium manganese ratio of 8
3 结 论
(1)在160 ℃,8 h,c(Li+)为4 mol/L 的水热条件下,以MnSO4为基础锰源,采用一步水热-焙烧法及自制MnOOH/Mn3O4锰源的分步水热-焙烧法均可制得尖晶石结构的Li1.6Mn1.6O4.
(2)一步法与自制MnOOH 锰源的分步法在锂锰比为4 ~20 时,均会生成不同于o-LiMnO2的锂锰氧化物杂质,不利于制备纯相o-LiMnO2.但自制Mn3O4锰源 的分步法合成o-LiMnO2时,低锂锰比会导致杂相Mn2O3残存,但在锂锰比为6 ~12 时,杂相全部转换为o-LiMnO2.在本文中的水热体系下,采用自制Mn3O4的分步法更易得到纯相o-LiMnO2,这为以MnSO4及MnOOH 为主流锰源的研究在选取原材料上提供了参考.
(3)当锂锰比为8 时,采用自制MnOOH 锰源的分步法合成的o-LiMnO2粒径为30 ~70 nm,呈立方形貌;自制Mn3O4锰源的分步法所合成的o-LiMnO2呈直径20 ~30 nm、长度100 ~110 nm 的棒状形貌;而一步法中Li1.6Mn1.6O4粒径分布在40~80 nm,呈均匀的立方形貌.这说明锰源或水热体系pH 值对水热产物的形貌具有一定程度上的影响.

