基于DKK3调控探讨藏红花素对Aβ25-35诱导神经元损伤的保护作用
杨晓佳,吴 敏,江 萌,刘立权
(杭州市中医院·浙江 杭州 310007)
阿尔兹海默症(Alzheimer’s disease, AD)为一类与年龄和特定神经病理改变相关的伴有认知及功能衰退的的神经退行性疾病[1]。淀粉样蛋白(amyloid β, Aβ)形成是AD的典型病理改变,也是导致神经系统损害以及痴呆症状出现的主要影响因素之一[2]。Dickkopf3(DKK3)属DKK蛋白家族成员的分泌性糖蛋白,在人类大脑多区域内的神经元中表达,主要参与神经元基本生理过程。研究资料显示AD患者血清、脑脊液中DKK3含量增加[3-4],提示DKK异常表达可能参与AD发病过程。
藏红花为传统中医药材,具有止痉挛、消炎、神经镇静或兴奋等作用[5]。藏红花素为藏红花中生物活性较强的成分之一。研究表明藏红花素可减轻Aβ引起的细胞毒性,具有较好神经保护作用[6]。本研究预通过相关实验,探讨藏红花素是否能通过介导DKK3对AD发挥神经保护作用。
1 材料与方法
1.1 实验材料 藏红花素:上海源叶生物科技公司,KA0807CA14。小鼠海马神经细胞HT22:赛百慷,上海,iCell-m020。Aβ25-35:Sigma试剂,WXZC2671S;CCK8试剂盒:MCE公司,HY-K0301;流式凋亡试剂盒:美国BD公司,1133534;脂质体3000:德国Thermo公司,L3000015;逆转录试剂盒:康为世纪,33020;Tubulin β、DKK3、β-连环蛋白(β-catenin)、B淋巴细胞瘤-2(Bcl-2)、糖原合成酶激酶-3β(GSK-3β)、磷酸化-GSK-3β(p-GSK-3β)抗体:美国Affinity抗体,4392910、7192810、6492980、5392110、8242510、8242564;Bcl-2关联X(Bax)、天冬氨酸蛋白水解酶3(Caspase-3):美国Abcam抗体公司,FR3347563-11、GS3846357-67。 BB150细胞培养箱、Micro17R低温高速离心机:德国Thermo公司;CMaxPlus酶标仪:美国MD公司;AE2000光学显微镜:美国Motic;CFX Connect实时荧光定量PCR仪:美国BIO RAD;C6流式细胞仪:美国BD;610020-9Q化学发光仪:中国勤翔。
1.2 方法
1.2.1 Aβ25-35诱导浓度确定 10% 胎牛血清、100 U/mL青霉素及0.1 g/L链霉素的高糖DMEM培养基培养HT22,培养基放置于37 ℃、5% CO2的细胞培养箱中。将细胞用1.25、2.5、5.00、10.00、20.00 μmol /L 的Aβ25-35诱导48 h,空白溶剂用作对照。细胞随后接种于96孔板内,每孔加入CKK8试剂,培养箱内孵育。取出后酶标仪测定450 nm处的吸光度,计算细胞活力。
1.2.2 藏红花素干预浓度确定 选取1.2.1确定Aβ25-35诱导浓度(5.00 μmol /L)干预的细胞,进行藏红花素浓度选择。细胞用0.5、1.0、2.0 μmol /L的藏红花素干预48 h。随后按照1.2.1细胞活性检测方法确定藏红花素的最佳干预浓度。
1.2.3 质粒构建及转染 构建3条DKK3 siRNA及1条对照siRNA。利用脂质体3 000将不同表达质粒转染至HT22细胞和Aβ25-35诱导细胞。
1.2.4 qPCR检测DKK3 mRNA表达 Trizol提取细胞RNA,逆转录PCR进行DNA扩增,实时荧光定量PCR检测DKK3 mRNA表达。反应条件为变性95 ℃ 10 min,扩增反应,95 ℃ 15 s,60 ℃ 60 s,40 次,溶解曲线,95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。DKK3引物序列,正向:CAGCTCTCAACTACCCTCAGG,反向:ACCTCAGAGGACGTTTTAGCA。GAPDH为对照,序列,正向:AATGGATTTGGACGCATTGGT,反向:TTTGCACTGGTACGTGTTGAT。采用2-△△CT法对结果进行相对定量分析。选取DKK3 mRNA极低表达的细胞进行后续实验。
1.2.5 细胞分组 细胞分为正常组、Aβ25-35组、Aβ25-35+藏红花素组(1.0 μmol /L)、Aβ25-35+ DKK3 siRNA组、Aβ25-35+siRNA对照组、DKK3-OE组、空白质粒对照组、DKK3-OE+藏红花素组(1.0 μmol /L);藏红花素干预48 h。
1.2.6 流式细胞数检测细胞凋亡 细胞接种于6孔板内,PBS洗涤调整细胞浓度(至1×106个/mL)。加入500 μL结合缓冲液重悬细胞,离心弃上清,再加入100 μL结合缓冲液混匀后,分别加入5 μL Annexin V-FITC与10 μL PI,混匀,室温避光结合15 min。最后加入结合缓冲液400 μL,上流式细胞仪检测。
1.2.7 Tubulin β染色检测细胞突触形态 细胞接种6孔板,吸除多余液体,多聚甲醛固定10 min,随后PBS清洗3遍。每孔加入1~2 mL 0.5% Triton X-100孵育2 min进行通透,PBS漂洗后吸除多余PBS。Tubulin β一抗孵育,随后PBS清洗干净。随后进入暗室,孵育稀释二抗30 min,PBS清洗。加入DAPI染液,PBS漂洗。封片,拍照,ImageJ软件测量每个视野的海马神经细胞突触的长度及分支数。
1.2.8 Western blot检测蛋白表达 裂解细胞,离心提取上清液。测定上清液内总蛋白含量,转膜,封闭,清洗后加入稀释的Aβ、DKK3、β-catenin、GSK-3β、p-GSK-3β、Caspase-3、Bax、Bcl-2的一抗抗体,4 ℃环境下摇床孵育过夜。清洗,再次封闭后,对于二抗孵育1.5 h。清洗,曝光,检测各蛋白相对表达量。
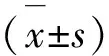
2 结果
2.1 不同浓度Aβ25-35对HT22细胞活性的影响 各浓度Aβ25-35诱导HT22细胞48 h后细胞活性显著下降(P<0.05),其中5.00、10.00、20.00 μmol /L Aβ25-35对HT22细胞活性的影响极为显著(P<0.01)。本研究采用5.00 μmol /L Aβ25-35处理HT22细胞48 h进行体外AD细胞造模。见表1。
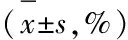
表1 不同浓度Aβ25-35处理HT22细胞存活率的比较
2.2 不同浓度藏红花素对Aβ25-35诱导HT22细胞活性的影响 与正常组相比,Aβ25-35组细胞存活率极显著降低(P<0.01)。在不同浓度藏红花素干预下,细胞的存活率均显著增加(P<0.05),1.0、2.0 μmol /L 藏红花素的干预作用极为显著(P<0.01)。本研究选择藏红花素最佳干预浓度为1.0 μmol /L。见表2。
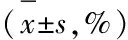
表2 不同浓度藏红花素对Aβ25-35诱导HT22细胞存活率的影响
2.3 不同DKK3质粒表达转染效果 与siRNA对照组相比,各条DKK3 siRNA均可显著下调HT22细胞DKK3 mRNA的表达(P<0.01),DKK3 siRNA 1抑制DKK3表达的效果最好。本文选取该条进行Aβ25-35诱导细胞转染。与空白质粒组相比,DKK3-OE可显著上调HT22细胞DKK3 mRNA的表达,DKK3-OE用于转染HT22细胞(P<0.01)。见表3。

表3 各组HT22细胞DKK3 mRNA表达情况
2.4 藏红花素对各组HT22细胞凋亡的影响 与正常组相比,Aβ25-35组和DKK-OE组的细胞凋亡率极显著升高(P<0.01);与Aβ25-35组相比,Aβ25-35+藏红花素组和Aβ25-35+DKK3 siRNA组的细胞凋亡率极显著降低(P<0.01)。与DKK3-OE组相比,DKK3-OE+藏红花素组的细胞凋亡率极显著降低(P<0.01)。见图1。

注:A.正常组;B.Aβ25-35组;C.Aβ25-35+藏红花素组;D.Aβ25-35+DKK3 siRNA组;E.Aβ25-35+siRNA对照组;F.DKK3-OE组;G.空白质粒对照组;H.DKK3-OE+藏红花素组与A组比较,▲P<0.05,▲▲P<0.01;与B组比较,★P<0.05,★★P<0.01;与F组比较,#P<0.05,##P<0.01图1 各组HT22细胞凋亡的比较

注:A.正常组;B.Aβ25-35组;C.Aβ25-35+藏红花素组;D.Aβ25-35+ DKK3 siRNA组;E.Aβ25-35+siRNA对照组;F.DKK3-OE组;G.空白质粒对照组;H.DKK3-OE+藏红花素组与A组比较,▲P<0.05,▲▲P<0.01;与B组比较,★P<0.05,★★P<0.01;与F组比较,#P<0.05图2 各组HT22细胞突触长度和分支数比较
2.5 藏红花素对各组HT22细胞突触的影响 与正常组相比,Aβ25-35组和DKK-OE组的细胞突触长度和分支数均显著减少(P<0.01);与Aβ25-35组相比,Aβ25-35+藏红花素组和Aβ25-35+DKK3 siRNA组的细胞突触长度和分支数极显著增加(P<0.01)。与DKK3-OE组相比,DKK3-OE+藏红花素组的细胞突触长度和分支数极显著增加(P<0.05)。见图2。
2.5 藏红花素对各组HT22细胞相关蛋白表达的影响 与正常组相比,Aβ25-35组、DKK-OE组细胞Aβ、DKK3、p-GSK-3β/GSK-3β、Caspase-3、Bax蛋白表达显著升高,β-catenin、Bcl-2蛋白表达显著降低(P<0.01)。与Aβ25-35组相比,Aβ25-35+藏红花素组和Aβ25-35+ DKK3 siRNA组细胞Aβ、DKK3、p-GSK-3β/GSK-3β、Caspase-3、Bax蛋白表达显著降低,β-catenin、Bcl-2蛋白表达显著升高(P<0.05)。与DKK3-OE组相比,DKK3-OE+藏红花素组细胞Aβ、DKK3、p-GSK-3β/GSK-3β、Caspase-3、Bax蛋白表达显著降低,β-catenin、Bcl-2蛋白表达显著升高(P<0.05)。见图3。

注:与A组比较,▲P<0.05,▲▲P<0.01;与B组比较,★P<0.05,★★P<0.01;与F组比较,#P<0.05,##P<0.01图3 各组HT22细胞相关蛋白表达的比较
3 讨论
AD神经病理学特征包括Aβ在老年斑中大量积累,Aβ的积累与神经元功能障碍和神经元丢失密切相关。Aβ25-35可显著增加神经细胞凋亡,增加神经细胞毒性[7-8]。本研究采用Aβ25-35诱导模拟细胞AD样损伤,结果显示,Aβ25-35诱导后HT22细胞活性显著下降,细胞凋亡显著增加,促凋亡蛋白 Caspase-3、Bax 蛋白表达升高,而抑凋亡蛋白Bcl-2表达降低,神经细胞的突触长度、分支数均显著下降,与既往研究报道相符[8-10],表明Aβ25-35诱导可造成HT22细胞AD样损伤。研究显示藏红花素可通过抑制抗氧化应激、调控凋亡通路减少神经细胞的凋亡[5,11]。本研究采用1.0 μmol/L藏红花素处理Aβ25-35诱导细胞发现,藏红花素可下调促凋亡Caspase-3、Bax蛋白表达、上调抑凋亡Bcl-2蛋白表达,抑制Aβ25-35诱导的细胞凋亡,增加细胞活性,且染色实验表明藏红花素可促进Aβ25-35诱导神经细胞的突触发生,提示藏红花素可抑制Aβ25-35对神经细胞的凋亡影响,并促进损伤细胞突触的再发生。
Wnt/β-catenin信号通路与包括AD在内的多种神经系统疾病的发生、发展有密切联系,该通路的激活可保护神经细胞免受Aβ引起的毒性损伤[12-13]。GSK-3β富集于中枢神经系统,是调节及记忆学习能力的重要分子,GSK-3β可水解Aβ前体,GSK-3β与Aβ彼此促进可加剧AD的病理发展[14]。GSK-3β是WNT/β-catenin信号通路的关键负调控激酶,当WNT蛋白失活,β-catenin的表达可直接受到GSK-3β的负调控[14]。本研究结果显示,Aβ25-35可上调细胞GSK-3β蛋白磷酸化水平,抑制β-catenin蛋白表达,而藏红花素干预可以逆转上述蛋白变化。
研究显示,DKK3过表达可抑制GSK-3β磷酸化表达以及β-catenin蛋白的激活[15-16]。本研究通过构建DKK3过表达以及沉默质粒观察DKK3不同表达对神经细胞的影响。测定结果表明,Aβ25-35诱导HT22细胞转染DKK3 siRNA后细胞凋亡下降,突触长度、分支数增加,Aβ、p-GSK-3β/GSK-3β、Caspase-3、Bax蛋白表达降低,而β-catenin、Bcl-2蛋白表达上调。而正常神经细胞转染DKK3过表达质粒后,各项检测结果与Aβ25-35诱导细胞结果呈相同趋势,但经藏红花素干预后,细胞凋亡下降,突触再发生显著,细胞内Aβ、p-GSK-3β/GSK-3β、Caspase-3、Bax蛋白表达降低,β-catenin、Bcl-2蛋白表达上调;显示藏红花素可能通过抑制DKK3表达调控GSK-3β/β-catenin信号通路以改善神经细胞损伤。
综上所述,藏红花素对Aβ25-35诱导的神经细胞损伤具有改善作用,其作用可能通过抑制DKK3调控GSK-3β/β-catenin信号通路实现。

