砷污染治理背景下阳宗海浮游植物生物量的时空分布模式及驱动因子*
郑 昕,陈 丽,仇 菲,张 涛,张昭阳,尚 丽,白宁静,陈小林,赵帅营,孔令阳,陈光杰
(云南师范大学地理学部, 云南省高原地理过程与环境变化重点实验室,昆明 650500)
重金属污染物已成为威胁湖泊水质和生态健康的重要胁迫因子[1],目前对于重金属污染水体的污染防控评估与生态修复效果评价研究总体较少。阳宗海是云南省第三大深水湖泊,于2008年发生了砷污染事件,污染发生后湖水中砷的浓度一度高达176.9 μg/L,为国家饮用水标准(10.0 μg/L)的17.7倍,水质从II类急剧下降为劣V类[2-4]。阳宗海砷污染治理主要分为两期,第一期时间为2009年10月-2011年10月,治理后湖水平均砷浓度从128.0 μg/L降低到49.0 μg/L;之后砷浓度出现反弹,在2017年10月-2019年10月期间进行了二期污染治理。两次治理后湖水的平均砷浓度降至29.7 μg/L,但仍然超过国家生活饮用水卫生标准[2,5]。两次砷污染治理方案中,主要采用喷洒三氯化铁絮凝剂降低阳宗海湖水中的砷浓度,可能导致沉积物成为砷污染物的高蓄积体和二次污染源[6-8]。底泥污染物的释放可以造成水体出现二次砷污染的风险及季节性波动,将通过生物吸收作用和食物网营养级的物种传递对湖泊生物产生直接或间接的毒性效应并呈现出季节性的变化规律[9-10]。因此,阳宗海沉积物中砷的二次释放过程可以严重威胁湖泊生态系统的健康。
浮游植物(浮游藻类)作为初级生产者,是湖泊食物网的基础[11]。浮游植物受到温度、营养盐、重金属等非生物因子及浮游动物、鱼类等生物因子的共同调控,同时浮游植物由于生长周期短,能够对外界环境的变化做出快速响应,常被用来作为水环境污染的指示生物,其变化将对湖泊生态系统产生重要的影响,是湖泊生态系统健康的重要评价指标[11]。重金属浓度超过一定阈值后能够对浮游植物产生毒害效应,该效应与重金属种类、元素形态、浮游植物种类等有关[12-14]。其中,砷元素对浮游植物生物量的影响存在“低促高抑”的作用[15-17]。同时,氮磷营养盐能够通过影响浮游植物的蛋白质合成和磷代谢从而对砷的作用产生影响,如五价砷通过磷的转运通道进入藻细胞,磷能够显著减轻五价砷的毒性[18-21]。此外,富营养化能够通过影响水体砷循环而进一步对浮游植物的生长产生影响,富营养化容易导致沉积物-水界面的缺氧环境,从而促进毒性更强的三价砷的释放,进一步对浮游植物的生长产生影响[22]。砷不仅可以直接影响浮游植物的生长,而且可以通过食物网的传递作用间接影响更高营养级的生物,从而对湖泊生态系统的结构和功能产生重要影响[23-25],浮游植物已成为指示砷污染水平及其生态效应的敏感指标[23,26]。因此,有必要系统研究砷污染背景下影响阳宗海浮游植物生物量变化的环境因子,以识别砷对浮游植物生物量的驱动作用。
本研究对2015-2019年阳宗海浮游植物生物量的时空变化规律进行研究,并进一步通过统计分析方法识别其与环境因子的关系,探讨砷污染修复后水体遗留砷对藻类的毒性作用和生态效应,以期为阳宗海的砷污染防治和生态安全评价提供科学支撑和数据基础。
1 材料与方法
1.1 样点设置
根据阳宗海形态特点,设置T1、T3、T5共3个样点进行样品采集(图1)。采样时间为2015年4、6、8、12月,2016年3、6、9、12月,2017年4、6、9、12月,2018年和2019年的3、6、9和12月。后续分析中,分别将3(4)、6、8(9)和12月归为春季、夏季、秋季和冬季。
图1 阳宗海采样点分布Fig.1 Sampling sites of Lake Yangzong
1.2 样品采集和测定
采集2 L表层水样用于分析总磷(TP)、总氮(TN)等水质理化因子,水温(WT)和pH用YSI 6600多参数水质分析仪测量,透明度(SD)用塞氏盘测定。总磷和总氮的分析参考《水和废水监测分析方法》(第四版)[27]。水样经0.45 μm的膜过滤后采用二乙基二硫代氨基甲酸银分光光度法(中华人民共和国国家标准GB 7485-1987)和原子荧光法(中华人民共和国国家标准HJ 694-2014)测定砷含量,其中2015年4月-2016年12月样品的砷含量采用二乙基二硫代氨基甲酸银分光光度法测定,2017年4月-2019年12月样品的砷含量采用原子荧光法测定。浮游植物现存量一般用藻数量(细胞个数和个体数)和重量(生物量)来表示,由于不同种类的藻个体差异较大,因此生物量已经被广泛用于浮游植物的定量分析[28]。采集1 L表层水样,加入鲁哥和甲醛固定后静置48 h,采用虹吸法吸掉上清液后将样品浓缩至50 mL,混匀后吸取0.10 mL在显微镜下计数并计算生物量[27-29]。
1.3 数据统计分析
2015年8月T1和T3位点的砷浓度低于检测限,根据T5位点砷浓度从底层到表层减少的规律及T1和T3位点分层水样的砷浓度(本课题组未发表数据)对T1和T3位点表层水的砷浓度进行校正[30]。对浮游植物生物量和环境因子进行正态分布检验并进行转换使其趋于正态分布。利用ANOVA分析浮游植物生物量和环境因子的时空差异性。采用Pearson分析浮游植物生物量与环境因子之间的相关性,并对显著环境因子与生物量做散点图。利用多元线性回归分析解释浮游植物生物量与多个环境因子之间的线性关系。数据进行标准化处理后对环境因子进行VIF检验,去掉膨胀系数大于10的环境因子后,采用多元线性回归分析识别驱动阳宗海浮游植物生物量变化的显著环境因子。所有数据分析均通过Origin 9.0和R 4.1.0处理。
2 结果
2.1 2015-2019年浮游植物生物量的时空分布特征
2015-2019年,阳宗海浮游植物生物量的范围为0.7~30.4 mg/L,平均生物量2016年最低,2017年最高。采样期间浮游植物生物量表现为秋季相对较高,冬季相对较低(图2)。2015-2019年蓝藻门占据绝对优势,生物量相对比例为24.6%~97.2%,平均值为74.9%,其生物量变化趋势与浮游植物生物量变化趋势基本一致(图2)。ANOVA分析结果显示,2015-2019年年际上以及分年度季节上浮游植物生物量差异显著,而空间差异均不显著。
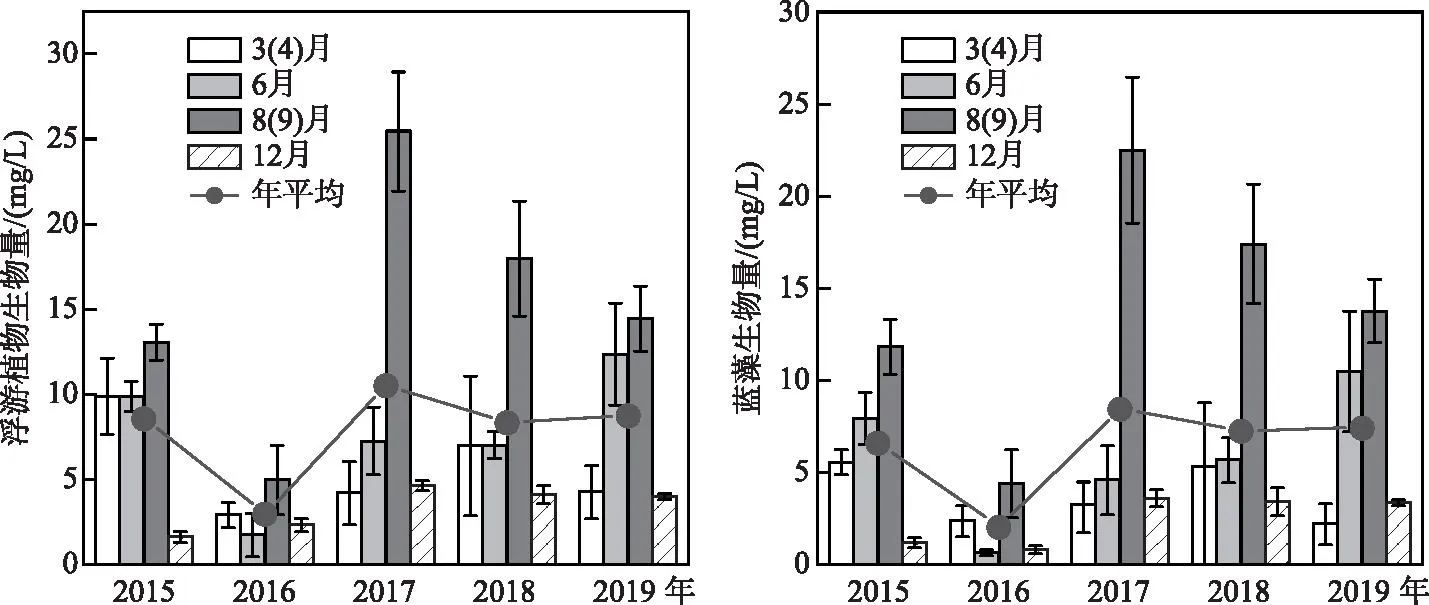
图2 阳宗海浮游植物生物量的变化特征 Fig.2 Variation characteristics of phytoplankton biomass in Lake Yangzong
2.2 2015-2019年环境因子的变化特征
2015-2019年阳宗海主要环境因子的变化见图3。砷浓度年平均值在2016年最高,为(63.4±24.1)μg/L,2017年治理后呈下降趋势,2019年平均值最低,为(26.6±9.0)μg/L;2015、2018和2019年均为混合期,相对浓度较高,而2016和2017年夏季砷浓度最高。2015-2019年年平均温度分别为(20.7±3.3)、(18.0±5.2)、(20.0±4.1)、(19.1±4.0)和(19.7±4.4)℃,2016年平均温度最低;季节上均表现为夏季(5年平均值为(23.6±0.7)℃)和秋季(5年平均值为(24.7±0.9)℃)温度较高,而春季(5年平均值为(15.7±1.6)℃)和冬季(5年平均值为(15.0±1.9)℃)温度相对较低。总氮年平均值2018年最高((1110.3±640.3)μg/L),2016年最低,为(792.5±183.5)μg/L;季节上,总氮5年平均值表现为2015和2019年冬季最高而夏季最低,2016年春季最高而夏季最低,2017年冬季最高而秋季最低,2018年秋季最高而夏季最低。总磷年平均值在2015年最高((39.6±8.6)μg/L),2018年最低((28.3±5.7)μg/L);2015、2017、2018年总磷浓度均为冬季最高,而2016和2019年分别为春季和夏季最高。透明度5年来总体呈升高趋势,范围为0.9~4.9 m;季节上春季和冬季相对较高,秋季最低。pH最高值为10.1,最小值为7.2;季节上,除2018年外,春季与冬季pH值较夏季和秋季低(图3)。ANOVA结果显示,除2015年的透明度和2016年的pH外,砷、温度、总氮、总磷、透明度和pH在分年度上均存在显著的季节差异(P<0.05),所有指标空间差异均不显著(P>0.05)。
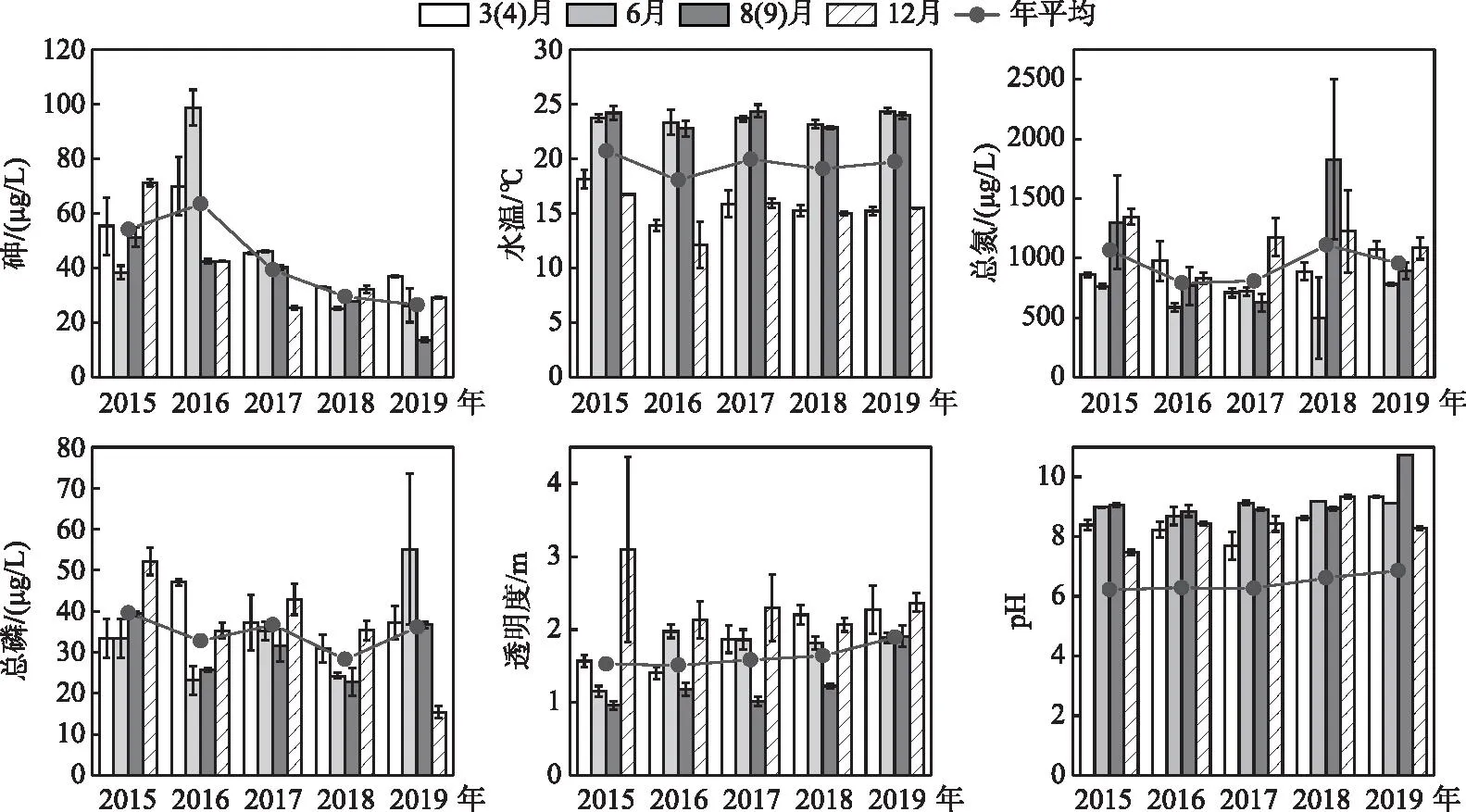
图3 阳宗海环境因子的变化特征Fig.3 Variation characteristics of environmental factors in Lake Yangzong
2.3 Pearson相关分析和多元回归分析结果
Pearson相关分析结果(表1)显示,2015-2019年浮游植物总生物量和蓝藻生物量均与水温和pH呈显著正相关,与透明度和砷含量呈显著负相关。浮游植物总生物量和蓝藻生物量与水温、pH、透明度、砷含量的相关系数分别为0.57、0.45、-0.58、-0.49和0.56、0.31、-0.48、-0.43。由于pH、透明度和浮游植物生物量存在相互影响的关系,进一步对水温和砷与浮游植物生物量和蓝藻生物量的关系做了散点图,结果见图4。
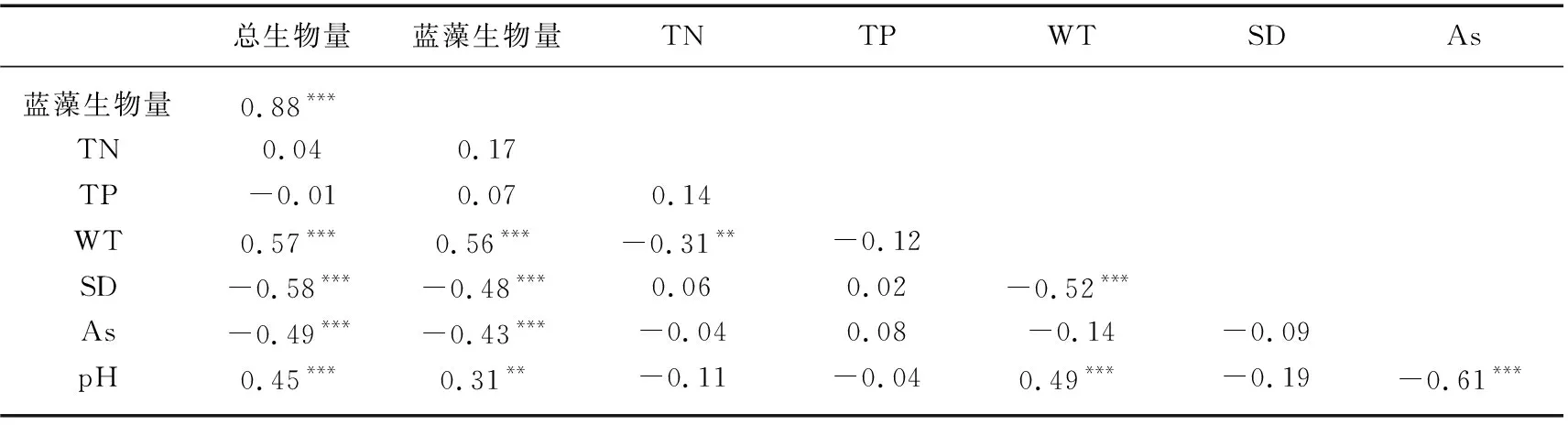
表1 阳宗海浮游植物生物量与环境因子的Pearson相关分析Tab.1 Pearson correlation analysis of phytoplankton biomass and environmental factors in Lake Yangzong
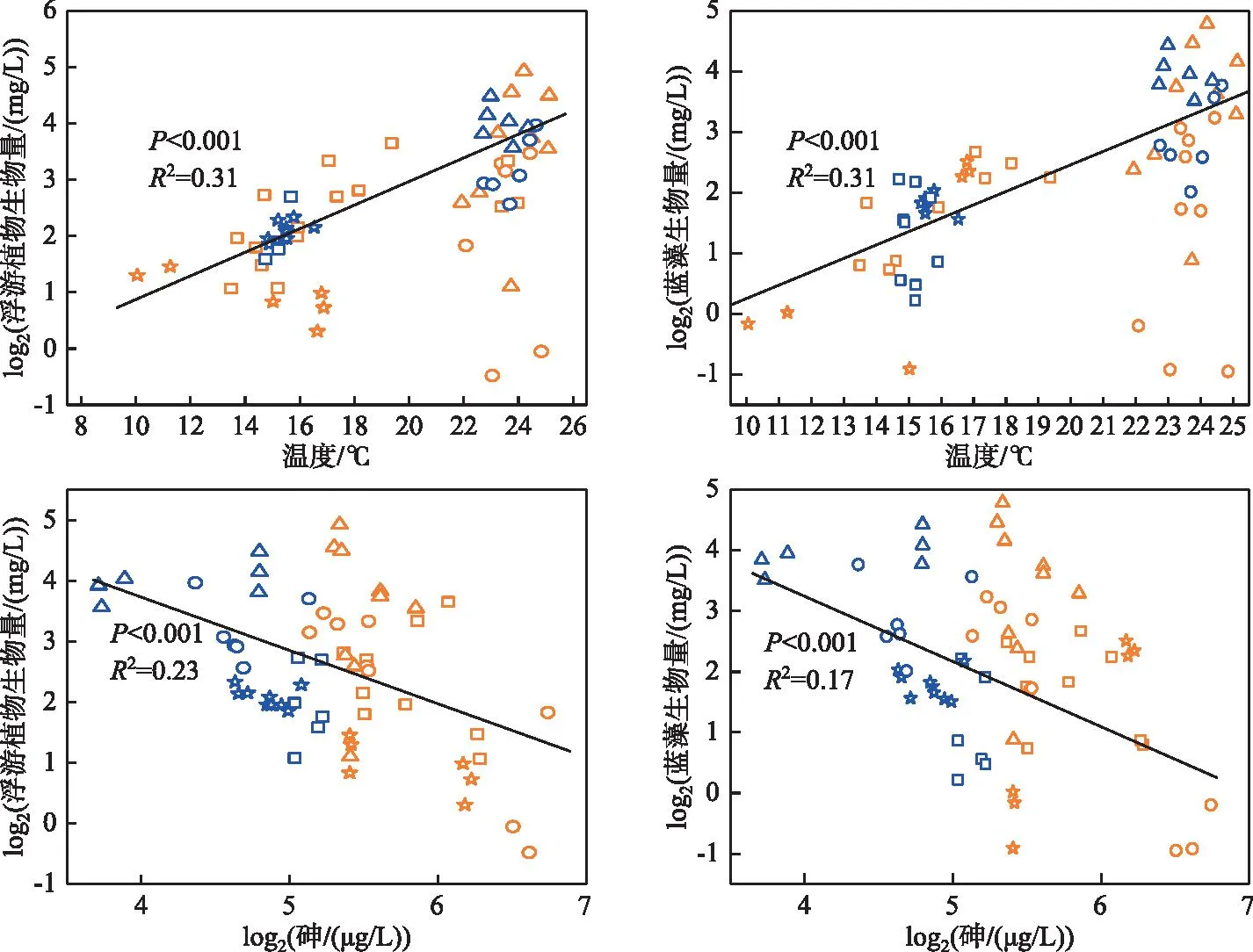
图4 阳宗海环境因子与浮游植物生物量的散点图(橘色为治理前,蓝色为治理后,正方形为春季,圆形为夏季,三角形为秋季,五角星形为冬季)Fig.4 Scatter diagram of environmental factors and phytoplankton biomass in Lake Yangzong
对浮游植物总生物量和蓝藻生物量与各环境因子进行多元线性回归分析,通过逐步筛选建立回归方程,回归方程见表2。温度和砷是驱动阳宗海浮游植物生物量和蓝藻生物量变化的显著因子,其中温度对浮游植物生物量和蓝藻生物量的解释比例最大,系数分别为0.54和0.63,其次是砷,系数分别为-0.41和-0.34,总氮的解释比例最小,系数分别为0.19和0.33。

表2 阳宗海浮游植物生物量与环境因子的多元线性回归分析Tab.2 Multiple linear regression analysis of phytoplankton biomass and environmental factors in Lake Yangzong
2.4 浮游植物细胞丰度/生物量、砷和氮磷营养盐的长期变化
阳宗海浮游植物细胞丰度/生物量、砷和氮磷营养盐的长期变化见表3。2008年砷污染之前阳宗海浮游植物细胞丰度和砷浓度均相对较低[31-33],2008年砷污染事件后浮游植物细胞丰度显著升高。2008-2013年,浮游植物细胞丰度呈上升趋势,范围为4.1×103~8.0×107cells/L,在此期间磷和砷浓度先上升后下降而氮浓度变化趋势相反[31,34-35]。2015-2019年,浮游植物细胞丰度的范围为7.6×106~4.2×109cells/L,与生物量的变化趋势一致。ANOVA分析显示,调查期间浮游植物细胞丰度和总氮浓度显著高于2008-2013年(P<0.05),砷浓度显著低于2008-2013年(P<0.05),而总磷与2008-2013年不存在显著差异(P>0.05),反映了调查期间浮游植物细胞丰度的增加可能与砷浓度的降低和总氮浓度的增加有关。
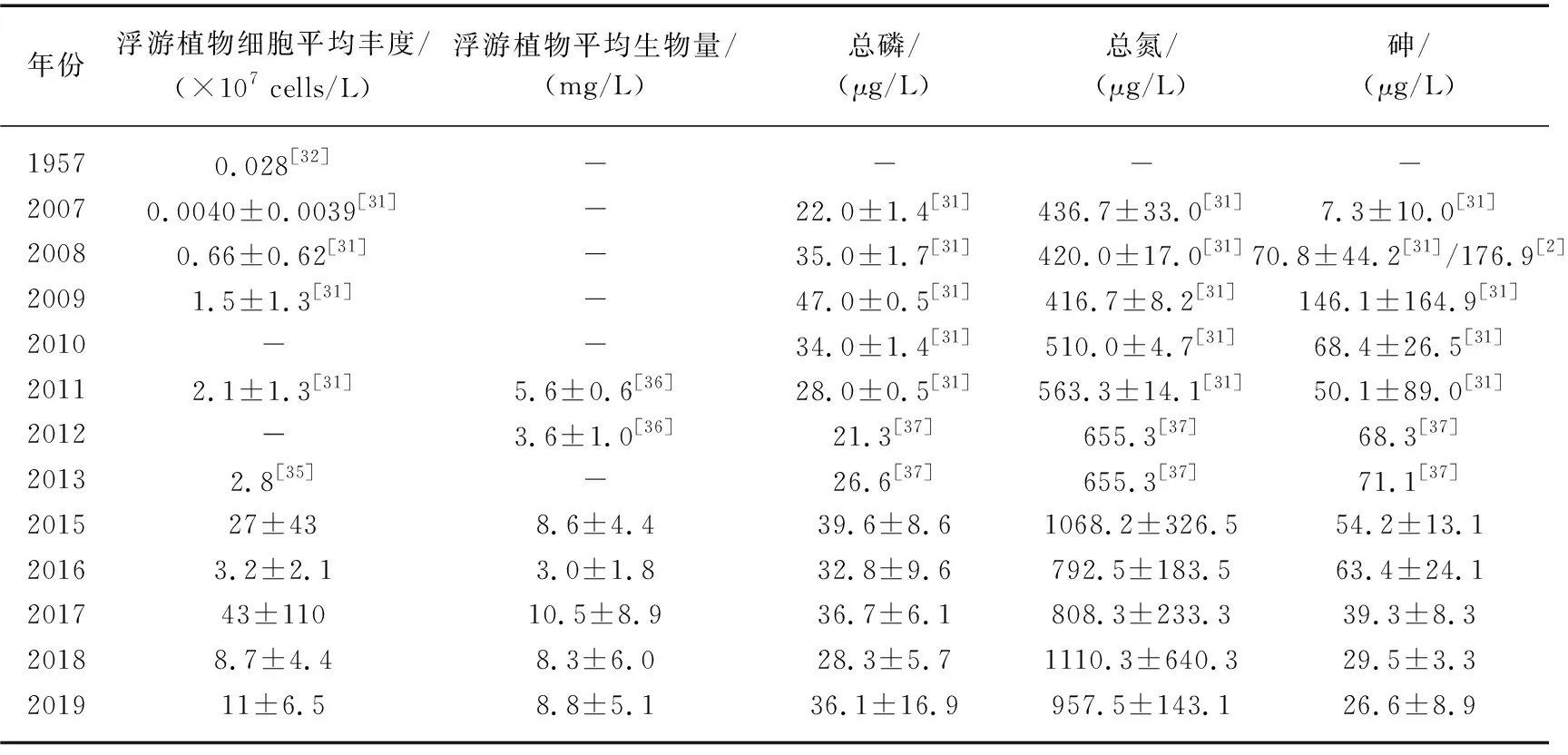
表3 阳宗海浮游植物细胞丰度、生物量与氮磷营养盐的长期变化Tab.3 Long-term changes of phytoplankton cell abundance, biomass, nitrogen and phosphorus nutrients in Lake Yangzong
3 讨论
3.1 砷对浮游植物的影响
研究表明不同种类的浮游植物对砷的敏感性不同,长期砷污染能够改变水体中浮游植物的物种组成,导致优势种向耐砷种类转变,同时降低浮游植物多样性[26,38-39]。阳宗海砷污染以来,蓝藻成为浮游植物的全年绝对优势门类,2015-2019年蓝藻门的生物量相对比例平均值为74.9%,这可能与蓝藻对砷的耐受性相对较高有关[8-9,16,31,34]。此外蓝藻的竞争优势较强,水体营养盐浓度高等条件均可能导致蓝藻占优[40-41]。
本研究结果显示调查期间阳宗海浮游植物生物量与砷呈显著负相关。研究表明低浓度砷促进浮游植物的生长而高浓度砷抑制浮游植物的生长[15-17,20]。一定浓度的砷能够抑制浮游植物的光合作用、破坏细胞结构、诱导细胞发生氧化损伤,从而对浮游植物产生毒性效应,抑制浮游植物的生长[8,16,18-21,23,42-43]。砷对浮游植物的毒性以及浮游植物对砷的富集和转化与氮磷营养盐有关[17-20]。淡水浮游植物对砷响应较为敏感,自然本底的砷浓度已经是一些营养盐限制淡水水体浮游植物变化的驱动因子[42],而营养盐如磷浓度的增加能够减轻砷对浮游植物的毒性,甚至可能出现低促效应,如对砷污染湖泊大屯海的研究结果显示浮游植物生物量与砷呈正相关,反映了砷对浮游植物生长的促进作用,这可能与大屯海磷浓度相对较高有关[44]。此外,研究显示经历过砷污染的浮游植物对砷的耐受性增强[23,26]。2015-2019年,阳宗海砷的浓度范围为13.1~107.0 μg/L,平均值为(42.6±19.7)μg/L,氮的浓度范围为220.7~2561.1 μg/L,平均值为(943.2±357.0)μg/L,磷浓度的范围为13.5~79.5 μg/L,平均值为(34.7±10.8)μg/L。虽然阳宗海浮游植物经历了长期的砷污染后对砷的耐受性可能增强,但是浮游植物生物量与砷呈负相关,表明在以上砷和营养盐浓度范围内,砷对浮游植物的生长仍然表现为抑制作用[23-25]。此外,2016年浮游植物的细胞丰度和生物量低于其他年份也可能与2016年砷浓度相对较高有关。
3.2 温度对浮游植物生长的影响
Pearson和多元线性回归的结果表明,温度是驱动阳宗海浮游植物2015-2019年生物量变化的显著因子。温度对浮游植物至关重要,通过影响浮游植物的新陈代谢而对其生长产生影响[45]。本研究结果显示2016年平均温度较低((18.0±5.2)℃),年平均生物量也相对较低((3.0±1.8)mg/L);2015-2019年阳宗海秋季浮游植物生物量平均值最高((15.2±7.1)mg/L),水温平均值为(24.7±0.9)℃;春季和冬季生物量相对较低(平均值分别为(5.7±2.9)和(3.3±1.2)mg/L),与此相对应水温也相对较低,平均值分别为(15.7±1.6)和(15.0±1.9)℃,对浮游植物全年优势门类蓝藻的生长产生了一定的抑制作用。不同种类的浮游植物最适生长温度不同,蓝藻的最适生长温度高于绿藻和硅藻[46]。因此阳宗海温度与浮游植物呈显著正相关也可能与蓝藻占据绝对优势有关。周起超等的季节调查显示阳宗海浮游植物生物量(以叶绿素a浓度表征)与温度呈负相关,本研究结果与其不一致,这可能与采样时间有关[47]。研究显示湖泊浮游植物生物量峰值出现的时间在不同的年份可能不同,如李春永和杨中兰对阳宗海2009-2010年浮游植物的逐月调查显示,2009年7月藻细胞密度最高而2010年9月和10月相对较高[34]。周起超等的采样时间为2014年10月、2015年1月、4月和2016年7月,温度较低的2015年1月阳宗海浮游植物生物量最高,从而导致浮游植物生物量与温度呈负相关[47]。
此外,温度可能通过影响湖水表层砷浓度而对浮游植物生物量产生影响[9]。阳宗海为暖单次混合型深水湖泊,其热力学分层存在季节变化特征,表现为冬季湖水混合、春季开始形成分层、夏秋季分层稳定[47]。研究表明湖泊混合状态能够影响砷从沉积物到上覆水体中的转移。在存在显著季节性热力学分层的深水砷污染湖泊,夏季热分层引起底层水体的季节性缺氧,导致了沉积物中砷的释放并限制于底层缺氧水体中,表层湖水中砷浓度相对较低;随着分层现象的消退,水体出现混合,底层砷向上层水体转移,导致表层湖水中砷含量升高[48-49]。因此,阳宗海水温的季节性变化导致水体热力学分层的季节变化,从而可能对湖水表层的砷浓度产生影响,进一步影响浮游植物生物量的季节性变化。本研究中砷与水温呈负相关,但是相关性不显著,相关性系数仅为-0.14,这可能与2016年6月砷浓度较高及2017年12月(二次砷污染开始治理后)砷浓度降低有关。
4 小结
2015年4月-2019年12月,蓝藻门为阳宗海浮游植物的主要优势门类,其生物量变化趋势与浮游植物生物量基本一致。浮游植物生物量和蓝藻生物量均夏秋季较高而冬季相对较低,2016年平均生物量最低而2017年最高。温度和砷是调查期间浮游植物生物量和蓝藻生物量变化的显著驱动因子。温度与浮游植物生物量和蓝藻生物量呈显著正相关,可能与蓝藻相对喜高温有关。砷表现出对阳宗海浮游植物生长的抑制作用,可能反映了水体砷遗留物的藻类毒性效应和长期生态效应。研究结果可为阳宗海的生态安全评价及综合治理提供科学依据。

