环2-(4-三氟甲基)苯基吡啶钌亚硝酰配合物的合成与光敏NO释放
李襄宏,吴秋俣,王艺荣,李珍
(中南民族大学 化学与材料科学学院,武汉 430074)
一氧化氮(NO)作为重要的生物活性分子之一,已被证实在高浓度(μmol·L-1~mmol·L-1)下可促使细胞凋亡坏死.随着光热及光动力治疗技术的发展,光敏型NO 供体分子包括硝基苯类[1-2]、N-亚硝胺类[3-4]、金属亚硝酰配合物[5]等的设计、合成及性能研究受到了国内外学者的广泛关注.钌亚硝酰配合物作为NO 分子供体,具有特殊的光敏性、较高的热稳定性、低的细胞毒性和较好的抗肿瘤活性[6-10].因此,开发结构新颖、合成较容易且功能优异的新型钌亚硝酰配合物在抗肿瘤治疗领域具有重要意义[5].环金属钌配合物以Ru—C 键替代Ru—N[11-12],增加了配合物在生理环境中的稳定性和亲脂性,具有更好的生物相容性和对癌细胞更强的细胞毒性[13-14].然而,基于环金属钌亚硝酰配合物的NO 供体分子方面的研究却比较少见[15-17],合成新的环金属钌类亚硝酰配合物仍然具有很大的挑战性.
本文以2-(4-三氟甲基)苯基吡啶为C,N-配体,2,2′-二联吡啶为N,N-配体,合成了其环金属钌配合物[Ru(bpy)2(4-CF3ppy)]PF6,随后将其与NOBF4反应制备得到了环2-(4-三氟甲基)苯基吡啶钌亚硝酰配合物[Ru(bpy)(4-CF3ppy)(CH3CN)NO](PF6)2(配合物1,如图1 所示),核磁、红外、质谱和循环伏安表征其结构正确.紫外-可见吸收光谱以及EPR 表征说明该配合物可光敏释放NO.相同条件下,其光敏NO 释放量显著高于[Ru(bpy)(ppy)(CH3CN)NO]2+和[Ru(bpy)(4-OCH3ppy)(CH3CN)NO]2+,这一结果与理论计算中Ru-N(NO+)的结合能大小一致.

图1 钌亚硝酰配合物1的合成Fig.1 Synthesis of ruthenium nitroyl complex 1
1 实验部分
1.1 试剂和仪器
甲苯、乙醇、乙腈、石油醚、二氯甲烷等有机溶剂、碳酸钠、六氟磷酸铵等无机盐(国药集团化学试剂);4-三氟甲基苯硼酸、2-溴吡啶、四(三苯基膦)钯、对氨基苯磺酸、85%浓磷酸、N-(1-萘)乙二胺二盐酸盐、四丁基六氟磷酸(上海阿拉丁);四氟硼酸亚硝鎓、NO 自由基捕获剂2-(4-羧基苯基)-4,4′,5,5′-四甲基咪唑啉-1-氧基-3-氧化物钾盐(c-PTIO)(上海麦克林);[Ru(cymene)Cl2)]2(北京百灵威),所有试剂均为分析纯.环金属钌亚硝酰配合物[Ru(bpy)(ppy)(CH3CN)NO]2+和[Ru(bpy)(4-OCH3ppy)(CH3CN)NO]2+按文献[17]方法合成并通过核磁表征;2-(4-三氟甲基苯基)吡啶参考文献[18]方法合成并通过核磁表征.
核磁共振仪(Ascend Ⅲ TM 600 MHz,Bruker);质谱仪[autoflex TM speed MALDI-TOF,Bruker,以CHCA(α-氰-4-羟基肉桂酸)为基质];紫外-可见分光光度计(UV-1800PC,上海美析);红外光谱仪(Nexus470,Thermo Nicolet);顺磁共振波谱仪(EMX Plus,Bruker);电化学工作站[CHI660C,以Ag+/Ag 做参比电极,玻碳电极做工作电极,Pt 丝做对电极,n-Bu4NBF6(0.1 mol·L-1)做支持电解质,乙腈溶液中扫描速度为50 mV·s-1];氙灯光源系统(CEL-HXF300-T3,中教金源科技);光功率与能量计(PM100D,Thorlabs).
1.2 配合物[Ru(bpy)2(4-CF3ppy)]PF6的合成
氩气气氛下,2-(4-三氟甲基苯基)吡啶(0.174 g,0.78 mmol)、KPF6(0.294 g,1.60 mmol)、乙腈12 mL和三乙胺0.35 mL依次加入50 mL三颈瓶中.搅拌均匀后,再加入[Ru(cymene)Cl2)]2(0.300 g,0.5 mmol),在55 ℃下回流16 h.冷却反应液至室温,旋蒸除掉溶剂得暗红色固体.继续向上述反应体系中加入2,2′-二联吡啶(0.250 g,1.57 mmol)和甲醇10 mL,回流12 h 后停止反应并冷却至室温.旋蒸,以二氯甲烷/乙腈作为洗脱剂,通过硅胶柱层析纯化,得黑色固体产物0.55 g,产率为70%.1H NMR(600 MHz,CD3CN)δ8.46(d,J=8.3 Hz,1H),8.39(d,J=8.1 Hz,1H),8.33(d,J=7.8 Hz,2H),8.12(d,J=8.0 Hz,1H),8.03~7.92(m,3H),7.88~7.77(m,4H),7.77~7.68(m,3H),7.65~7.61(m,1H),7.44~7.39(m,1H),7.27~7.17(m,3H),7.16(dd,J=8.1,1.3 Hz,1H),7.04~6.99(m,1H),6.69(s,1H).13C NMR(151 MHz,CD3CN)δ194.87,166.54,158.18,157.43,157.19,155.68,154.74,151.28,150.92,150.76,150.35,149.74,137.18,136.58,135.87,134.88,134.76,131.42,131.40,127.65,127.12,126.98,126.86,124.34,124.10,124.04,123.84,123.76,123.71,120.47.MS(Maldi-TOF,CHCA):m/z计算值636.09[M-PF6-]+,实验值636.23.
1.3 环金属钌亚硝酰配合物1的合成与表征
氩气气氛下,向三口瓶中依次加入配合物[Ru(bpy)2(4-CF3ppy)]PF6(0.101g,0.13 mmol)、乙腈12 mL和四氟硼酸亚硝鎓(0.076 g,0.65 mmol),在10 ℃下避光反应1 h 后,浓缩反应液体积至3 mL.室温下,缓慢加入饱和六氟磷酸铵水溶液10 mL,待固体析出后过滤,用大量去离子水和乙醚洗涤产品,真空干燥后,将其溶解乙腈中,加入乙醚重结晶得到0.098 g 暗红色晶体1,产率90%.1H NMR(600 MHz,DMSO-d6)δ9.45(dd,J=6.6 Hz,1.2 Hz,1H),9.09~9.00(m,2H),8.89(d,J=8.0 Hz,1H),8.82(d,J=8.0 Hz,1H),8.72(td,J=8.0,1.4 Hz,1H),8.63(td,J=7.9,1.5 Hz,1H),8.49(d,J=8.2 Hz,1H),8.42(td,J=8.0,1.4 Hz,1H),8.24~8.20(m,1H),8.01~7.98(m,1H),7.73(dd,J=8.0,1.2 Hz,1H),7.62~7.58(m,1H),7.22(dd,J=6.6 Hz,1.2Hz,1H),6.71(d,J=1.2 Hz,1H),2.08(s,3H).13C NMR(151 MHz,DMSO-d6)δ161.29,155.85,153.32,152.91,150.43,147.13,146.64,143.85,143.79,142.91,130.34,130.02,129.39,128.63,126.77,126.64,126.09,125.38,124.96,124.24,123.64,122.43,118.08,1.15.IR(KBr,cm-1):1911(νN≡O),839(νP-F).MS(Maldi-TOF,CHCA):m/z计算值696.01 [M-PF6-]+,实验值:696.38,666.28 [M-PF6-NO]+.
1.4 理论计算
分子的几何结构使用Perdew-Burke-Ernzerhof(PBE)方法结合def2-SVP 基组,通过Gaussian16 软件进行了充分优化,采用Grimme 的DFT-D3(BJ)经验色散校正.在相同水平上计算了振动频率,以确认所有结构都不具有虚频,即所优化结构对应于势能面上的局部极小值.在PBE0/def2-TZVP 级别上对Ru 和NO 之间的相互作用能进行了计算,并使用Boys 和Bernardi 提出的counterpoise 方法对进行了基组重叠误差(BSSE)进行了校正,其中相互作用能被定义为复合物的能量与NO 分子和不包括NO 的结构的能量之差,其中后两者的几何结构均冻结为其在复合物中的结构.在基态结构下,采用TDPBE0-D3(BJ)/def2-TZVP 计算了体系的激发能.根据Multiwfn 的分析结果,采用VMD 1.9.3 绘制了HOMO(最高占据分子轨道)和LUMO(最低未占据分子轨道).
1.5 吸收光谱及光敏NO释放
将配合物1 用乙腈溶解,配成1.0 mmol·L-1储备液,用乙腈稀释至20 μmol·L-1,在用氙灯照射0、10、30、60、120、180 min 后扫描吸收光谱,即得到1 在光照下的吸收光谱变化,光照强度为850 mW·cm-2.
将等体积的1%磺胺酸、5%磷酸和0.1%N-(1-萘)乙二胺二盐酸盐水溶液混合制备Griess试剂.将亚硝酸钠水溶液(5~100 μmol·L-1)与Griess 试剂混合,扫描其吸收光谱,以产生的偶氮染料在540 nm处的吸光度A 为纵坐标,NO2-浓度为横坐标制作标准曲线.吸取配合物1、储备液150 μL,Griess 试剂100 μL,配置1 的溶液(50 μmol·L-1)进行测试,光照强度为850 mW·cm-2.根据标准曲线测算NO/NO2-的量,以确定配合物1 的光敏NO 释放量.相同条件和方法测定[Ru(bpy)(ppy)(CH3CN)NO]2+和[Ru(bpy)(4-OCH3ppy)(CH3CN)NO]2+的NO释放量.
2 结果与讨论
2.1 配合物的合成与表征
按照文献[19]方法,首先合成了环金属钌配合物[Ru(bpy)2(4-CF3ppy)]PF6,氢谱[图2(a)]、碳谱[图2(b)]及质谱[图2(b)插图]确认了其结构.这里,图2(b)碳谱中位于δ194.87 的信号归属于苯环上与中心钌(Ⅱ)结合的碳原子特征信号峰.而图2(b)插图质谱中位于636.23 处的信号峰为配合物失去平衡阴离子PF6-后形成的分子离子碎片峰,与理论值636.09 [M-PF6-]+相符.
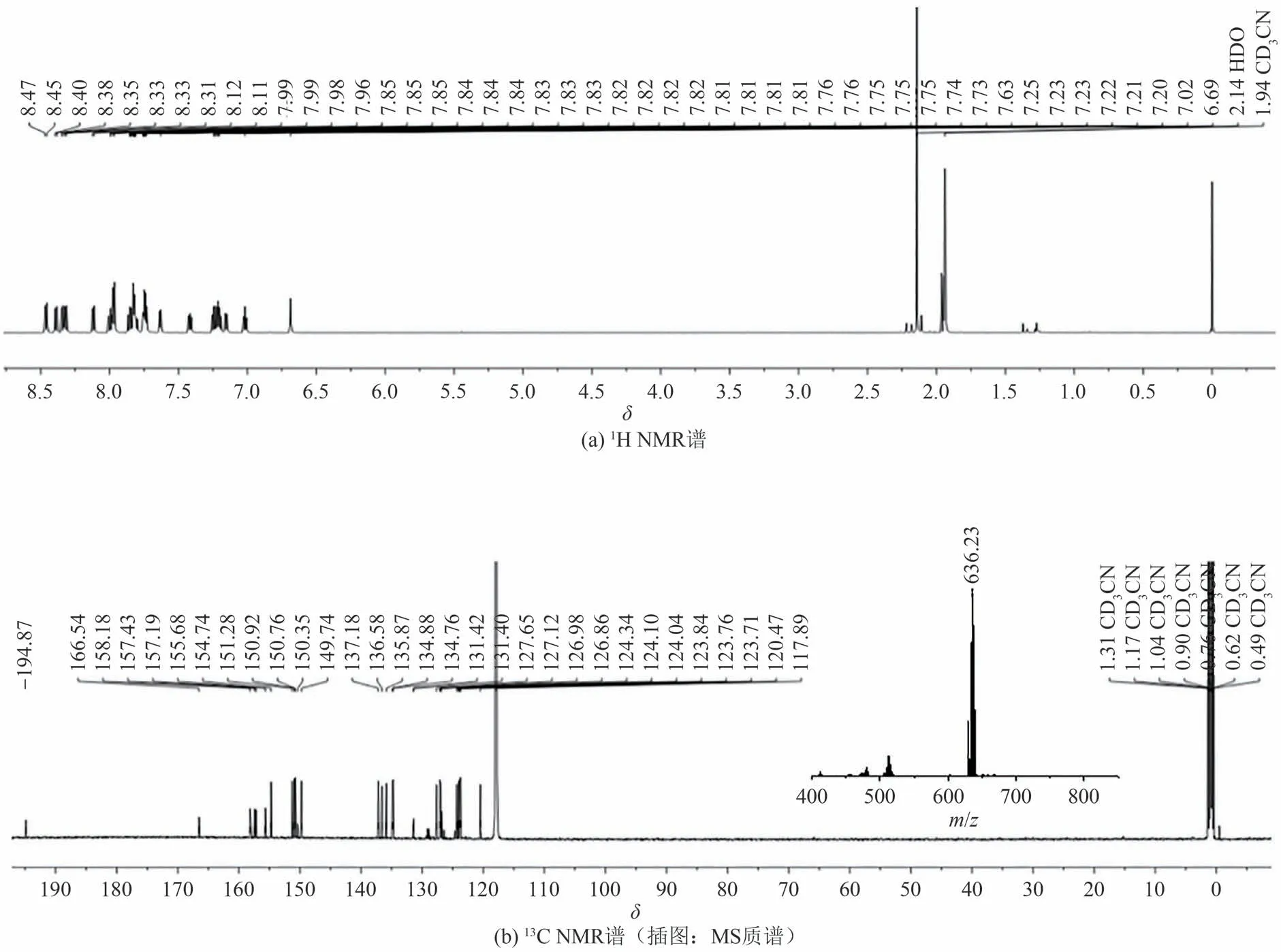
图2 [Ru(bpy)2(4-CF3ppy)]PF6的NMR谱和质谱Fig.2 NMR and MS spectra of [Ru(bpy)2(4-CF3ppy)]PF6,respectively
随后,将[Ru(bpy)2(4-CF3ppy)]PF6在弱酸性条件下与亚硝酸钠进行反应制备配合物1[16].由于环金属钌配合物中Ru-C在酸性溶液中不稳定性[20],尽管获得了目标配合物1,但产率极低,且副产物多,分离提纯困难.因此,以NOBF4代替亚硝酸钠作为NO 源,将其与[Ru(bpy)2(4-CF3ppy)]PF6进行反应,后处理得到钌亚硝酰配合物1,产率高达90%.氢谱[图3(a)]和碳谱[图3(b)]中所呈现的氢信号及碳信号表明[Ru(bpy)2(4-CF3ppy)]+在与NOBF4的反应中失去了一个bpy 分子从而空出两个配位点,分别与NO+及溶剂分子CH3CN配位并最终形成六配位的配合物1.质谱[图3(b)插图]中出现在696.38 的分子离子峰与[M-PF6-]+理论值696.01 接近,进一步确认该亚硝酰配合物的生成过程中失去了一个bpy 分子.值得一提的是,质谱中也观察到666.28 处的分子离子碎片峰,与失去一个NO 分子的分子离子碎片[M-PF6--NO]+(理论值666.02)一致.以上表征结果确认了配合物1的结构.

图3 配合物1的NMR谱和质谱Fig.3 NMR and MS spectra of complex 1
此外,与[Ru(bpy)2(4-CF3ppy)]PF6相比,图4 FT-IR 谱图中观察到配合物1 在1911 cm-1处出现了一个中等强吸收峰,这归属于NO+中N—O特征伸缩振动[15-17,21-22],表明该配合物中存在RuⅡ-NO+特征结构.图4 插图为配合物1 的循环伏安图,相关数据整理在表1 中(这里配合物1 所有的电位都相对于二茂铁Fc+/0进行修正,即图示电位数据加36 mV).如图4 所示,归属于配合物1 的Ru(Ⅱ)→Ru(Ⅲ)氧化峰位出现在-0.015 VvsFc+/Fc0.与[Ru(bpy)(4-OCH3ppy)(CH3CN)NO]2+和[Ru(bpy)(ppy)(CH3CN)NO]2+分别位于-0.154 V 和-0.164 VvsFc+/Fc0的氧化峰位相比[17],可知苯环上取代基的吸电子特性明显增加了Ru(Ⅱ)的稳定性,使得配合物1 的Ru(Ⅱ)/(Ⅲ)氧化电位更高[11].值得注意的是,在-0.51~-0.91 VvsFc+/Fc0范围内,配合物1 经历了RuⅡNO+→RuⅡNO·和RuⅡNO·→RuⅡNO-的两步连续还原过程[8,23],进一步证实了结构中RuⅡ-NO+的存在.此外,正电位区0.2 V 以上的氧化峰可归因于碳阴离子配体的氧化,而发生在更负的电位上的还原峰则归属于联吡啶配体的还原.

表1 三个环金属钌亚硝酰配合物性质比较Tab.1 Comparison of properties of the three cyclometalated ruthenium nitrosyl complexes.

图4 配合物1和[Ru(bpy)2(4-CF3ppy)]PF6的FT-IR红外光谱Fig.4 FT-IR spectra of complex 1 and [Ru(bpy)2(4-CF3ppy)]PF6
2.2 理论计算
图5 列出了配合物1 的HOMO 及LUMO 轨道分布.由图5 可见:其HOMO 轨道电子云主要分布在C^N 配体上;LUMO 轨道电子云则主要分布在Ru 原子和NO 上,这也说明Ru(Ⅱ)的d轨道与NO 分子的π*分子轨道之间有很强的相互作用.表1 给出了配合物1、[Ru(bpy)(ppy)(CH3CN)NO]2+和[Ru(bpy)(4-OCH3ppy)(CH3CN)NO]2+中Ru(Ⅱ)与NO 分子间 的Ru-NO 结合能,分别为-69.30、-98.28[17]和-101.17 kcal·mol-1[17].这里,吸电子基团—CF3的引入,使Ru—NO 结合能数值明显降低,RuⅡ—NO+更容易发生断裂.因此,可以推断含吸电子基团的钌亚硝酰配合物作为NO供体,其NO释放更容易.
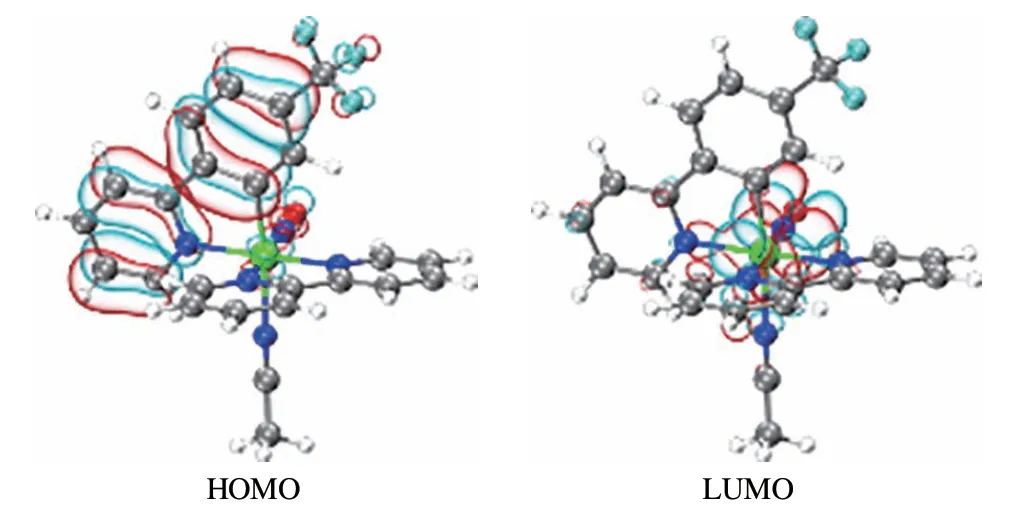
图5 配合物1的HOMO和LUMO轨道Fig.5 HOMO and LUMO orbitals of complex 1
2.3 吸收光谱及光敏NO释放
研究了配合物1的乙腈溶液在黑暗和光照下的吸收光谱(见图6).黑暗条件下,配合物在可见光区几乎没有吸收,在314 nm 附近的谱带归属于dπ(Ru)→π*(bpy)跃迁,在252 nm 和297 nm 附近的吸收带归于2-苯基吡啶和2,2′-二联吡啶的π→π*跃迁.光照后,230~300 nm 间的吸收峰强度随光照时间增加而增强(光照强度为850 mW·cm-2),该吸收谱带归属于联吡啶及C,N-配体到NO+的LLCT跃迁吸收.314 nm 附近的吸收峰强度下降的同时,430 nm 处出现新峰且峰强度随着光照时间的增加而增加,这可归属于dπ(Ru)→π*(NO)的MLCT 跃迁[23-24].以上吸收光谱的变化说明在光照条件下,配合物可能存在分子内的电子转移过程,光敏NO 释放是可能的,其光敏释放NO 的过程可用下式描述[8,17,24]:
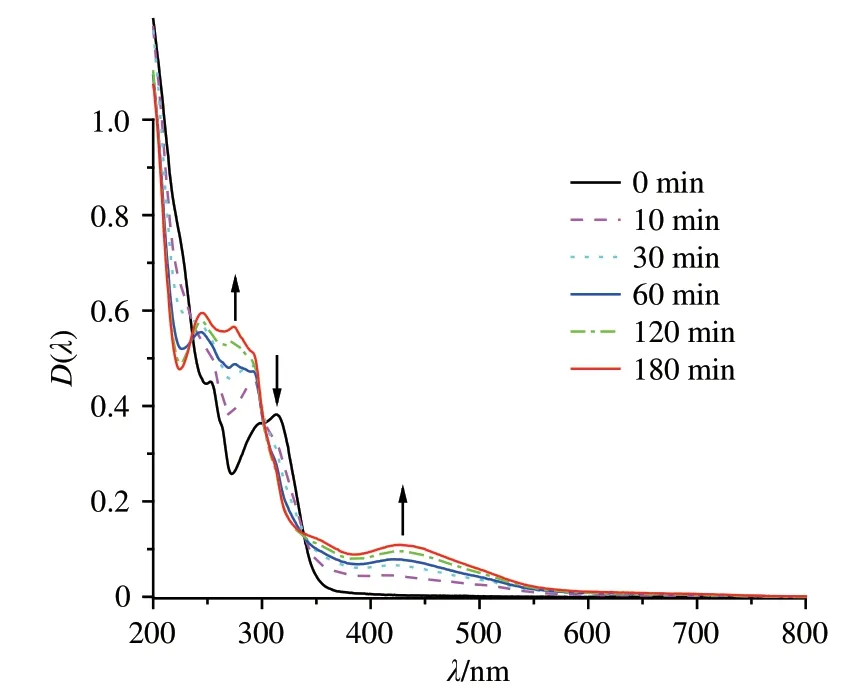
图6 配合物1的乙腈溶液(20 μmol·L-1)在氙灯照射下随时间变化的吸收光谱Fig.6 Time-dependent UV-vis absorption spectra of complex 1(20 μmol·L-1)in CH3CN under xenon lamp irradiation
(L)RuⅡ-NO++hv+solv→[(L)RuⅢ-(solv)+NO·]→RuⅡ-(solv)+NO·.
EPR 表征进一步证实了配合物1 可光敏释放NO.如图7 所示:在DMSO 中混合等摩尔量的配合物1 和NO 自由基捕获剂c-PTIO(二者浓度均为50 μmol·L-1),在黑暗条件下,EPR 中显示了c-PTIO典型的五重峰信号.氙灯照射1 h 后(光照强度为850 mW·cm-2),c-PTIO 的特征五重峰衰减并转变为属于亚氨基氮氧化物c-PTI 的特征七重峰.这可归因于配合物1在光照下产生了NO自由基,与c-PTIO发生特征还原反应,将c-PTIO还原为c-PTI[8,25-26].

图7 配合物1的EPR光谱Fig.7 EPR spectra of complex 1
基于配合物1在光照下的吸收光谱以及EPR 谱的变化,随后利用Griess 试剂测定了配合物1 和[Ru(bpy)(ppy)(CH3CN)NO]2+、[Ru(bpy)(4-OCH3ppy)(CH3CN)NO]2+的光敏NO 释放量.如表1 所示,随着光照时间的增加,所有配合物的光敏NO 释放量均增加.其中,配合物1 的光敏NO 释放量增加尤其显著.光照10 min 时,配合物1 释放的NO 量为4.23 μmol·L-1;光照60 min 时,释放NO 量则达到18.48 μmol·L-1.显然,同等条件下,配合物1 的光敏NO 释放量远大于其它两个配合物(见表1),这可从Ru-N(NO)的结合能理论计算值得到合理解释.
3 结语
合成了新的钌亚硝酰配合物[Ru(bpy)(4-CF3ppy)(CH3CN)NO](PF6)2(配合物1),NMR 及MS确认其结构,并通过IR、CV 谱图信息证实了结构中存在RuⅡ-NO+.光照下的吸收光谱以及EPR 变化表明:该配合物可光敏释放NO,其释放量通过Griess试剂测定得到.通过比较同条件下配合物1、[Ru(bpy)(ppy)(CH3CN)NO]2+和[Ru(bpy)(4-OCH3ppy)(CH3CN)NO]2+的光敏NO 释放量以及它们的Ru-NO结合能理论计算值发现,吸电子基团的引入更有利于NO 的光敏释放.这一结果为后续设计具有优良光敏NO 释放能力的钌亚硝酰配合物提供了数据支持.

