蛹虫草液体发酵培养基的响应面法优化及其抗氧化活性测定
钟鑫荣,白伟娟,周春梅,林金福,黄千慧,张维瑞,刘盛荣,魏 奇*
(1.宁德师范学院 生命科学学院,福建 宁德 352100;2.福建农林大学 食品科学学院,福建 福州 350002;3.闽东特色生物资源福建省高校工程研究中心,福建 宁德 352100;4.厦门市燕之屋丝浓食品有限公司,福建 厦门 361100)
蛹虫草(Cordyceps militaris)也称北冬虫夏草和北虫草,其蛹多为鳞翅目昆虫的蛹,草则为真菌的子实体部分,由这两部分组成的复合体即为蛹虫草.真正的蛹虫草含有虫体,没有虫体的为虫草花.蛹虫草具有益肾补阳、止血化痰、抗疲劳、改善睡眠质量等作用[1-3],其主要天然活性成分包括虫草素、虫草多糖、虫草酸、虫草甾醇、虫草多肽、凝集素、超氧岐化酶和类胰岛素蛋白等[4-6],其中,虫草多糖与超氧化物歧化酶是蛹虫草的重要活性成分,药用价值显著.已有研究表明,虫草多糖能使机体的血清免疫球蛋白抗体的含量增加,从而增强机体免疫能力和抑制肿瘤细胞的生长[7-8];虫草酸对增加免疫力和缓解心脑血管等疾病具有积极的作用[9-12];虫草素作为一类核苷酸物质,具有抑菌和抑制癌细胞生长的作用[13].
传统的发酵方法主要包括液体发酵和固体发酵.固体发酵是将微生物接种于没有或几乎没有游离水的固态基质上进行发酵,传统的固体发酵技术常应用于白酒和陈醋等产品的生产[14-16].液体发酵是指将物料首先制备成液态,再将微生物接入而产生的生物反应过程.相比于固体发酵,液体发酵具有速度快、成本低、产量高等优点[17-19].研究发现,采用液体深层发酵的方法制备的蛹虫草菌丝体具有和天然采集的蛹虫草相类似的活性物质,利用蛹虫草液体发酵技术制备蛹虫草活性物质能够缩短蛹虫草的生产周期[20].
鉴于此,本研究以蛹虫草生物量为指标,在单因素试验的基础上,通过正交试验优化蛹虫草的液体培养基组成配方,以期为食品工业化利用蛹虫草液体发酵生产蛹虫草天然活性物质提供参考.
1 材料与方法
1.1 主要材料
蛹虫草(宁德师范学院微生物室提供)、葡萄糖、蔗糖、蛋白胨、酵母粉、KH2PO4、MgSO4,以及分析纯(国药集团化学试剂有限公司).
马铃薯液体培养基:马铃薯200 g,葡萄糖20 g,水1 000 mL,121 ℃灭菌20 min;液体种子培养基:葡萄糖30 g、蛋白胨4 g、酵母粉5 g、磷酸二氢钾1 g、硫酸镁0.5 g,水1 000 mL,121 ℃灭菌20 min.灭菌后将液体种子培养基分别装入容量为250 mL三角锥形瓶中,每瓶装液100 mL.
1.2 主要仪器设备
DHG-9070A型鼓风干燥箱(上海飞越实验仪器有限公司),YP802N型电子天平(上海精密科学仪器有限公司),SW-CJ-2D 型双人净化工作台(上海博迅实业有限公司),HH-4 型恒温水浴锅(常州亿通分析仪器制造有限公司),NRY-200 型恒温培养摇床(上海南荣实验室设备有限公司),SC-3612 型低速离心机(科大创新股份有限公司).
1.3 实验方法
1.3.1 菌种扩大培养 使用接种针取适量斜面保存的菌株接种至马铃薯液体培养基,并置于28 ℃条件下恒温培养7 d.
1.3.2 种子液制备 从蛹虫草母种液体培养基中取5 mL的菌种液体,接种到装有100 mL液体种子培养基的锥形瓶中,摇床培养60 h(25 ℃,150 r·min-1),然后重新转接一次,接种量5 mL,摇床培养60 h(25 ℃,150 r·min-1).
1.3.3 培养基的优化 单因素试验:根据蛹虫草生长所需要营养条件,设定葡萄糖添加量(10、20、30、40 g·L-1),蔗糖添加量(10、20、30、40 g·L-1),蛋白胨添加量(1、3、5、7、9 g·L-1)和酵母粉添加量(1、3、5、7、9 g·L-1),以生物量为指标,先对碳源作出筛选,再对氮源进行筛选,由此获得蛹虫草最优液体培养基配方.
正交试验:在单因素试验的基础上,对葡萄糖、蔗糖和蛋白胨添加量进行3 因素3 水平正交试验,优化培养基组成.响应面因素水平见表1.

表1 响应面因素与水平表
1.3.4 生物量测定 菌丝用纱布过滤,蒸馏水清洗3 遍,然后置于55 ℃鼓风干燥箱中烘干至恒重,称量即得生物量.
1.3.5 蛹虫草对DPPH自由基的清除能力测定 参考文献[21]的方法进行测定,以水溶性维生素E为对照组.
1.3.6 蛹虫草对ABTS自由基的清除能力测定 参考文献[22]的方法进行测定,以水溶性维生素E为对照组.
1.4 数据分析
每个实验重复测定3 次,取其平均值,应用SPSS 16.0 和Design-Expert 8.0 软件对数据进行处理,并用Graphpad Prism 9作图.
2 实验结果与分析
2.1 不同碳源对蛹虫草生物量的影响
由图1 可知,蛹虫草生物量随着碳源(蔗糖或葡糖糖)添加量的增加,呈现出先增加后减少的趋势.当碳源的添加量为20 g·L-1时,蛹虫草生物量达到最大值;当碳源添加量大于20 g·L-1时,蛹虫草生物量呈现下降的趋势.当2种碳源添加量相同时,蔗糖液体培养基所获得的蛹虫草生物量高于葡萄糖液体培养基所获得的蛹虫草生物量.由此可见,蔗糖液体培养基更适合蛹虫草菌丝体生长.故选定蔗糖作为蛹虫草液体发酵培养基的碳源,最佳添加量为20 g·L-1.

图1 不同碳源添加量对蛹虫草生物量的影响
2.2 蛋白胨添加量对蛹虫草生物量的影响
如图2所示,随着蛋白胨添加量的升高,蛹虫草生物量逐渐增加,当添加量为7 g·L-1时,蛹虫草生物量显著增加(P<0.05),其生物量达最大值(2.45 g);随后,随着蛋白胨添加量的增加,蛹虫草生物量呈现出缓慢下降的趋势,当添加量为9 g·L-1时,蛹虫草生物量与添加量为7 g·L-1时蛹虫草生物量不具有统计学意义(P>0.05),此时继续增加蛋白胨无法提高蛹虫草的生物量.故选定蛋白胨最佳添加量为7 g·L-1.
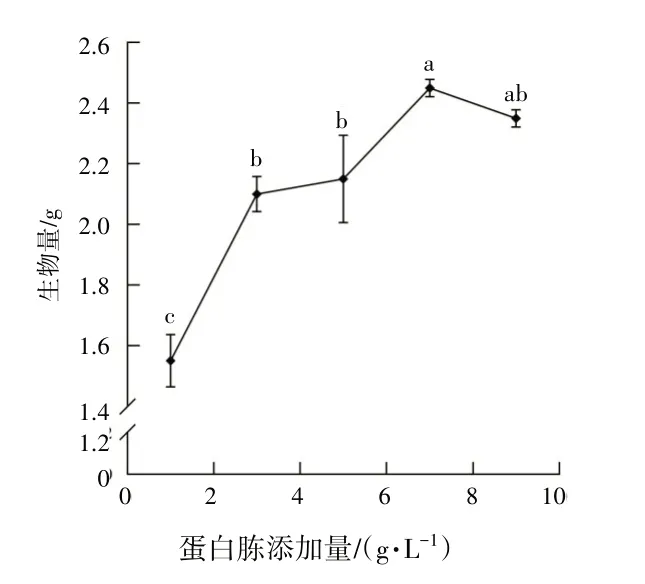
图2 蛋白胨添加量对蛹虫草生物量的影响
2.3 酵母粉添加量对蛹虫草的影响
由图3可知,当酵母粉添加量小于3 g·L-1时,随着酵母粉添加量的增加,蛹虫草生物量显著增加(P<0.05),在添加量为3 g·L-1时,生物量达到最大值(2.13 g);而当酵母粉添加量大于3 g·L-1时,随着酵母粉添加量的增加蛹虫草生物量逐渐减少.因此,选定酵母粉最佳添加量为3 g·L-1.
2.4 响应面试验结果
表2 为试验设计优化后的结果.应用Design Expert 8.0 对数据进行回归分析,由此获得由蔗糖(A)、蛋白胨(B)和酵母粉(C)对蛹虫草生物量的回归方程:Y(生物量)=2.53+0.0887A+0.1137B-0.0125C-0.0775AB-0.065AC+0.025BC-0.1652A2-0.1302B2-0.1427C2.

表2 试验设计及结果
由表3可知,Y(生物量)的回归模型的F=28.91且P=0.000 1<0.05,说明该模型具有显著的线性关系.失拟性P=0.075 2>0.05,不存在显著性差异,说明该方程具有良好的拟和性.由此可见,此验证方法可靠,该模型可用于预测蛹虫草液体发酵培养基配方的优化.对蔗糖添加量和酵母粉添加量,蔗糖添加量和蛋白胨添加量之间的显著性分析表明:AB 和AC 的P值均小于0.05,说明蔗糖添加量和酵母粉添加量,蔗糖添加量和蛋白胨添加量对蛹虫草生物量具有显著影响;BC项P>0.05,说明酵母粉添加量和蛋白胨添加量之间对蛹虫草生物量的影响不显著.

表3 方差分析表
如图4A所示,蔗糖添加量和蛋白胨添加量较小时,蛹虫草生物量较小.蛹虫草生物量随着蔗糖添加量和蛋白胨添加量的增加而增加,蔗糖添加量和蛋白胨添加量之间的交互作用能够显著影响蛹虫草的生物量(P<0.05).此时等高线图呈现为椭圆形,表明蔗糖添加量和蛋白胨添加量这两个因素的交互作用明显(图4a).

图4 两因素交互作用对蛹虫草生物量的响应面图及等高图
当蛋白胨添加量一定时,酵母粉添加量和蔗糖添加量对蛹虫草生物量的影响结果如图4B 所示.酵母粉添加量固定时,随着蔗糖添加量的增加,蛹虫草生物量先增加然后降低;蔗糖添加量固定时,增加酵母粉添加量,蛹虫草生物量先增加然后减少.酵母粉添加量和蔗糖添加量的交互作用对蛹虫草生物量存在显著性影响(P<0.05),并且等高图为椭圆形,说明酵母粉添加量和蔗糖添加量这两个因素对蛹虫草生物量的交互作用明显(图4b).
由图4C 可知,当酵母粉添加量固定时,蛹虫草生物量随着蛋白胨添加量的增加呈现出先增加然后减少的趋势.如图4c 所示,等高线形状为圆形由此表明蛋白胨添加量和酵母粉添加量之间的交互作用不显著(P>0.05).故最优的配方为:蔗糖32 g·L-1、蛋白胨6 g·L-1、酵母粉4 g·L-1、硫酸镁0.5 g·L-1、磷酸二氢钾1.0 g·L-1,在此条件下,蛹虫草生物量为2.41 g,接近理论值(2.37 g),说明优化结果可靠.
2.5 蛹虫草的抗氧化活性分析
2.5.1 蛹虫草清除DPPH 自由基能力的测定 由图5 可知,随着蛹虫草菌丝体浓度的增加,蛹虫草对DPPH 自由基的清除率也随之增加,并且呈现出量效关系.当浓度为0.4 mg·mL-1时,蛹虫草菌丝体对DPPH 自由基的清除率为25.86%;当浓度为2.0 mg·mL-1时,蛹虫草菌丝体对DPPH 自由基的清除率最大(82.88%),显著高于其他处理组(P<0.05).当浓度为0.4 mg·mL-1时,水溶性维生素E 对DPPH 自由基的清除率为94.17%.由此可知,在相同浓度条件下,水溶性维生素E 对DPPH 自由基的清除作用强于蛹虫草菌丝体.
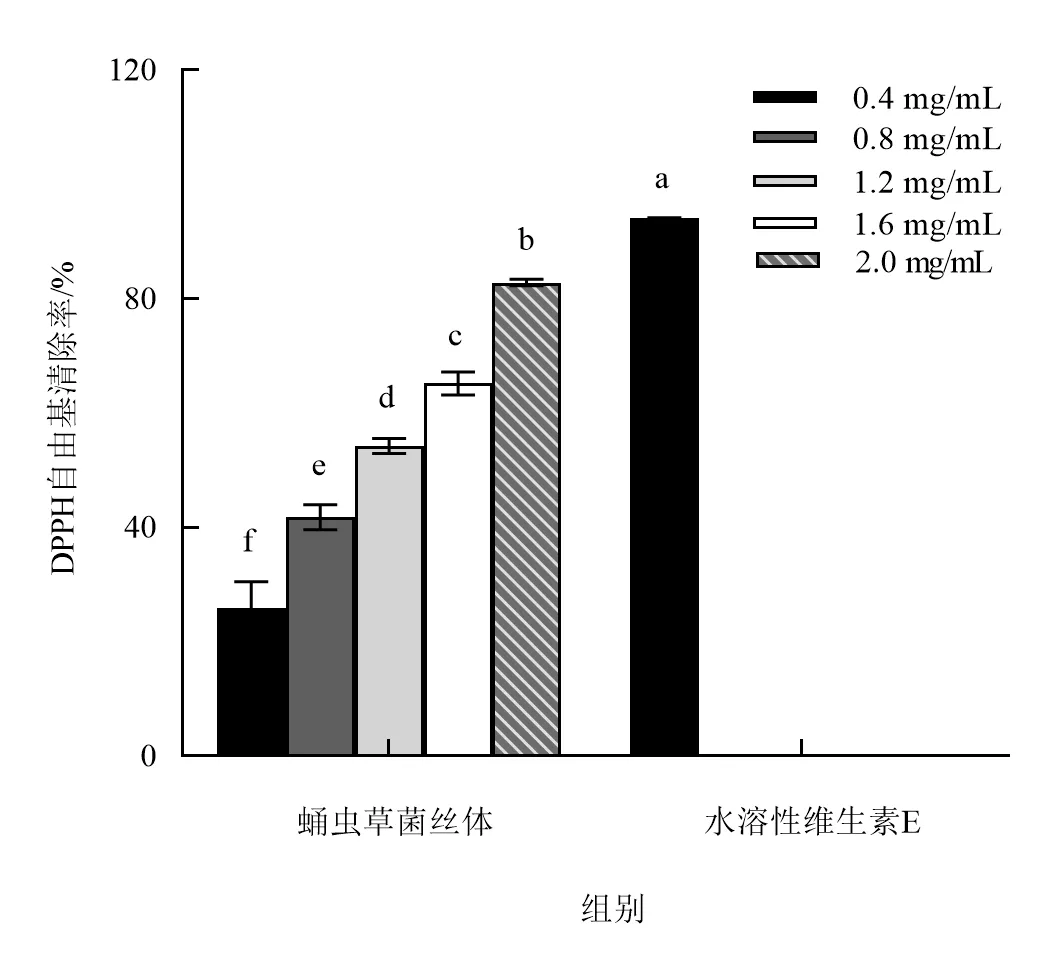
图5 蛹虫草对DPPH 自由基的清除能力
2.5.2 蛹虫草清除ABTS自由基能力的测定 由图6所示,蛹虫草菌丝体对ABTS自由基具有清除能力,当蛹虫草菌丝体浓度为0.4~2.4 mg·mL-1时,ABTS 自由基清除率与蛹虫草菌丝体浓度呈现一定的量效关系,蛹虫草菌丝体对ABTS 自由基清除率随着蛹虫草浓度的升高而增强.当浓度为2.4 mg·mL-1时,ABTS 清除率为77.48%,说明蛹虫草菌丝体具有体外清除ABTS 自由基的能力.当浓度为0.4 mg·mL-1时,水溶性维生素E 对ABTS 自由基的清除率为94.90%.由此可知,在相同浓度的条件下,水溶性维生素E对ABTS自由基的清除作用强于蛹虫草菌丝体.
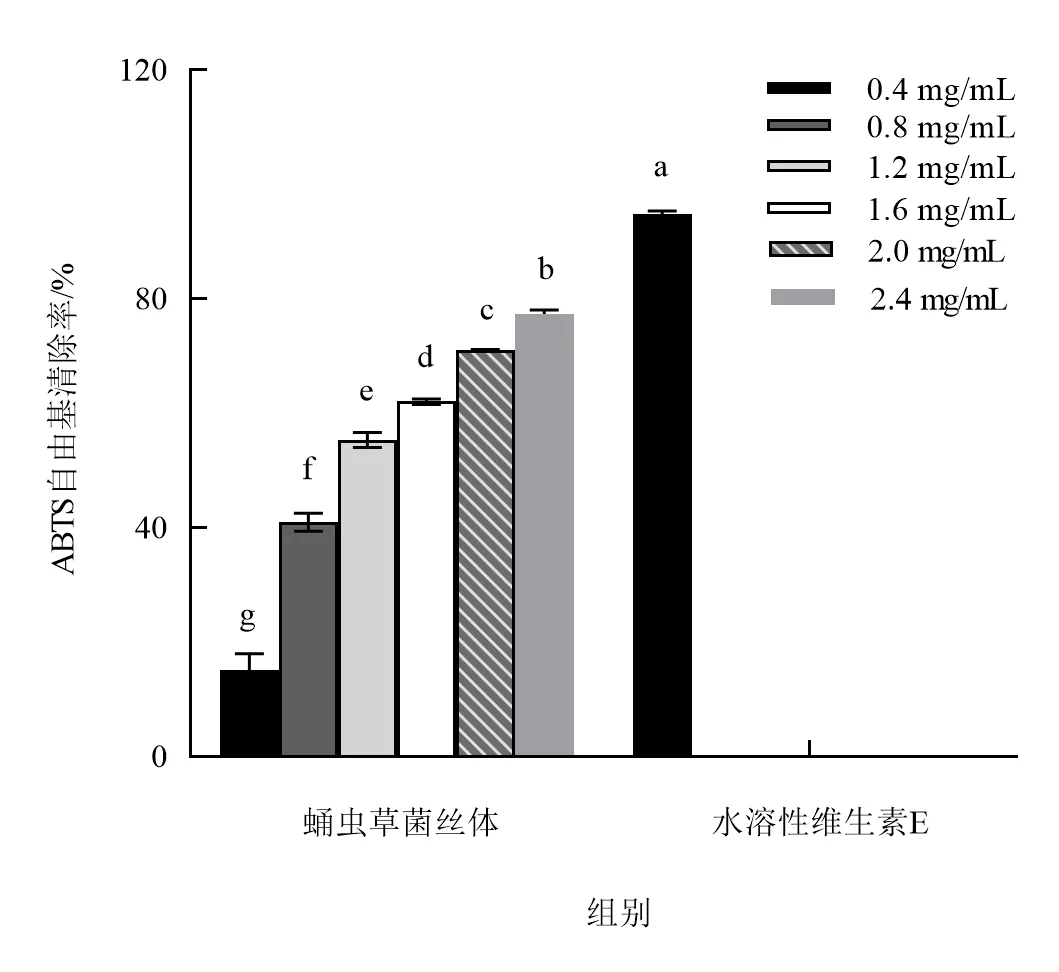
图6 蛹虫草对ABTS 自由基的清除能力
3 讨论与结论
人工种植蛹虫草因周期长、技术难度大,不利于大规模生产及应用开发,而采用液体发酵培养获得蛹虫草菌丝体,具有节约成本、生长周期短和操作技术简单等优点,有利于大规模制备蛹虫草的天然活性物质.杨爽等[23]研究发现,通过优化蛹虫草液体发酵条件,能够提高醇溶蛋白的必需氨基酸含量;周广乙等[24]研究发现,蔗糖可以作为蛹虫草液体培养基的碳源,增加蛹虫草生物量的产率.本研究以蔗糖添加量、酵母粉添加量和蛋白胨添加量为变量,以蛹虫草生物量为指标,通过响应面设计优化得到蛹虫草液体发酵培养基的最为配方为蔗糖32 g·L-1、蛋白胨6 g·L-1、酵母粉4 g·L-1、硫酸镁0.5 g·L-1、磷酸二氢钾1.0 g·L-1,此最佳配方的蛹虫草生物量为2.41 g,接近预测值(2.37 g).该研究结果与秦鹏等[25]关于蛹虫草生物量(2.57 g)的研究结果相近.
郭笑等[26]研究发现,蛹虫草子实体中分离得到的脑苷脂类单体能够增加氧化损伤细胞中的超氧化物歧化酶含量,并且能够有效降低其丙二醛含量.由此可知,蛹虫草具有体外抗氧化作用.郭静科等[27]研究发现,蛹虫草子实体粉末和菌丝体粉末对DPPH 和氧自由基具有清除作用,这可能是因为蛹虫草中的虫草素和虫草多糖等物质具有抗氧化活性有关.该研究结果与本研究关于蛹虫草菌丝体的研究结果相一致,证实了蛹虫草菌丝体对DPPH 自由基具有体外清除作用.本研究发现蛹虫草菌丝体具有出一定的体外抗氧化活性,蛹虫草菌丝体能够有效清除DPPH 和ABTS 自由基的作用.本研究可为蛹虫草功能性产品的开发利用及抗氧化评价提供理论研究基础,对蛹虫草资源的利用具有参考意义.

