不同转染方法应用于体细胞转基因效率的研究
赵广伟,杨小玲,张孟奇,苏勤智,陈 凤*
(1.河南牧业经济学院 动物科技学院,河南 郑州 450046;2.中山大学附属第七医院 消化医学中心,广东 深圳518107)
采用基因转染技术将目的基因片段导入到受体细胞中,是探索基因功能、生产基因编辑动物等重要的技术环节。高效的基因转染效率与转染方法和所转染的供体细胞密切相关,适宜的转染方法和恰当的供体细胞对提高基因转染效率具有重要意义。增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)常用作报告基因来反映转染效率的高低[1]。目前报道用于导入外源基因的转染方法包括磷酸钙法、脂质体法、病毒载体法、电穿孔法、显微注射法和罗氏转染试剂等[2-3],这些方法都有各自的优点和局限性,其中应用最为广泛的是具有用时短、操作容易、适用范围广特性的脂质体、罗氏转染试剂和电穿孔法。
基因编辑猪的生产具有重要的研究价值,可用于人源化器官培养、器官移植和人类疾病模型等生物医学领域中[4]。广西巴马小型猪不仅在生理结构、新陈代谢和解剖学等方面与人类相近,而且其体型矮小更便于试验操作,被认为是生物医学研究领域的理想的模型动物[5]。猪体细胞克隆基因编辑手段是医学模型研发中的主要工具之一,通常易获得且培养和操作简单的猪成纤维细胞(porcine fetal fibroblasts,PFFs),被用作基因编辑猪的供体细胞。另外,研究显示间充质干细胞(mesenchymal stem cells,MSCs)具有易于导入和稳定高效表达外源基因的优点[6-7]。多项研究已证实MSCs作为供体细胞用于核移植以形成重构胚时,其囊胚率和克隆后代的出生率均明显高于PFFs[8-9]。考虑到转染方法对不同细胞的转染效果影响较大,因此在实验室以往研究的基础上[10],本研究选取EGFP作为报告基因,通过比较分析脂质体、罗氏转染试剂和电穿孔法转染PFFs、脂肪干细胞(adipose-derived stem cells,ADSCs)和骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的效果,以期筛选更优的转染方法和供体细胞,为生产基因编辑巴马小型猪奠定试验基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂 选取来自广西大学扶绥实验基地的广西巴马小型猪的骨髓、脂肪和耳源组织;pEGFP-N1质粒载体(4.7 kb)购自北京启研生物有限公司;电转核转染液购自碧云天生物公司;去内毒素质粒提取试剂盒来源于Qiagen公司;胶原酶购自Sigma公司;Lipofectamine TM 2 000脂质体转染试剂盒和罗氏X-tremeGENE HP DNA 转染试剂分别购自Invitrogen公司和Roche公司;高糖DMEM培养基、Opti-MEM培养基购自Gibco公司,胎牛血清(FBS,OriCell)购自广州赛业、0.25%胰蛋白酶-EDTA购自碧云天。
1.2 方法
1.2.1 质粒提取 将保存在-80 ℃冰箱中的载体菌种取出置于冰上,取10 μL接种到含有氨苄青霉素抗性的10 mL液体LB培养基中,放置在37 ℃、200 r/min 条件下的震荡培养8~12 h。然后按照1∶1000的比例取相应量活化后的载体菌液转接到液体LB培养基中,在相同条件下继续震荡培养8~12 h后按照Qiagen去内毒素的质粒大提试剂盒说明书进行质粒提取,最后采用分光光度计测定质粒浓度,放置在-20 ℃冰箱中保存备用。
1.2.2 细胞分离培养 参照实验室已报道的细胞培养方法[5,11],分别采用胶原酶消化法、骨髓抽取法和组织块贴壁法获得ADSCs、BMSCs和PFFs的原代细胞。采用细胞完全培养液(高糖DMEM培养基+10%FBS+1%双抗)在细胞生长到80%~90%汇合度时进行传代培养。选取P3~P4的体细胞汇合度为70%~80%进行后续转染试验。
1.2.3 电穿孔法转染 胰酶消化后,离心收集各备转细胞加入少量培养液进行重悬,经细胞计数后将密度调整为每毫升106个细胞。离心弃上清后加入200 μL核转染液,混匀后再向其中加入6 μg pEGFP-N1质粒,于室温静置5 min,最后将混合物转移至2 mm电击杯中。电转参数参照本实验室前期摸索的条件,设定为:180 v、10 ms、2 mm、1次电击[10-11]。电击完成后将细胞转移到培养皿中,12 h后更换为完全培养液继续培养36~48 h。
1.2.4 罗氏转染 转染开始前先将细胞的培养液换成不含双抗的细胞正常培养液,然后按照X-tremeGENE HP DNA 试剂盒说明书进行转染液的配制。6孔板细胞的转染液用量和配制过程为:在500 μL DMEM培养基中加入3.0 μg pEGFP-N1质粒DNA和9 μL转染试剂(质量体积比为1∶3),混匀后室温静置30 min,最后将转染复合物逐滴加入到细胞培养液中,轻轻摇晃混匀后放入培养箱中培养36~48 h。
1.2.5 脂质体转染 转染开始前先将培养液更换为Opti-MEM转染培养基,按照LipofectamineTM2 000转染试剂盒的说明书配制6孔板培养细胞的转染液,其中液体Ⅰ组分为2.0 μg pEGFP-N1质粒DNA和250 μL Opti-MEM转染培养基,液体Ⅱ组分为10 μL Lipofectamine TM 2 000 试剂和250 μL Opti-MEM培养基。液体Ⅰ和Ⅱ配制后各自于室温下静置5 min后混合在一起,混匀后于室温静置20 min。最后将混合液轻轻逐滴加到待转细胞培养液中,轻微摇晃混匀后继续培养6 h,之后更换成细胞完全培养液继续培养42 h。
1.2.6 细胞存活率分析 细胞转染过程中将未进行转染的供体细胞作为对照组,并经过细胞计数后确保各孔细胞接种时的数量一致。在转染48 h时,用胰酶消化收集各组细胞,流式分析前先取少量细胞进行台盼蓝染色,再用血细胞计数板进行计数。细胞相对存活率即为各转染组与相同细胞未转染对照组活细胞数量的比值。
1.2.7 转染效率的检测 各组细胞在转染48 h后通过倒置荧光显微镜观察EGFP的表达情况,并拍照记录。胰酶消化收集各组细胞,用PBS进行重悬,流式细胞仪检测表达绿色荧光细胞的比例。基于对照组的自发荧光水平来设置门控条件标准,对比分析不同转染方法和不同来源细胞条件下的细胞转染效率。
1.2.8 统计学分析 细胞相对存活率和转染效率数据用平均数(Mean)±标准差(SD)来表示,试验重复3次。试验采用SPSS26.0统计软件对数据进行单因素ANOVA检验,以P<0.05表示有统计差异,以P<0.01表示差异显著,P<0.001表示差异极显著。
2 结 果
2.1 细胞原代分离培养
3种体细胞的原代分离培养结果如图1所示。脂肪组织块经胶原酶消化后进行培养,第5天培养皿底有部分呈成纤维样的细胞贴壁生长(图1A);骨髓抽取后接种到培养皿中,24 h后观察到少许未伸展开的细胞在皿底贴壁生长(图1B);耳缘组织采用经典的组织块贴壁法进行分离培养,第6天组织块周围有大量细胞往外生长、延伸,形状呈典型的梭状(图1C)。
2.2 细胞转染效果观察
电穿孔法、脂质体和罗氏转染试剂介导EGFP基因转染猪ADSCs、BMSCs和PFFs 48 h后,在荧光显微镜下可观察到不同程度的绿色荧光表达(图2),初步表明不同的方法转染猪不同体细胞效果不同。

图2 EGFP在转染48 h的表达情况
2.3 流式分析细胞转染效率
3种方法转染细胞48 h后进行流式分析,结果表明(图3),转染效率从高到低依次为电穿孔法>罗氏转染试剂>脂质体,电穿孔法在ADSCs和BMSCs的转染效率高达80%,转染PFFs的效率也大于60%,明显高于罗氏转染试剂和脂质体在相同细胞中的转染效率(P<0.001)。此外,罗氏转染试剂的转染效率(约20%)也显著高于脂质体(约10%)(P<0.01)。

图3 不同方法转染体细胞的效率比较
相同方法转染不同体细胞的比较见图4。由图4可见,采用罗氏和脂质体试剂分别转染ADSCs、BMSCs和PFFs的效率无显著性差异(P>0.05),而电穿孔法转染MSCs的效率均显著高于PFFs(P<0.01),但ADSCs和BMSCs间差异不显著(P>0.05)。
2.4 细胞存活率分析
3种体细胞采用不同方法进行转染后的细胞存活率情况如图5所示。由图5可见,从高到低依次为罗氏转染试剂>脂质体>电穿孔法,使用罗氏和脂质体转染后的细胞存活率未见显著性差异(P>0.05),但二者均显著高于采用电穿孔法转染后的细胞存活率(P<0.001)。
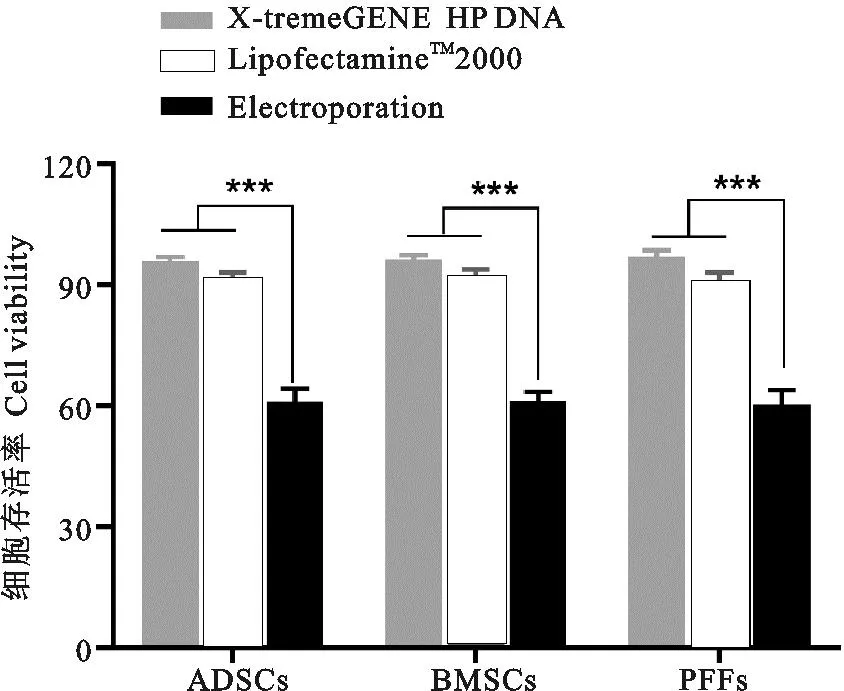
图5 不同方法转染相同体细胞的细胞存活率比较
采用同样方法转染猪不同体细胞的细胞存活率比较如图6所示。由图6可见,罗氏和脂质体试剂转染3种体细胞的细胞存活率均在90%左右,而电穿孔法转染3种体细胞的细胞存活率约为60%,3种体细胞在使用相同方法进行转染后的细胞存活率差异不显著(P>0.05)。

图6 相同方法转染不同体细胞的细胞存活率比较
3 讨 论
基因转染方法和供体细胞类型的选择是外源基因最终能否获得稳定高效表达的关键。不同来源的细胞因其生长特性不同,因此接受外源DNA的能力是不相同的。选取适宜的转染方法将含有目的基因的片段导入到供体细胞中,并在其中高效、稳定的表达是生产基因编辑动物过程的关键环节。本研究选用在体细胞克隆中常用的MSCs和PFFs作为供体细胞,利用实验室前期优化的电穿孔转染程序以及商品化的脂质体和罗氏试剂,将pEGFP-N1载体分别转染上述细胞,系统地比较不同方法和不同细胞条件转染后的细胞相对存活率和转染效率,为进一步的稳定转染、筛选基因编辑阳性细胞用于基因编辑克隆猪的生产奠定基础。
研究者通过优化胶原酶类型(Ⅰ型、Ⅱ型、混合型)浓度(0.075%~0.2%)和作用时间(0.5~2.5 h),建立从脂肪组织获取ADSCs的方法。BMSCs的分离培养常常使用密度梯度离心法、细胞贴壁法和免疫磁珠法等。而采用抽取骨髓液置于皿内进行细胞贴壁培养的方法分离获取BMSCs,不仅过程简单易操作,而且不易受到污染。本研究分别采用经过证实且具有良好效果的胶原酶消化法、骨髓抽取法和组织块贴壁法分别进行原代细胞分离培养,成功获得了具备典型形态特征的 ADSCs、BMSCs 和 PFFs[11],它们传至P5仍具有较快的增殖速度和良好的细胞形态,可用于转染试验。本研究结果显示,3种转染方法均可实现外源基因EGFP在ADSCs、BMSCs和PFFs的表达。其中,电穿孔法转染猪体细胞的效率最高,但其细胞相对存活率低于其他两种方法。前期研究结果显示,电穿孔转染中电压的大小对细胞损伤和存活率影响最大,相对较高的电压会提高转染效率,但细胞的存活率随着转染效率的升高而降低[12]。另一项研究认为,使细胞的存活率在50%左右时的电转染参数获得的转染效率最佳[13]。本研究采用电穿孔法转染猪三种体细胞后的存活率均在60%左右,转染效率在60%~80%之间(MSCs转染效果最好),高于其他研究采用优化后的电穿孔法转染成纤维细胞取得的转染效率[14]。这可能与本研究中使用的核转染体系有关,通过专门悬浮液配方和针对性的电场脉冲指数有效提高了转染效率。本研究中,电穿孔转染MSCs的效率高于PFFs,猜测可能与早期MSCs处于未分化、具备较好的细胞生长状态以及适用的转染参数等因素相关。目前,已有许多研究使用低细胞毒性的商业转染试剂,但对它们转染效果的评价却不尽相同。本试验结果表明,罗氏和脂质体试剂转染细胞的毒性均较低,罗氏转染试剂在三种体细胞的转染效率均比脂质体高出一倍,类似于之前多个文献报道的结果[15-16]。本试验脂质体法转染猪体细胞的转染效率低于另一篇文献的报道,采用优化后的脂质体转染体系在PFFs中获得了20%左右的转染效率[17],这种差异可能与多种因素有关。研究认为,基因转染的过程会受到许多不确定的因素影响,如细胞的生长状态、质粒片段的长度与纯度、质粒与转染试剂比例、细胞接触转染液的时间等[15,18]。因此,对不同来源的细胞进行基因转染操作时,应尽可能先优化这些因素,以提高转染效果。
综上所述,脂质体转染虽然对细胞存活率的影响不显著,但获得的转染效率较低,因此不建议采用脂质体试剂转染猪体细胞。而电穿孔法的应用范围更广,对于商品化试剂难以转染的间充质干细胞,也能获得较高的转染效率,综合考虑该方法对转染后细胞的存活有损伤,建议对于生长状态较好的猪体细胞可采用经过优化的电穿孔法进行转染。

