人工培养窖泥中微生物菌群多样性解析
杨少勇,贺子豪,李 娜,郭 壮,王玉荣*
(1.湖北文理学院 湖北省食品配料工程技术研究中心,湖北 襄阳 441053;2.酿造微生物研究与应用襄阳市重点实验室,湖北 襄阳 441053)
浓香型白酒是中国十二大香型白酒之一,其生产工艺一般采用固态发酵[1]。在生产过程中最主要的发酵设备是窖池,窖池的质量与白酒的品质息息相关,而窖池的好坏本质上在于窖泥的品质[2]。窖泥本身是新鲜的土壤,在长期发酵过程中形成了一个独特的微生物群落[3]。在窖池中,微生物以窖泥为载体,酒醅为营养物质,在生长繁殖时代谢出各种影响白酒品质的风味物质或风味前体物质[4]。然而,新建窖池一般至少经过20年的自然成熟期才能产出优质的白酒,这导致自然成熟窖泥的数量无法满足白酒行业的快速发展[5]。因此,研究人员利用现代微生物技术培养出人工窖泥,大大缩短了窖泥自然成熟的时间。
人工窖泥的传统培养方法是研究人员将发酵剂接种到按比例混合的新鲜土壤、自然成熟窖泥、豆粕和小麦的混合物中,然后在厌氧条件下培养30~60 d[6]。MU Y等[7]研究发现,在人工窖泥中添加强化大曲可以改变其原核微生物群落,从而提升人工窖泥的风味品质。鲁少文等[8]在人工窖泥中添加前期研究发现的新型己酸菌可以大大缩短窖泥自然成熟的时间。
目前,对人工窖泥品质提升的研究较为深入,但关于人工窖泥中微生物群落结构的研究报道较少。本研究利用Illumina MiSeq高通量测序技术对采集自湖北省襄阳市的人工窖泥中微生物菌群多样性及群落结构进行解析,以此探究人工窖泥中微生物群落组成,以期为人工窖泥培养方法的改良以及品质的提升提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
人工窖泥:于2022年10月在湖北省襄阳市某酒厂采集,共3份,编号为XF1~XF3。3份人工窖泥均由该酒厂自制:用含沙量低、粘性强、无污染的黄土做载体,辅以优质曲粉,高蛋白、高能量的农副产品以及优良醅糟、复合功能菌液、黄水和酒尾等原料,于温度、水分、pH值等适宜的窖泥培养池中厌氧培养,采集的样品均已厌氧培养50 d左右,采集后装入无菌袋中迅速运回至实验室,置于-40 ℃保存备用。
1.1.2 试剂
E.Z.N.ATM Mag-Bind Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国Omega Bio-Tek公司;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)、DNA聚合酶(5 U/μL)、2×聚合酶链式反应(polymerase chain reaction,PCR)mix:上海桑尼生物科技有限公司;引物338F/806R、ITS3F/ITS4R:武汉天一辉远生物科技有限公司;DNA Marker、10倍缓冲液:青岛蔚来生物科技有限公司。
1.2 仪器与设备
Illumina MiSeq高通量测序平台:美国Illumina公司;TG16MW微量高速冷冻离心机:湖南赫西仪器装备有限公司;Vortex-2旋涡混匀仪:上海沪析实业有限公司;FluorChem HD2化学发光凝胶成像系统:普诺森生物科技(上海)有限公司;ND-2000C微量紫外分光光度计:美国Nano Drop公司;R930机架式服务器:美国DELL公司;S1000梯度PCR仪:美国Bio-Rad公司。
1.3 试验方法
1.3.1 人工窖泥样品微生物菌群总基因组DNA的提取
称取2.0 g混匀的人工窖泥样品,按照基因组DNA提取试剂盒说明书对3份人工窖泥样品的基因组DNA进行提取[9],经1.0%琼脂糖凝胶电泳检验DNA的完整性和纯度,检验合格并测定其浓度,置于-40 ℃储存备用。
1.3.2 人工窖泥样品微生物菌群PCR扩增及Illumina MiSeq高通量测序
以检验合格总基因组DNA为模板,使用带有细菌特异性核苷酸标签的引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对细菌16S rDNA的V3-V4区基因序列进行PCR扩增,PCR扩增反应体系和扩增程序参照周文等[10]的方法进行;使用带有真菌特异性核苷酸标签的引物ITS3F(5'-GCATCGATGAAGAACGCAGC-3')和ITS4R(5'-TCCTCC-GCTTATTGATATGC-3')对真菌ITS区基因序列进行PCR扩增,PCR扩增反应体系和扩增程序参照李斌等[11]的方法进行。合格的PCR扩增产物委托上海美吉生物技术有限公司的Illumina MiSeq平台进行第二代高通量测序。
1.3.3 下机数据处理及生物信息学分析
测序返回的原始下机数据经过校正、拼接和质控等优化处理后得到合格的序列[12]。再经去除嵌合体序列后,得到优质序列。将优质序列上传至QIIME(v1.7.1)平台进行微生物多样性评价。采用UPARSE软件对优质序列以97%的相似度划分并创建操作分类单元(operational taxonomic units,OTU),选取具有代表性的OTU优质序列在GREENGENE数据库[13]和核糖体数据库项目(ribosomal database project,RDP)数据库[14]中对细菌和真菌序列进行物种分类和注释,并对人工窖泥样品中微生物菌群多样性进行计算。
1.3.4 数据处理
通过R软件(v4.1.1)绘制韦恩图,通过绘图网站(http://www.cloudtutu.com)绘制人工窖泥样品中优势菌门的物种丰度星图和优势菌属的环状热图,使用R软件(v4.1.1)的corrplot包绘制样品中优势菌属的相关性热图,其他可视化分析图均由软件Origin 2018绘制。
2 结果与分析
2.1 人工窖泥样品微生物菌群的多样性分析
对3份人工窖泥样品的细菌和真菌共277 849条和163 359条原始下机序列进行质控,平均每份样品包含92 614条细菌有效序列和54 453条真菌有效序列。在97%的相似度下划分优质序列,共获得12 128个细菌OTU和1 034个真菌OTU。人工窖泥样品中细菌和真菌的稀疏曲线见图1。

图1 人工窖泥样品中细菌(a)和真菌(b)菌群的稀疏曲线Fig.1 Rarefaction curve of bacterial (a) and fungal (b) communities in artificial pit mud samples
由图1可知,随着测序深度的增加,样品中OTU的数量逐渐趋于饱和,只有少量新的OTU产生,说明样品的测序量和深度合理,能够真实的反映样品中微生物多样性,满足后续分析的要求。由图1亦可知,在同一测序深度下,XF2样品的细菌菌群多样性较其他样品高,真菌菌群多样性较其他样品低。
为进一步探究样品间微生物菌群的相似性和差异性,基于OTU水平对人工窖泥样品的微生物进行韦恩图分析,结果见图2。
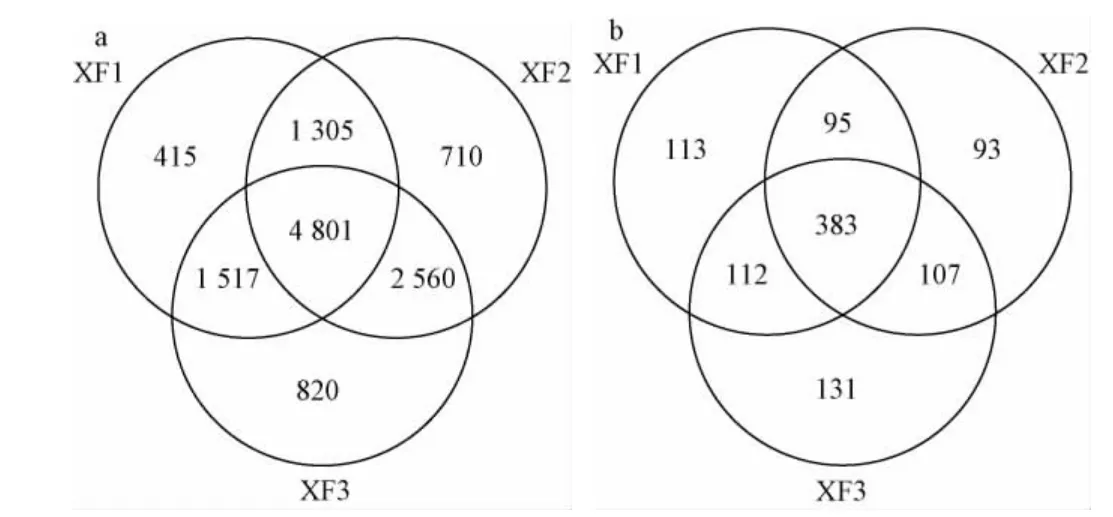
图2 基于操作分类单元水平人工窖泥样品中细菌(a)和真菌(b)的韦恩图Fig.2 Venn diagram of bacteria (a) and fungi (b) in artificial pit mud samples based on operational taxonomic unit level
由图2可知,在细菌OTU水平上,XF1、XF2和XF3样品中分别划分出8 038、9 376和9 698个OTU,其中共有OTU为4 801个,占细菌总OTU数的17.71%;在真菌OTU水平上,XF1、XF2和XF3样品中分别划分出703、678和733个OTU,其中共有OTU数为383个,占真菌总OTU数的18.12%。由此可见,人工窖泥中微生物菌群组成较为丰富且存在一定的共有菌群。除此之外,各样品中还包含有数量不等的细菌、真菌OTU序列,表明不同人工窖泥样品的菌群组成亦存在一定的特异性。
2.2 人工窖泥样品微生物群落结构组成分析
在对人工窖泥微生物菌群多样性分析的基础上,进一步对优质序列进行物种分类和注释,在门和属水平上共注释到14个细菌门和343个细菌属,13个真菌门和106个真菌属。将平均相对丰度>1.0%的菌门或属定义为优势菌门或优势菌属,将其他已知但平均相对丰度<1.0%的门或属归类为“others”,将未知物种归类为“unclassified”。基于门水平,人工窖泥样品中细菌和真菌菌群的结构组成见图3。
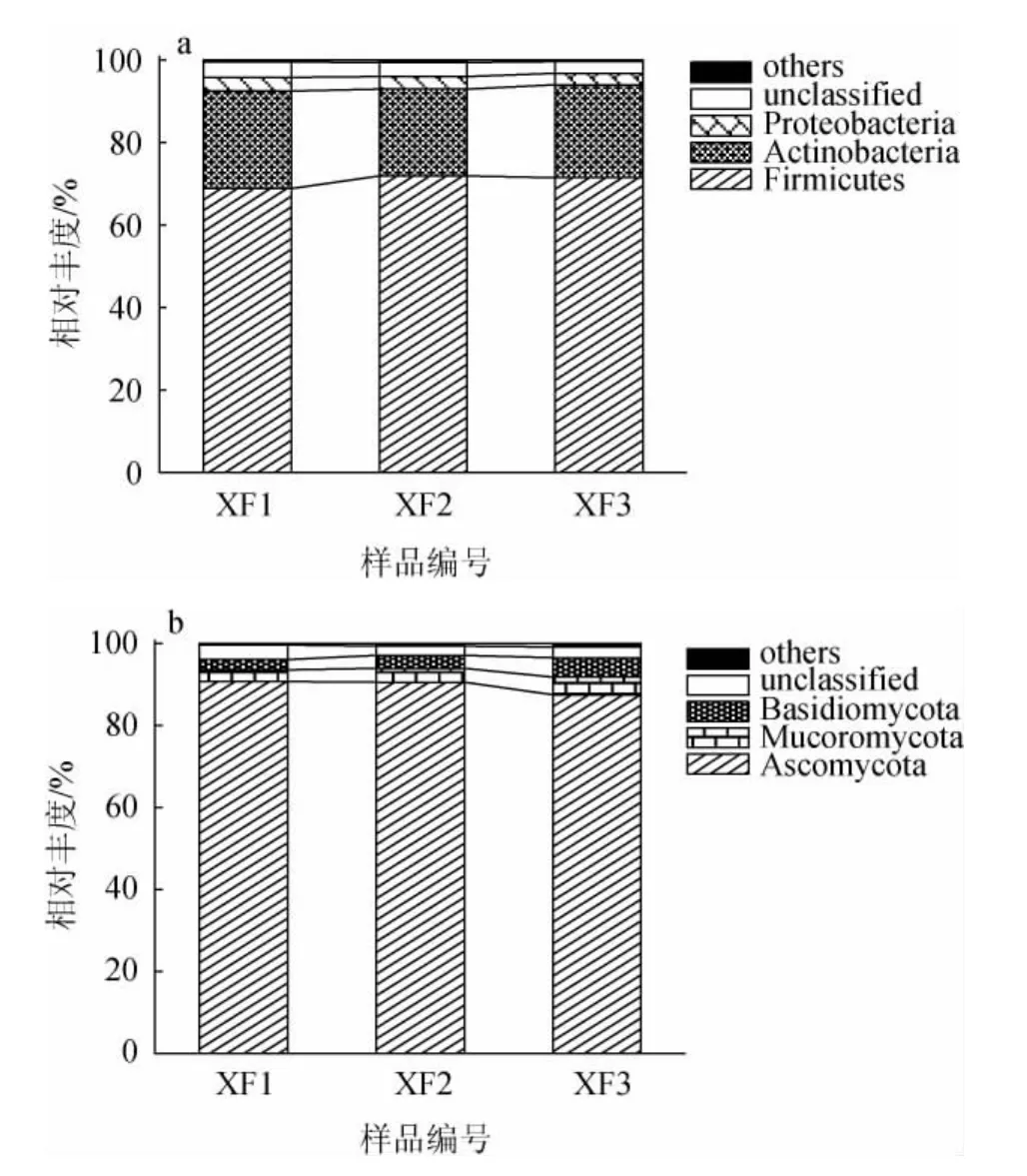
图3 基于门水平人工窖泥样品中细菌(a)和真菌(b)菌群结构Fig.3 Structure of bacterial (a) and fungal (b) communities in artificial pit mud samples based on phylum level
由图3a可知,在注释到的14个细菌门中,厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)的平均相对丰度分别为70.69%、22.41%和3.04%,是人工窖泥样品中的优势细菌门。LIANG H等[15]运用PCR-变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)技术分析发现,Firmicutes、Actinobacteria和Proteobacteria在老窖泥和新窖泥两种类型的窖泥中占优势,与本研究的结果较为相似,说明在细菌门水平上,人工窖泥和正常窖泥的细菌群落结构有一定的相似性。由图3b可知,在注释到的35个真菌门中,子囊菌门(Ascomycota)(89.60%)、毛霉菌门(Mucoromycota)(3.52%)和担子菌门(Basidiomycota)(3.48%)是人工窖泥样品中的优势真菌门。LIU Y等[16]利用高通量测序技术对陶融型白酒上、中、下和底层窖泥的微生群落结构进行解析,发现Ascomycota、Mucoromycota和Basidiomycota是上、中、下和底层窖泥的优势真菌门,亦与本研究结果一致。由图3亦可知,各样品间细菌、真菌门水平组成相似但相对丰度不同,如放线菌门在各样品中的相对丰度分别为23.64%、21.06%和22.55%;毛霉菌门在各样品中的相对丰度分别为2.85%、3.39%和4.35%。
基于属水平,进一步对人工窖泥中微生物群落结构组成进行分析,结果见图4。
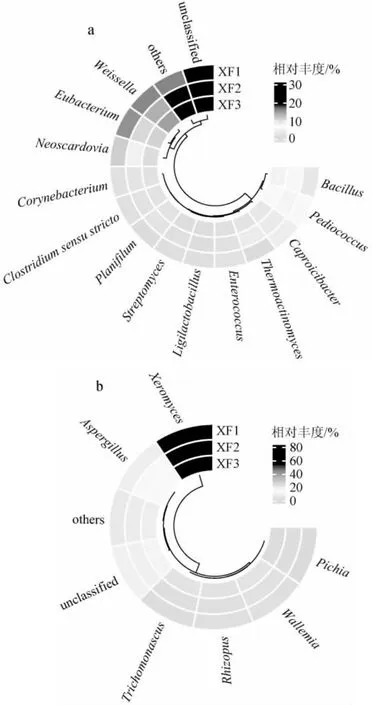
图4 基于属水平人工窖泥样品中细菌(a)和真菌(b)菌群结构Fig.4 Structure of bacterial (a) and fungal (b) communities in artificial pit mud samples based on genus level
由图4a可知,在细菌属水平上,优势细菌属有13个,包括魏斯氏菌属(Weissella)(14.32%)、真杆菌属(Eubacterium)(11.89%)、新斯氏菌属(Neoscardovia)(9.42%)、片球菌属(Pediococcus)(5.49%)、芽孢杆菌属(Bacillus)(4.22%)、Caproicibacter(3.18%)、高温放线菌属(Thermoactinomyces)(2.02%)、棒状杆菌属(Corynebacterium)(1.71%)、真丝菌属(Planifilum)(1.65%)、狭义梭菌属(Clostridium sensu stricto)(1.57%)、肠球菌属(Enterococcus)(1.49%)、链霉菌属(Streptomyces)(1.08%)和联合乳杆菌属(Ligilactobacillus)(1.02%)。其中魏斯氏菌属、片球菌属和芽孢杆菌属均属于乳酸菌,其产生的乳酸与乙醇反应可以生成白酒中重要的风味成分乳酸乙酯[17];高温放线菌属是大曲中产淀粉酶、果胶酶和纤维素酶等水解酶类的重要来源,对大曲内部结构的疏松和大曲骨架的维持有重要作用[18];狭义梭菌属是一类厌氧菌,能利用乙酸和乙醇等生成白酒中重要的香味成分己酸乙酯和丁酸乙酯[19];真杆菌属中部分菌种的发酵代谢产物为丁酸、乙酸或甲酸,这些菌属均是酿酒过程中重要的酿酒功能菌属[20]。由图4b可知,在真菌属水平上,优势真菌属有6个,包括耐干霉菌属(Xeromyces)(65.04%)、曲霉属(Aspergillus)(9.57%)、节担菌属(Wallemia)(2.71%)、Trichomonascus(2.18%)、根霉属(Rhizopus)(2.04%)和毕赤酵母属(Pichia)(1.07%)。其中耐干霉菌属、曲霉属和根霉属等菌属具有较强的分泌糖化酶、葡萄糖氧化酶、葡萄糖淀粉酶和蛋白酶等酶类的能力,进而促进酵母菌繁殖,产生更多的乙醇,提升白酒的风味和品质[21];毕赤酵母属是酵母菌的一类,可以将甲醇作为碳源生成乙醇[22]。
由图4亦可知,在细菌和真菌属水平上,未知物种的平均相对丰度分别为22.82%和11.05%,在人工窖泥样品中占比较大。综上所述,人工窖泥样品中不仅含有多种重要的酿酒功能菌属,还有较多的未知物种,这对人工窖泥微生物菌库的扩充有着重要的意义。
2.3 人工窖泥样品优势菌属间的相关性分析
人工窖泥样品中微生物菌群组成较为丰富,且各样品细菌和真菌菌群存在一定的相似性和特异性,而高质量人工窖泥形成的重要因素之一是微生物菌群的共同作用。为进一步探究人工窖泥样品中微生物菌群间的关系,对人工窖泥样品中优势菌属间的相关性进行分析,结果见图5。

图5 人工窖泥样品中优势菌属间相关性分析热图Fig.5 Heat map of correlation analysis between dominant microbial genera in artificial pit mud samples
由图5可知,真丝菌属(Planifilum)与芽孢杆菌属(Bacillus)呈显著正相关(P<0.05),联合乳杆菌属(Ligilactobacillus)与肠球菌属(Enterococcus)呈显著正相关(P<0.05)。其中,芽孢杆菌属参与了白酒酿造全过程,其代谢产生的蛋白酶、淀粉酶等水解酶类可以将原料分解成各种风味化合物的前体物质[23];而联合乳杆菌属(Ligilactobacillus)和肠球菌属(Enterococcus)属于乳酸菌,在一定条件下,其部分菌种产生的酸类物质与风味物质结合会生成白酒的主体香型物质乳酸乙酯、乙酸乙酯、己酸乙酯等[24]。由此可知,不同细菌类群间的协同效应赋予了白酒独特的酒体风味。此外,人工窖泥样品中部分优势菌属间存在拮抗或竞争关系,如曲霉属(Aspergillus)与肠球菌属(Enterococcus)呈极显著负相关(P<0.01);魏斯氏菌属(Weissella)与高温放线菌属(Thermoactinomyces)及毕赤酵母属(Pichia)呈显著负相关(P<0.05),真丝菌属(Planifilum)与真杆菌属(Eubacterium)呈显著负相关(P<0.05),棒状杆菌属(Corynebacterium)与新斯氏菌属(Neoscardovia)呈显著负相关(P<0.05),联合乳杆菌属(Ligilactobacillus)与狭义梭菌属(Clostridium sensu stricto)及曲霉属(Aspergillus)呈显著负相关(P<0.05)。曲霉属为白酒酿制提供了种类繁多的酶类,如糖化酶、蛋白酶、液化酶和脂肪酶等酶类[21];毕赤酵母属产酯能力强,能以有机酸为原料合成酯类,对白酒出酒率、风味和品质都有一定的影响[25];魏斯氏菌属和真杆菌属可以产生乳酸、丁酸、乙酸或甲酸等有机酸,其在人工窖泥样品中的相对丰度分别为14.32%和11.89%,可能是白酒滋味品质形成的重要来源[26-27];而真丝菌属是窖泥老化或者质量较差窖泥中所含有的指示菌属,其在人工窖泥样品中的平均相对丰度为1.65%,如果此菌属含量过高,会影响人工窖泥的品质[28]。因此,在后续对人工窖泥的研究中,可以采用传统纯培养技术收集魏斯氏菌属、肠球菌属、毕赤酵母属和曲霉属等酿酒菌属的部分性状优良菌种,选择性的应用到人工窖泥品质提升中。
3 结论
纳入本研究的人工窖泥样品中,微生物菌群组成较为丰富且存在一定的特异性,通过高通量测序技术从中共注释到13个优势细菌属和6个优势真菌属,优势细菌属分别为Weissella、Eubacterium、Neoscardovia、Pediococcus、Bacillus、Caproicibacter、Thermoactinomyces、Corynebacterium、Planifilum、Clostridium sensu stricto、Enterococcus、Streptomyces和Ligilactobacillus,优势真菌属分别为Xeromyces、Aspergillus、Wallemia、Trichomonascus、Rhizopus和Pichia。优势菌属间的相关性分析表明,芽孢杆菌属(Bacillus)、联合乳杆菌属(Ligilactobacillus)和肠球菌属(Enterococcus)等菌属对人工窖泥品质的调节有积极的正向协同效应,而部分细菌属与真菌属之间存在一定的拮抗或竞争关系。在后续研究中可对人工窖泥中未知物种进行深入探究,还可以采用传统纯培养技术对酿酒功能菌属进行分离鉴定,依据各菌属间的相关性适时添加合适菌株调节窖泥微生态。

