典型石英族矿物表面差异性对其吸附重金属的影响
唐翠华
典型石英族矿物表面差异性对其吸附重金属的影响
唐翠华1, 2, 3
(1. 油气地球化学与环境湖北省重点实验室(长江大学), 湖北 武汉 430100; 2. 长江大学 资源与环境学院, 湖北 武汉 430100; 3. 油气资源勘探技术教育部重点实验室, 湖北 武汉 430100)
矿物表面微结构及其性质是矿物表界面作用的关键制约因素, 控制着重金属元素在表生地球化学环境中迁移和归趋。本文对比了典型石英族矿物(α-石英、α-方石英)对Cu2+、Pb2+、Zn2+、Co2+等重金属离子的吸附特征和规律, 通过等温滴定量热技术分析了2种矿物吸附这4种离子的热力学特征,并结合EPR谱初步分析了Cu2+和Co2+在2种不同矿物表面上的吸附机制和差异。结果表明: ①α-石英、α-方石英对4种重金属离子有明显的选择性吸附, 且对Cu2+和Pb2+的吸附能力明显大于Zn2+和Co2+。离子吸附量与矿物表面羟基位密度呈正相关关系, 因此, α-石英的单位面积吸附量均大于α-方石英; ②α-石英、α-方石英吸附Cu2+、Pb2+、Zn2+为吸热反应, 且α-石英的反应焓变值大于α-方石英。α-石英、α-方石英吸附Co2+为放热反应, 可能与重金属离子在其表面形成产物的结构不同有关; ③α-石英、α-方石英与Cu2+发生配位, 主要生成了内层配合物(=2.08)。α-石英吸附Co2+产物中存在属于Co(Ⅱ)的产物信号峰, 而在α-方石英中无较明显此峰, 表明Co2+在α-方石英表面可能形成了其他局部微观结构, 并不以简单的配位吸附Co(Ⅱ)的形式存在, 但需进一步验证。本研究进一步明确了石英族矿物表面微结构和性质差异对其吸附重金属的影响。
α-石英; α-方石英; 表面差异性; 吸附; 重金属
0 引 言
矿物表界面反应是元素地球化学循环的重要环节, 矿物表面微结构及其性质是矿物表界面反应的关键因素。重金属离子在土壤和沉积物中的界面反应(吸附、沉淀等)是它们在地表环境中迁移、转化和富集的重要过程(吴大清等, 2001)。近年来, 伴随经济的飞速发展, 环境污染问题日益突出, 重金属离子对土壤环境的污染与危害也越严重(Eloussaief et al., 2009; Idris, 2015)。随着对有毒有害元素地球化学循环研究的深入, 人们认识到矿物表界面作用在控制这些有害物质的地球化学循环方面起着关键作用。
作为土壤和沉积物中重要组成部分, SiO2矿物在重金属离子的迁移、转化和富集过程中扮演着重要角色。研究表明, 在不同介质条件(如pH值、离子强度、初始浓度)的溶液中, 矿物表面对重金属离子的吸附量不同, 重金属离子在矿物表面的结合形态也不同(Freedmanet al., 1994; 吴宏海等, 2000; 吴宏海和吴大清, 2000; Hyun et al., 2003)。因此, 重金属离子在不同表面性质的矿物上会形成不同的产物(Chisholmbrause et al., 1990; 曾贻善和杨异, 1995; O’Day et al., 1996; Kasar et al., 2013)。重金属离子在矿物–溶液界面有不同的反应形式, 其结合形态可能为矿物表面官能团与部分脱水重金属水合离子配位络合形成的内层配位化合物(inner-sphere complexes),或与未脱水重金属水合离子形成的外层配位化合物(outer-sphere complexes), 甚至出现表面沉淀(surface precipitation)。研究发现, 将土壤和沉积物中的SiO2矿物单一地视为一种矿物是不科学的, 而且对晶型SiO2矿物表界面反应的研究也多停留在石英层面上(吴宏海等, 1998, 2000; 吴宏海和吴大清, 2000)。SiO2晶型矿物由多个具有不同性质的同质多像体组成, 是石英族矿物的重要组成部分。石英族矿物的主要表面官能团为表面羟基, 其类型(包括孤立羟基和孪位羟基)和分布(如密度)存在差异。因此, 这些变体矿物的表面结构和表面性质差异对一些表面反应(如有机质吸附、表面元素溶出)有一定影响(Tang et al., 2015; Zhu et al., 2018; Tang and Dong, 2021), 但对其与重金属离子之间的作用有何影响仍知之甚少。因此, 开展常见石英族矿物与常见重金属反应的研究, 不仅能进一步明确SiO2同质多像体矿物表面微结构和性质差异对其吸附重金属的影响, 而且也能够为客观、全面地评价土壤和沉积物中SiO2矿物体系对重金属离子的环境行为影响提供一定的理论依据。
本文选用典型石英族矿物(α-石英、α-方石英)为研究对象, 采用吸附实验, 通过等温滴定量热法(isothermal titration calorimetry, ITC)和电子顺磁共振波谱仪(electron paramagnetic resonance, EPR), 考察它们对Cu2+、Pb2+、Zn2+、Co2+等重金属离子的吸附特征和热力学特征, 以及Cu2+和Co2+在2种矿物表面的吸附机制和差异, 进一步深入探讨石英族矿物中同质多像体的表面微结构和性质差异对典型重金属离子吸附行为的影响。
1 实验与方法
1.1 实验样品
α-石英采自贵州贵定, α-方石英购自广西桂平。样品经单罐行星式高能球磨机(Fritsch Pulverisette 6, 德国)研磨至平均粒径约5 μm。用0.01 mol/L HCl溶液浸泡样品24 h, 以去除金属杂质, 然后用超纯水反复冲洗至无AgCl, 过滤后, 用真空冷冻干燥机干燥。粉末样品经450 ℃煅烧12 h去除有机物。测定α-石英、α-方石英的BET比表面积分别为3.8 m2/g和3.6 m2/g。
实验中用到的Cu(NO3)2·3H2O、Pb(NO3)2、Zn(NO3)2·6H2O、Co(NO3)2·6H2O试剂均为分析纯(天津科密欧化学试剂有限公司)。
1.2 实验及测试方法
1.2.1 α-石英、α-方石英对Cu2+、Pb2+、Zn2+、Co2+的等温吸附实验
取0.2 g α-石英、α-方石英分别加入50 mL聚丙烯离心管中, 加入10 mL pH值为5~6的超纯水, 混匀稳定24 h, 使固–液悬浊液的最终pH值约为5.5±0.1(预实验确定)。然后分别向各离心管中加入10 mL初始浓度为20 mg/L、30 mg/L、40 mg/L、50 mg/L、60 mg/L、70 mg/L、80 mg/L和90 mg/L的Cu2+溶液(pH值已调节至5.5±0.1)。充分混匀后, 离心管置于恒温摇床中以160 r/min的振荡速率恒温(25±1 ℃)振荡24 h。待充分反应后, 再以4200 r/min的速率离心10 min, 然后用水相聚醚砜滤膜(规格为13 mm/0.45 μm)进一步分离固液相, 取滤液用超纯水稀释至一定浓度, 溶液中Cu2+含量通过原子吸收分光光度计(PerkinElmer AA400)测定, 空白实验表明离心管壁的吸附可忽略不计。实验在室温、空气气氛条件下进行。
α-石英、α-方石英吸附Pb2+、Zn2+、Co2+实验中, Pb2+溶液的初始浓度为20 mg/L、40 mg/L、60 mg/L、80 mg/L、100 mg/L、120 mg/L、160 mg/L、200 mg/L和240 mg/L; Zn2+、Co2+溶液的初始浓度为8 mg/L、12 mg/L、16 mg/L、20 mg/L、24 mg/L、28 mg/L、32 mg/L和36 mg/L。其余实验步骤与Cu2+实验步骤相同。
1.2.2 等温滴定量热实验
(1) 吸附剂悬浊液样品的制备: 配制10 g/L α-石英、α-方石英悬浊液10 mL, 各加3滴0.1 mol/L KNO3溶液, 并用标准酸碱溶液调节悬浊液的pH值至5.5~6.0。移取0.7 mL悬浊液加入已洗净干燥的1 mL不锈钢安瓿瓶中, 安装好后, 分别将参比电极和实验电极所在的安瓿瓶提取器放入纳瓦级量热仪(TAMⅢ, 美国)相应的测量通道中。空白实验中向安瓿瓶中加入超纯水。
(2) 待滴定重金属离子溶液的制备: 配制1 mmol/L Cu2+、Pb2+、Zn2+、Co2+溶液, 调节溶液的pH值与上述对应悬浊液的pH值接近, 差值不超过0.1。用配制好的溶液润洗进样注射器及其进样针管3次后, 向进样注射器中加入0.25 mL重金属离子溶液, 保证进样注射器中无气泡, 使进样长针管中充满滴定液, 并将进样注射器安装在进样马达上。
(3) 将进样针管沿管道缓慢插入安瓿瓶液面上方, 将安瓿瓶提取器采用逐步下放的方式放至测量通道中, 等待仪器稳定。测量程序设置温度为25 ℃, 滴定次数为10次, 每次滴加溶液20 μL。待安瓿瓶提取器放至最底端, 仪器基线稳定后即可进行滴定测量。
测量得到的所有热流–时间滴定曲线都必须经基线校正。曲线中每个峰(吸热)或谷(放热)的峰底或谷底与峰尖或谷尖的积分峰面积为该次滴定反应过程中吸收或放出的热量值, 每次滴定的各样品实验与空白实验的热量差值为吸收或放出的净热量值。以吸收或产生的净热量值为纵坐标, 滴加的重金属离子体积为横坐标作图, 并经NanoAnalyze软件拟合, 即可得到相应的热力学参数。
1.2.3 α-石英、α-方石英吸附产物的EPR测试方法
α-石英、α-方石英样品的EPR测试在Bruker EMX EPR共振谱仪上完成, 测试波段为X波段, 测试频率为9.4 GHz, 微波功率为2.21 mW, 测试温度为液氮温度(77 K), 扫描步长为1 K。
2 结果与讨论
2.1 α-石英、α-方石英对Cu2+、Pb2+、Zn2+、Co2+的等温吸附结果
α-石英和α-方石英对Cu2+、Pb2+、Zn2+、Co2+的等温吸附结果(图1)表明,在pH=5.5时, α-石英和α-方石英对4种重金属离子具有明显的选择性吸附, 且对Cu2+和Pb2+的吸附量明显大于Zn2+和Co2+。这种选择性吸附与重金属离子的有效水合半径和水化能等因素相关。另外, α-石英对重金属离子的吸附量高于α-方石英(两者对Co2+吸附量均较小且差异不明显, 可能与其吸附机制有关), 这是因为Cu2+、Pb2+、Zn2+等重金属离子主要通过与表面硅羟基(≡Si–OH)反应吸附在α-石英、α-方石英表面, 因此, 重金属离子吸附量与矿物表面羟基位密度密切相关。α-石英和α-方石英的晶体结构不同, 导致其晶面上的表面羟基类型和密度有差别。而且, 由于两者均为无解理矿物, 破碎断键具有无规则性, 因此破碎颗粒表面的羟基种类和密度分布情况比单晶面上的分布更复杂。α-石英的表面羟基密度大于α-方石英(Murashov and Demchuk, 2005; Tang et al., 2014), 因此α-石英对Cu2+、Pb2+、Zn2+等重金属离子的单位面积吸附量高于α-方石英。
2.2 等温滴定量热实验结果
在25 ℃、pH=5.5~6.0条件下, Cu2+、Pb2+、Zn2+和Co2+溶液滴定α-石英、α-方石英的等温滴定量热曲线(图2)显示, α-石英、α-方石英吸附Cu2+、Pb2+、Zn2+的反应为吸热反应, 吸附Co2+的反应为放热反应。在滴定的初始阶段, 热效应比较明显, 热流值较大, 随后逐渐减小。这是由于在滴定初始阶段, α-石英、α-方石英的表面反应位相对充足, 重金属离子能够与足量的表面位反应, 有限的重金属离子优先和α-石英、α-方石英表面上的高亲和位结合(曾贻善和杨异, 1995; O’Day et al., 1996), 且高亲和位与重金属离子的结合力更强, 从而热效应值更大。但这种吸附位只占总表面位很小的一部分, 因此, 当表面高亲和位被完全占据时, 重金属离子开始与表面较低亲和位结合, 表面位与重金属离子之间的作用力变弱, 反应的热效应值变小。随着矿物表面吸附接近饱和时, 表面位与重金属离子基本完全反应, 减掉空白实验中重金属离子的稀释热, 反应净放出或吸收的热量接近0。
在25 ℃、pH=5.5~6.0条件下, α-石英、α-方石英与Cu2+、Pb2+、Zn2+和Co2+体系等温滴定过程中的热量变化情况(图3)显示, 随着滴定反应进行, α-石英、α-方石英矿物表面与各重金属离子的反应过程中吸收或放出的热量逐步减少, 并有接近0的趋势, 表明反应逐步趋向平衡。
通过NanoAnalyze软件对滴定数据进行拟合得到各反应相关的热力学参数(表1)。α-石英、α-方石英吸附重金属离子反应的吉布斯自由能(Δ)均为负值, 表明吸附反应能自发进行。熵变值(Δ)均为正值, 表明重金属离子与表面位通过配位作用吸附在α-石英、α-方石英上, 导致其体系无序度增加(Sheng et al., 2013)。α-石英、α-方石英吸附Cu2+、Pb2+、Zn2+反应的焓变值(Δ)均大于0,表明整个反应为吸热反应。Karlsen et al. (2010)对Pb2+、Cr3+等重金属离子与几丁质和活性炭反应的微量热研究表明, 重金属离子在几丁质表面的吸附为吸热反应, 实质是重金属离子与其表面含氧等活性官能团的键合反应, 是典型的吸热过程。α-石英、α-方石英与Cu2+、Pb2+、Zn2+重金属离子反应的实质是表面反应位SiO−与重金属离子的键合, 因此, 该吸附反应为吸热反应。Wu et al. (2013)对改性玻璃粉(主要成分为PbO、SiO2)吸附Cu2+的热力学研究也发现其吸附过程为吸热反应。此外, α-石英吸附Cu2+、Pb2+、Zn2+的Δ均大于α-方石英, 可能是由于α-石英的表面羟基密度高于α-方石英, 且α-石英的表面孪位羟基密度更高(Tang et al., 2014),对Cu2+、Pb2+、Zn2+离子的键合能力更强。
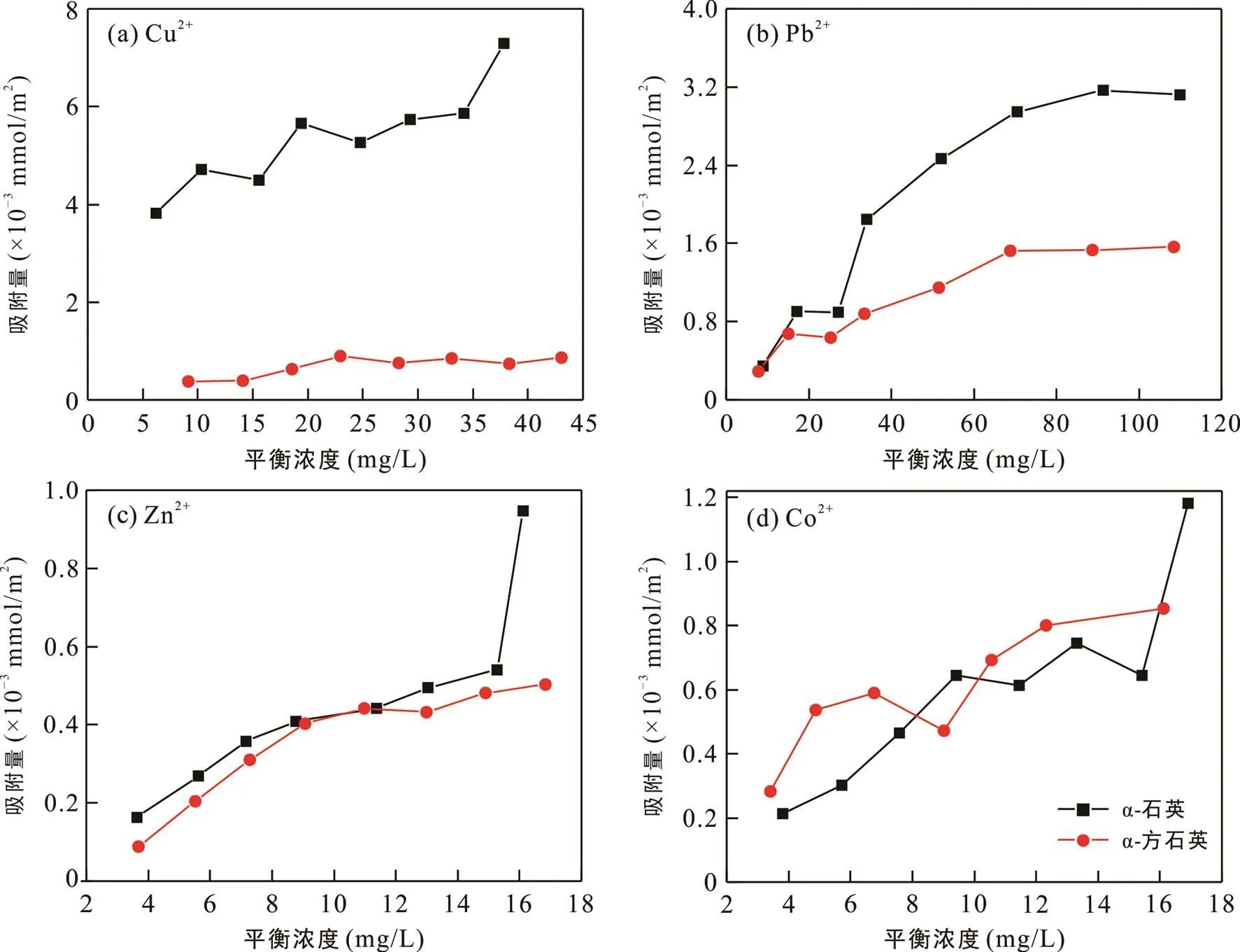
图1 α-石英、α-方石英对Cu2+(a)、Pb2+(b)、Zn2+(c)、Co2+(d)的等温吸附曲线

图2 α-石英、α-方石英对Cu2+、Pb2+、Zn2+、Co2+的等温滴定量热曲线(向上(正)峰表示吸热, 向下(负)峰表示放热)

图3 α-石英、α-方石英与Cu2+(a)、Pb2+(b)、Zn2+(c)、Co2+(d)体系等温滴定过程中的热量变化拟合曲线
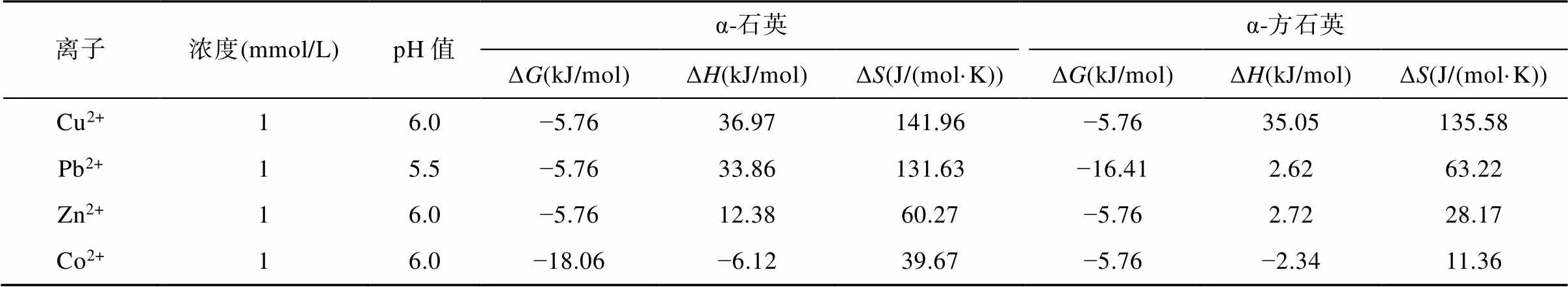
表1 等温滴定量热数据拟合得到的相关热力学参数
α-石英、α-方石英吸附Co2+的Δ<0(分别为−6.12 kJ/mol和−2.34 kJ/mol; 表1), 为放热反应。本文中α-石英吸附Co2+的Δ与James and Healy (1972)的研究结果(Δ=−8.34 kJ/mol)接近。α-石英、α-方石英吸附Co2+的热效应与Cu2+、Pb2+、Zn2+明显不同, 可能与不同重金属离子在其表面吸附后形成的局部结构不同有关。Manceau et al. (1999)采用延伸X射线吸收精细结构谱(EXAFS)研究Co2+在α-石英表面吸附产物的结构发现, Co2+在α-石英表面并不只是简单地生成类似Co(OH)2的沉淀结构, 而是在表面微观局部范围内生成了类似于三八面体黏土矿物的结构; Cheah et al. (1998, 1999)运用X射线精细结构谱(XAFS)和EPR研究Cu2+在α-石英表面吸附产物的微观结构却发现, Cu2+与α-石英表面的硅羟基以单核单配位和单核双配位形式在其表面生成内层配合物, 且随反应时间增加, 双配位与单配位比值相应增加, 并没有局部Cu原子三维结构的生成。因此, 虽然本研究体系条件与前人研究有所不同, 但从热反应结果来看, 吸附在α-石英和α-方石英表面的Co2+仍有形成上述微观局部结构的可能。吸附在矿物表面的Co2+形成的短程有序结构为保持其局部结构的稳定性, 可能需要释放出结构中的部分能量, 使其Δ为负值, 但这需要后续进一步的表征手段进行验证。
2.3 EPR表征结果
α-石英和α-方石英吸附Cu2+、Co2+产物的EPR谱图(图4、5)显示, 它们均具有=2.00电子顺磁信号, 且α-石英中的信号明显强于α-方石英。这个信号为α-石英中的结构缺陷信号, 包括氧空位缺陷(E1′心)和杂质元素不等价置换产生的信号(Hyun et al., 2003)。吸附了Cu2+和Co2+的氧空位缺陷信号峰基本没有变化, 表明Cu2+和Co2+在α-石英和α-方石英表面的吸附并不依靠氧空位结构缺陷, 而是表面羟基位作用的结果(Tang and Cai, 2021)。
在α-石英、α-方石英吸附Cu2+产物的EPR谱图(图4)中, 除了=2.00信号峰, 还有一个=2.08信号峰, 此峰归属于Cu(Ⅱ)的产物信号峰。该信号峰的产生主要是由于反应溶液中Cu(H2O)62+的配体水分子脱失, 结构对称性降低, 部分脱水的水合铜离子与呈负电性的α-石英和α-方石英表面发生配位作用, 形成了较稳固的内层配合物。α-方石英吸附Cu2+的量比α-石英低, 但α-方石英的=2.08信号峰却更强, 一方面, α-石英中强烈的氧空位缺陷信号, 导致Cu(Ⅱ)信号很弱, 而在α-方石英中Cu(Ⅱ)信号相对明显; 另一方面, α-石英中配位吸附铜(=2.08)信号强度降低可归因于表面二聚体或者多核形式铜的形成(Motschi, 1984; Xia et al., 1997, 1998; Cheah et al., 1998)。此外, 在α-石英中, 除了=2.08信号峰, 还存在=2.05信号峰, 该信号峰代表的Cu(Ⅱ)表面赋存状态仍需要进一步的谱学手段验证。
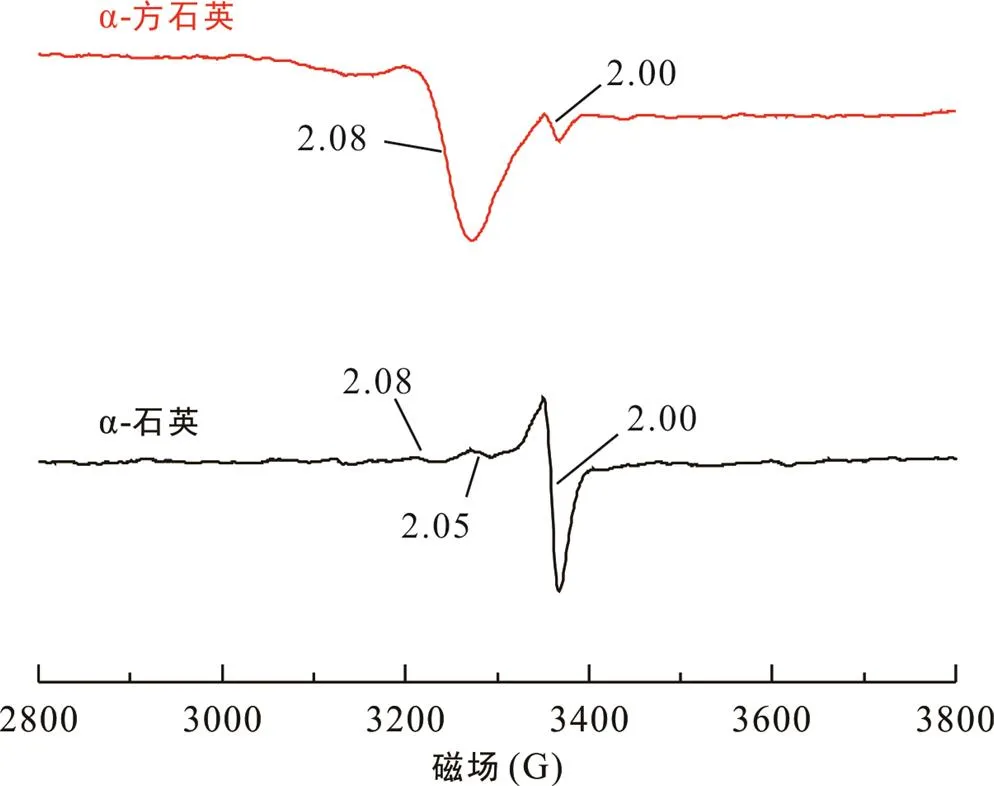
图4 α-石英和α-方石英吸附Cu2+的EPR谱图

图5 α-石英和α-方石英吸附Co2+的EPR谱图
在α-石英吸附Co2+产物的EPR谱图(图5)中,也出现了=2.05信号峰, 此峰为Co(Ⅱ)的产物信号峰, 但同样由于其强烈的结构缺陷信号, 该信号峰相对较弱。而在α-方石英中, 除了=2.00的氧空位缺陷信号峰, 无其他明显的Co(Ⅱ)信号峰, 表明Co2+在α-方石英表面可能形成了其他局部微观结构, 并不以简单的配位吸附Co(Ⅱ)形式存在。
3 结 论
(1) α-石英、α-方石英对Cu2+、Pb2+、Zn2+、Co2+有明显的选择性吸附, 且对Cu2+和Pb2+的吸附能力明显大于Zn2+和Co2+。这种选择性吸附与重金属离子的结晶学半径、有效水合半径以及水化能等因素密切相关。吸附反应主要依靠表面羟基位的配位作用, 因此, α-石英对重金属离子的单位面积吸附量均大于α-方石英。
(2) α-石英、α-方石英吸附Cu2+、Pb2+、Zn2+为吸热反应, 且α-石英的反应焓变值大于α-方石英; 而吸附Co2+为放热反应, 可能与不同重金属离子吸附在其表面后形成的结构不同有关。
(3) α-石英、α-方石英与Cu2+发生配位作用, 生成内层配合物, 无外层配合物生成。α-石英吸附Cu2+的反应产物中出现=2.05信号峰, 与α-方石英有所差别。α-石英吸附Co2+的反应产物中存在Co(Ⅱ)的产物信号峰, 而在α-方石英中无明显此峰, 表明Co2+在α-方石英表面可能形成了其他局部微观结构, 并不以简单的配位吸附Co(Ⅱ)形式存在, 但需进一步的谱学手段验证。
致谢:感谢华南师范大学吴宏海教授和另一位匿名评审专家对本文提出建设性修改意见。
吴大清, 刁桂仪, 彭金莲, 王林江, 袁鹏. 2001. 环境矿物界面反应动力学. 岩石矿物学杂志, 20(4): 395–398, 404.
吴宏海, 吴大清. 2000. 石英矿物表面反应性的EPR谱学研究. 光谱学与光谱分析, 20(3): 298–301.
吴宏海, 吴大清, 彭金莲. 1998. 重金属离子与石英表面反应的实验研究. 地球化学, 27(6): 523–531.
吴宏海, 吴大清, 彭金莲. 2000. 溶液介质条件对重金属离子与石英表面反应的影响. 地球化学, 29(1): 62–66.
曾贻善, 杨异. 1995. 金在石英表面沉淀的实验研究. 地质论评, 41(3): 277–281.
Cheah S F, Brown G E, Parks G A. 1998. XAFS spectroscopy study of Cu(Ⅱ) sorption on amorphous SiO2and gamma-Al2O3: Effect of substrate and time on sorption complexes., 208(1): 110–128.
Cheah S F, Brown G E, Parks G A. 1999. Structure and composition of copper(Ⅱ)-2,2′-bipyridine sorption complexes on amorphous SiO2., 63(19–20): 3229–3246.
Chisholm-Brause C J, O’Day P A, Brown Jr G E, Parks G A. 1990. Evidence for multinuclear metal-ion complexes at solid water interfaces from X-ray absorption-spectroscopy., 348(6301): 528–531.
Eloussaief M, Jarraya I, Benzina M. 2009. Adsorption of copper ions on two clays from Tunisia: pH and temperature effects., 46(4): 409–413.
Freedman Y E, Magaritz M, Long G L, Ronen D. 1994. Interaction of metal with mineral surfaces in a natural groundwater environment., 116(1–2): 111–121.
Hyun S P, Cho Y H, Hahn P S. 2003. An electron paramagnetic resonance study of Cu(Ⅱ) sorbed on quartz., 257(2): 179–187.
Idris S A M. 2015. Adsorption, kinetic, and thermodynamic studies for manganese extraction from aqueous medium using mesoporous silica., 440: 84–90.
James R O, Healy T W. 1972. Adsorption of hydrolyzable metal ions at the oxide — Water interface. Ⅲ. A thermodynamic model of adsorption., 40(1): 65–81.
Kasar S, Kumar S, Kar A S, Godbole S V, Tomar B S. 2013. Sorption of Eu(Ⅲ) by amorphous titania, anatase and rutile: Denticity difference in surface complexes.:, 434: 72–77.
Karlsen V, Heggset E B, Sørlie M. 2010. The use of isothermal titration calorimetry to determine the thermodynamics of metal ion binding to low-cost sorbents., 501(1): 119–121.
Manceau A, Schlegel M, Nagy K L, Charlet L. 1999. Evidence for the formation of trioctahedral clay upon sorption of Co2+on quartz., 220(2): 181–197.
Motschi H. 1984. Correlation of EPR parameters with thermodynamic stability constrants for copper(Ⅱ) complexes-Cu(Ⅱ)-EPR as a probe for the surface complexation at the water/oxide interface.:, 9(4): 333–347.
Murashov V V, Demchuk E. 2005. Surface sites and unrelaxed surface energies of tetrahedral silica polymorphs and silicate., 595(1): 6–19.
O’Day P A, Chisholm-Brause C J, Towle S N, Parks G A, Brown Jr G E. 1996. X-ray absorption spectroscopy of Co(Ⅱ) sorption complexes on quartz (alpha-SiO2) and rutile (TiO2).a, 60(14): 2515–2532.
Sheng G P, Xu J, Luo H W, Li W W, Li W H, Yu H Q, Xie Z, Wei S Q, Hu F C. 2013. Thermodynamic analysis on the binding of heavy metals onto extracellular polymeric substances (EPS) of activated sludge., 47(2): 607–614.
Tang C H, Cai L M. 2021. The effect of surface heterogeneity between α-quartz and α-cristobalite on adsorption behaviors toward Cu2+solution.:, 609, 125651.
Tang C H, Dong H. 2021. Effects of surface heterogeneity of α-quartz and α-cristobalite on adsorption of crystal violet., 6(18): 12105–12113.
Tang C H, Zhu J X, Li Z H, Zhu R L, Zhou Q, Wei J M, He H P, Tao Q. 2015. Surface chemistry and reactivity of SiO2polymorphs: A comparative study on α-quartz and α-cristobalite., 355: 1161–1167.
Tang C H, Zhu J X, Zhou Q, Wei J M, Zhu R L, He H P. 2014. Surface heterogeneity of SiO2polymorphs: An XPS investigation of α-quartz and α-cristobalite., 118(45): 26249–26257.
Wu S J, Liou T H, Yeh C H, Mi F L and Lin T K. 2013. Preparation and characterization of porous chitosan- tripolyphosphate beads for copper(Ⅱ) ion adsorption., 127(6): 4573– 4580.
Xia K, Mehadi A, Taylor R W, Bleam W F. 1997. X-ray absorption and electron paramagnetic resonance studies of Cu(Ⅱ) sorbed to silica: Surface-induced precipitationat low surface coverages., 185(1): 252–257.
Xia K, Taylor R W, Bleam W F, Helmke P A. 1998. The distribution of Cu(Ⅱ) on boehmite and silica surfaces: Correlating EPR signal loss with the effective Bohr Magneton Number of sorbed ions., 199(1): 77–82.
Zhu J X, Tang C H, Wei J M, Li Z H, Laipan M W, He H P, Liang X L, Tao Q, Cai L M. 2018. Structural effects on dissolution of silica polymorphs in various solutions., 471: 57–65.
Effects of surface differences in typical quartz minerals on the absorption of heavy metals
TANG Cuihua1, 2, 3
(1. Hubei Key Laboratory of Petroleum Geochemistry and Environment (Yangtze University), Wuhan 430100, Hubei, China; 2. College of Resources and Environment, Yangtze University, Wuhan 430100, Hubei, China; 3. Key Laboratory of Exploration Technologies for Oil and Gas Resources, Ministry of Education, Wuhan 430100, Hubei, China)
The surface microstructure and properties of minerals play crucial roles in governing their surface/interfaceinteractions, as well as the migration and fate of heavy metal elements in supergene geochemical environments. This paper presents a comparative study on the adsorption characteristics and behaviors of α-quartz and α-cristobalite concerning Cu2+, Pb2+, Zn2+, and Co2+ions. The thermodynamic features of the adsorption of these ions by the two minerals were investigated using isothermal titration calorimetry. When combined with the EPR spectra, the adsorption mechanisms of Cu2+and Co2+on the surfaces of the two minerals were elucidated. The research results demonstrate that: (1) α-quartz and α-cristobalite exhibit clear adsorption selectivity for the four heavy metal ions, with their adsorption capacity for Cu2+and Pb2+significantly greater than that for Zn2+and Co2+. The adsorption amount was positively correlated with the density of hydroxyl sites on the mineral surface, resulting in a greater adsorption amount per unit area for α-quartz compared to that of α-cristobalite. (2) The adsorption of Cu2+, Pb2+, and Zn2+by α-quartz and α-cristobalite is endothermic, and the enthalpy of the former is greater than that of the latter. The thermal effect of the adsorption of Co2+by α-quartz and α-cristobalite is distinctly different from that of Cu2+, Pb2+, and Zn2+, as it is an exothermic reaction. This divergence may be attributed to the different structures of heavy metal ions formed on the surface. (3) Cu2+predominantly coordinates on the surface of α-quartz and α-cristobalite to form an inner complex (=2.08). A signal peak belonging to Co(Ⅱ) appears in the α-quartz adsorption product, but no obvious peak is observed in α-cristobalite. This indicates that Co2+may have formed other local microstructures on the surface of α-cristobalite, rather than a simple coordinated adsorption Co(Ⅱ) form, although further investigation is needed to confirm this.
α-quartz; α-cristobalite; surface heterogeneity; adsorption; heavy metals
P574
A
0379-1726(2023)06-0707-08
10.19700/j.0379-1726.2023.06.005
2021-11-29;
2021-12-16
国家自然科学基金项目(41703108)资助。
唐翠华(1988–), 女, 讲师, 主要从事矿物表界面物理化学过程研究。E-mail: tch880710@163.com

