牛樟芝种质资源分析及其Antcin 类化合物对乳腺癌细胞的影响
温叶艳,张引莲,张煜隆,林紫璇,林冬梅,林兴生,李 晶*
(1.福建农林大学菌草科学与技术研究院/国家菌草工程技术研究中心,福建 福州 350002;2.福建农林大学生命科学学院,福建 福州 350002)
牛樟芝(Taiwanofungus camphoratus M.Zang & C.H.Su)是中国台湾特有的珍稀药用菌,又名牛樟菇、樟芝,是多年生蕈菌类,具有圆柱形担孢子,菌丝呈黄色、棕红色或红色,子实体生长在中国台湾特有的牛樟树中空内壁上,呈暗棕红色,形状呈不规则状。牛樟芝Antcin 类化合物是其主要活性物质,常被用于解毒、止痛,具有抗氧化和抗肿瘤作用[1]。据国际抗癌协会资料统计,乳腺癌是女性发病率最高的恶性肿瘤,全世界每年约120 万妇女发病,其中约50 万人死于乳腺癌,且发病率在中国逐年上升,对社会家庭产生巨大的影响[2]。牛樟芝中Antcin A、Antcin K、Antcin H等化合物具有不同的抗肿瘤活性作用[3]。Hsieh 等[4]认为Antcin A、Antcin C 和Methyl anticiante A 可选择性抑制人类癌细胞而非正常细胞的增殖;Methylantcinate B 和Antcin B 被认为是对各种类型癌细胞的强细胞毒性药物[5];Antcin A 能抑制乳腺癌细胞的迁移和侵袭,可作为开发乳腺癌治疗抗转移药物的先导制剂[6]。分子生物学技术已成为21 世纪科技革命的主要技术之一,DNA 分子标记技术是分子生物学技术的重要组成部分,成为作物遗传育种、品种鉴定、遗传多样性分析、基因定位和克隆等研究的重要手段。在食用菌研究中,DNA 分子标记技术和基因转化技术等已广泛应用于生物遗传多样性、种群结构、种质鉴定和物种鉴别中[7]。其中简单重复序列区间长度多态性(Inter Simple Sequence Repeat,ISSR)和基于ITS 限制性内切酶片段长度多态性分析(Internal Transcribed Spacer-Restriction Fragment Length Polymorphism,ITS-RFLP)技术成为研究真菌遗传多样性较为常见的分子技术之一[8],该方法具有简便、快速、低成本和重复性好等特点[9]。BOX-PCR 指纹图谱分析技术与重复片段PCR基因指纹分析(Repetitive DNA PCR-based Genomic Fingerprinting,REP-PCR)和分型法基于肠杆菌基因间重复共有序列(Enterobacterial Repetitive Intergenic Consensus-PCR,ERIC-PCR)技术相似,但其操作更为简单快捷,容易获得较为丰富的扩增条带,不需要菌株的特异性DNA 探针,仅需要一条单引物就能够完成大量菌株的DNA 多态性分析,已被广泛应用于品种鉴定[10]。文章通过收集牛樟芝菌株并使用DNA 分子标记技术对其进行种质资源分析,并对从牛樟芝中提取到的Antcin 类化合物开展其对乳腺癌细胞的增殖、转移等研究,探讨Antcin 类化合物的协同作用,为开发乳腺癌治疗药物提供新思路。
1 材料与方法
1.1 供试材料
1.1.1 试验菌株和细胞
本研究所使用供试菌株均由笔者收集并保存于福建农林大学国家菌草工程技术研究中心,乳腺癌细胞由中国台湾中兴大学树木代谢组学和天然药物开发实验室王升陽教授提供(表1)。

表1 供试菌株及细胞来源
1.1.2 主要工具酶及试剂
牛樟芝固体培养基主要配方为2.5%葡萄糖、0.5% 蛋白胨、0.3% 麦芽糖、0.3% 酵母提取物、0.1% KH2PO4、0.1% MgSO4·7H2O、0.1%维生素B1、0.25%柠檬草水提取物[10]、2%琼脂粉,培养基于121 ℃灭菌20 min 后倒平板冷却备用。Antcin B(ATB)和Antcin H(ATH)化合物从牛樟芝AC001 子实体中分离得到,纯度均>99%[11]。2 × Taq Master Mix、D2000(plus)Marker、真菌DNA 提取试剂盒、限制性内切酶EcoR I,Dra I,BspD I,Apal I,MspA1 I 等购于NEW ENGLAND BIOLABS 公司,二甲基亚砜(DMSO),Roswell Park Memorial Institute-1640 培养基(RPMI),胎牛血清(FBS),丙酮酸钠,三苯氧胺(Tamoxifen,TAM),青霉素(Penicillin,AMP)、吉姆萨染色液(Giemsa) 等由Invitrogen(Carlsbad,CA) 提供,Matrigel 基质基底膜由Discovery Labware(Bedford,USA)提供,其他试剂均为国产分析纯。本文主要引物均由福州尚亚生物技术有限公司合成(表2)。

表2 本研究所用引物
1.2 试验方法
1.2.1 基因组DNA 提取
将供试菌株采用牛樟芝固体培养基平板进行活化,分别取新鲜菌丝体按真菌DNA 提取试剂盒说明书要求操作,经Nanodrop 2000 检测浓度和纯度合格后-20 ℃保存备用。
1.2.2 ITS-RFLP 序列扩增供试菌株
ITS 序列扩增反应体系为25 μL,其中2 × Taq Master Mix1 2.5 μL、DNA 模板1 μL、ITS1 与ITS4 引物各1 μL,ddH2O 9.5 μL。PCR 扩增程序:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,30 个循环,最后72 ℃延伸7 min。PCR 产物经1%琼脂糖凝胶电泳后进行产物回收、纯化和测序。
通过限制性内切酶EcoR I,Dra I,BspD I,Apal I,MspA1 I 对ITS PCR 产物进行酶切。反应体系(总体积30 μL):10 × FastDigest Green Buffer 2 μL、FastDigest enzyme 1 μL、PCR 产物10 μL、ddH2O 17 μL。酶切程序:37 ℃反应5 min 后65 ℃加热10 min 使酶失活。以1%琼脂糖凝胶,100 V 电压电泳30 min,经切胶回收测序后,所得到的序列与NCBI 中GenBank 数据库做比对分析。序列采用软件MEGA7.0 以邻接(Neighbor-joining,简称NJ)法构建进化树,以外源菌株金福菇TO03 作为外源对照。
1.2.3 BOX-PCR 序列扩增
BOX-PCR 序列扩增反应体系为25 μL,其中包括2 × Taq Master Mix 3.3 μL,DNA 模板1 μL,引物1 μL,ddH2O 19.7 μL。PCR 扩增程序:95 ℃预变性7 min,94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸8 min,30 个循环,最后72 ℃延伸15 min。PCR 产物经1 %琼脂糖凝胶电泳后拍照记录。
1.2.4 ISSR 序列扩增
ISSR 序列扩增反应体系为25 μL,包括2 × Taq Master Mix 12.5 μL,DNA 模板1 μL,引物1 μL,ddH2O 10.5 μL。PCR 扩增程序:94 ℃预变性4 min,94 ℃变性30 s,以50~60 ℃复性45 s,72 ℃延伸2 min,共35个循环,最后72 ℃延伸7 min。PCR 产物经1 % 琼脂糖凝胶电泳后拍照。采用软件Ntsyspc 2.10e 以非加权组平均法(UPGMA)聚类分析和Tree Plot 法对凝胶电泳图进行分析并建立进化树。
1.2.5 乳腺癌细胞培养及MTT 试验
将乳腺癌细胞MDA-MB-231 接种在含有10%胎牛血清、1.5 g·L-1NaHCO3和100 U·L-1AMP 的RPMI 培养基中,在5% CO2培养箱中37 ℃继代培养至第6 代,以第7 代MDA-MB-231 细胞为实验对象。
MTT 试验是将MDA-MB-231 细胞分别以104个·孔-1(200 μL) 的密度接种在含有10% FBS、1.5 g·L-1NaHCO3和1%青霉素的RPMI 培养基的96 孔细胞培养板中,分别以0、5 μmol·L-1、10 μmol·L-1、20 μmol·L-1、40 μmol·L-1的ATB、ATH 和ATB+ATH 组合分别处理MDA-MB-231 细胞24 h 和72 h,以490 nm 处的吸光度值设置细胞增殖率为100%,计算Antcin 类化合物对乳腺癌细胞致死率。
1.2.6 划痕试验
将2 × 104个·孔-1(70 μL)MDA-MB-231 细胞接种到具有无硅细胞培养插入物的6 孔培养板中,培养24 h 后取出插入物,用PBS 洗涤孔中细胞,加入2 mL无FBS 的RPMI 培养基和一定浓度的ATB、ATH 分别继续培养12 h、24 h 和48 h,以5 μmol·L-1TAM 处理组为阳性对照(下同),并在0 h、12 h、24 h 和48 h 用倒置显微镜对细胞生长情况进行记录,以监测细胞在培养皿中的迁移情况,并通过软件ImageJ 分析处理组与对照组相比的细胞迁移百分比。
1.2.7 Transwell 侵袭试验
10 μL Matrigel 基质放于聚碳酸酯膜滤膜上,37℃保温2 h 使其凝固;收集培养好的MDA-MB-231 细胞经无FBS 的RPMI 培养基洗3 次并调整细胞浓度为104个·mL-1(200 μL),加入一定浓度ATB、ATH。底部腔室中加入700 μL 含FBS 的RPMI 培养基作为趋化因子。细胞在培养箱中培养24 h 后,用4 ℃甲醇固定滤膜上的细胞15 min,采用Giemsa 染色溶液染色30 min 后用PBS 洗涤若干次。最后,通过显微镜(200×)拍摄照片,并用软件ImageJ 分析细胞数量。
1.2.8 成球试验
将200 μL Matrigel 作为粘性层滴注在6 孔细胞培养板上,并在37 ℃下保温2 h 使其凝固。制备以104个·孔-1(2 mL)MDA-MB-231 细胞接种到RPMI 培养基中,待细胞完全沉降后,用含5%基质凝胶的完全培养基代替RPMI 培养基,培养时间共15 d,每3 d 更换1 次培养基,结束后用PBS 洗涤表面细胞后采用Giemsa 染色溶液染色30 min,最后用PBS 洗涤若干次,自然晾干后在显微镜下记录结果。
1.2.9 数据处理
每项试验均设置3 个重复,使用软件Graphpad prism 5.01 对数据进行统计分析,结果以平均值± 标准差表示,使用ANOVA 方差分析与t 检验对数据进行统计评估,所有统计分析结果中* 表示在P<0.05具有显著性差异。
2 结果与分析
2.1 ITS-RFLP 序列扩增
ITS-PCR 扩增序列经琼脂糖凝胶电泳得到的片段大小约750 bp (图2),对供试菌株的ITS 序列和NCBI 中比对的近20 条序列的遗传距离进行分析(图3)。结果发现,AC001 与AC005 亲缘关系较近,而AC002、AC003、AC004 和AC006 亲缘关系较近。

图1 供试菌株

图2 供试菌株ITS 扩增的PCR 谱带

图3 Neighbor-joining 法构建的ITS 序列系统发育树
酶切结果如图4 所示,不同牛樟芝菌株的条带间并未有明显区别,无法显著区分菌株间差异。
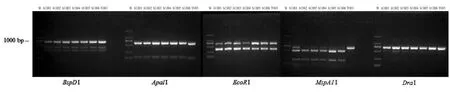
图4 不同限制性内切酶对ITS 序列进行酶切后产物
2.2 BOX-PCR 序列扩增
如图5 所示,采用BOXAIR 引物扩增的条带均在250~2000 bp,不同牛樟芝菌株条带在1500 bp 左右,且与金福菇TO03(CK)菌株条带区别显著。
图5 BOX-PCR 扩增条带凝胶电泳
2.3 ISSR 序列扩增
由图6 可见,从28 条ISSR 常用引物中筛选出扩增条带清晰、重复性好、多态性高的引物,主要包括P1、P4、P5、P13、P14、P23、P24、P25,扩增产物经1%琼脂糖凝胶电泳检测,结果发现,不同引物可以通过条带显著区分不同菌株间差异性,ISSR 扩增多态性谱带采用UPGMA 法进行聚类分析,结果共获得812 条多态性条带,多态性条带比例达41%。表明其遗传多样性较为丰富,牛樟芝菌株与金福菇菌株之间的遗传相似系数为0.34,说明二者亲缘关系较远;6 株牛樟芝菌株之间也存在不同程度的相对亲缘关系,在遗传相似系数0.48 处可聚为3 类,其中AC002、AC003、AC004和AC005 可以聚为一类(图7)。
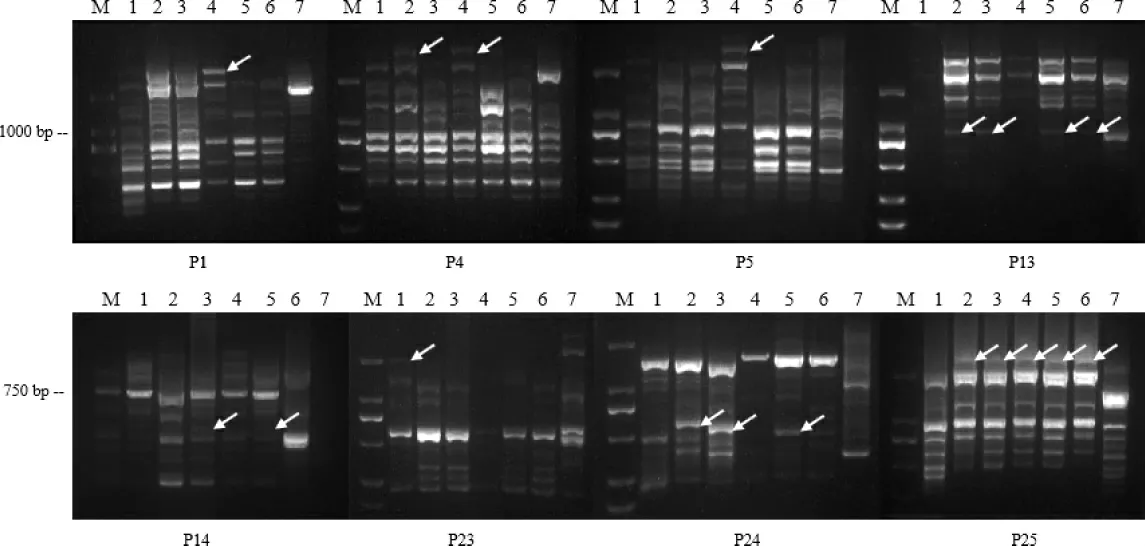
图6 部分ISSR 引物扩增凝胶电泳谱带
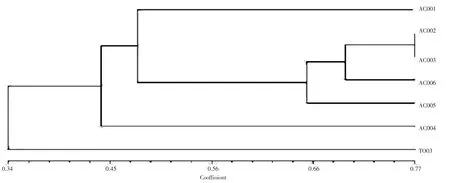
图7 UPGMA 聚类图谱
2.4 Antcin 类化合物对细胞毒性的作用
通过MTT 法分别测定牛樟芝ATB 和ATH 对MDA-MB-231 细胞毒性结果表明,与0.05% DMSO(CK)相比,10 μmol·L-1ATB 处理、40 μmol·L-1ATH处理对细胞毒性的作用无显著性差异(P>0.05),且5 μmol·L-1ATB 处理和20 μmol·L-1ATH 处理菌株在24 h 和72 h 条件下对细胞毒性的作用无显著性差异(P>0.05);当ATB 浓度高于10 μmol·L-1和ATH 高于5 μmol·L-1时,细胞活力在72 h 内以剂量依赖性方式逐渐降低(P>0.05)。因此,本研究采用5 μmol·L-1ATB和20 μmol·L-1ATH 组合,10 μmol·L-1ATB、40 μmol·L-1ATH 的非细胞毒性浓度进行后续研究(图8)。
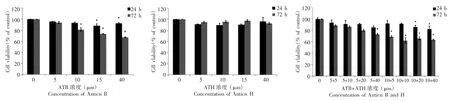
图8 ATB 和ATH 组合模式对MDA-MB-231 细胞毒性的影响
2.5 Antcin 类化合物对细胞迁移的影响
如图9 所示,ATB+ATH 组在48 h 时的闭合面积与0 h 时的相比仅减小13.30%,而与阴性对照组(Neg)相比减小了48.2%(P<0.05),表明2 种化合物共同作用可对MDA-MB-231 细胞迁移起到协同作用。
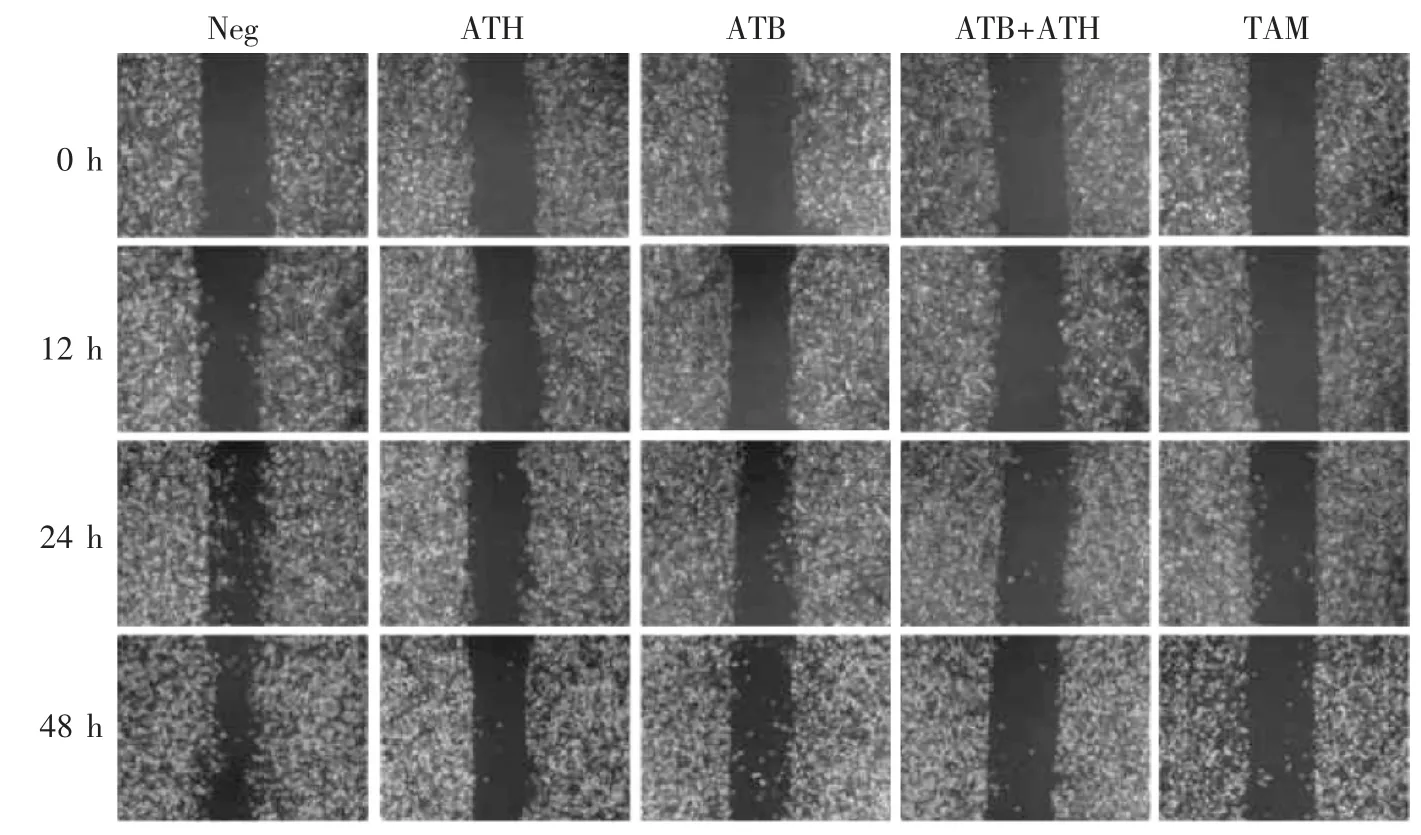
图9 Antcin 类化合物对MDA-MB-231 细胞迁移作用的影响
2.6 Antcin 类化合物对细胞侵袭的影响
与阴性对照组(Neg) 相比,ATB、ATH 和ATB+ATH 均能显著抑制MDA-MB-231 细胞的侵袭能力(图10-a),且ATB+ATH 组与阳性对照组(TAM)无显著性差异(P>0.05)(图10-b)。

图10 ATB 和ATH 化合物对MDA-MB-231 侵袭的抑制作用(24 h)
2.7 Antcin 类化合物对细胞成球作用的影响
如图11 所示,乳腺癌细胞在无任何干预的情况下经培养15 d 后具有显著的成球现象,而通过添加ATB、ATH 和ATB+ATH 均能显著抑制MDA-MB-231细胞的成球,从而抑制癌细胞在体内成瘤。
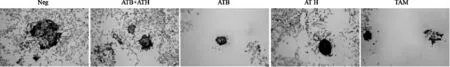
图11 ATB 和ATH 化合物对乳腺癌细胞成球的抑制作用
3 讨论
采用ITS-RFLP、ISSR 和BOX-PCR 技术对收集到的牛樟芝菌株进行分类,其中BOX-PCR 和ISSR 技术能通过特定的引物区分不同菌株间的差异,且研究结果不受生长阶段和形态限制,大大增加了鉴定的准确性和科学性,从分子水平为牛樟芝的准确分类、鉴定提供了科学依据。ITS-RFLP 分子标记技术一般用于鉴定真菌物种及属内物种间系统发育关系,ITS 序列上的5.8 S、18 S 和28 S rRNA 基因具有极大保守性,且绝大多数真核生物在此区域都表现出极为广泛的序列多态性[12],然而限制性内切酶的筛选是该技术的重点,笔者筛选EcoR I、Dra I、BspD I、Apal I、MspA1 I 等常见限制性内切酶对ITS 片段进行处理,由于供试牛樟芝菌株之间相似度较高,所选限制性内切酶难以分辨出明显差异,因此进一步筛选更高效的内切酶用于区分该菌株片段是今后研究重点。Antcin类化合物是牛樟芝中的主要活性物质,对癌细胞增殖、侵袭和转移等均有显著作用[13]。目前,已有研究表明,单一Antcin 类化合物(Antcin A,Antcin C,Antcin K 和Antcin H)对治疗小鼠风湿关节炎、肥胖、脑出血、抗炎症等病症具有显著疗效[14]。然而对于ATB 和ATH 叠加后的协同作用却少有研究,文章对MDAMB-231 中细胞活力、细胞迁移以及细胞侵袭的影响研究表明,ATB+ATH 组在48 h 时的闭合面积与0 h时相比仅减小13.30%,而与阴性处理组相比减小了48.2%(P<0.05);且ATB+ATH、ATB 和ATH 均能显著抑制MDA-MB-231 细胞的侵袭(P<0.05),ATB+ATH与阳性对照组(TAM)无显著性差异(P>0.05),能显著抑制MDA-MB-231 细胞的成球,从而抑制癌细胞在体内成瘤,因此,ATB+ATH 协同作用能有效抑制乳腺癌细胞的增殖。生物活性化合物通过对免疫系统的有益作用以及对癌细胞的直接细胞毒性作用,对癌症治疗产生间接影响,从而有效抑制癌细胞的黏附、迁移和侵袭[15]。
4 结论
通过多种DNA 分子标记技术开展牛樟芝种质资源研究,规范菌种市场显得尤其重要。本研究收集了6株牛樟芝菌株并对其进行亲缘分析;从中分离出的牛樟芝Antcin 类化合物ATB 和ATH 对乳腺癌细胞的转移、侵袭等具有显著抑制作用,能为其在动物试验和临床应用提供理论依据。
致谢:感谢中国台湾中兴大学树木代谢组学和天然药物开发实验室王升陽教授、Kumar 博士和王雅昀博士对本研究细胞实验进行指导。

