hnRNPA2B1通过抑制转铁蛋白受体增强胰腺癌细胞对铁死亡的抵抗
李政, 刘雅雯, 陈家希, 王慧之, 于正悦, 王舜宇, 龚爱华, 徐岷
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 泰兴市人民医院消化科, 江苏 泰兴 225400; 3. 江苏大学附属医院消化科, 江苏 镇江 212001)
在我国,胰腺癌是消化道肿瘤患者中死亡率较高的疾病之一[1],其5年生存率低于10%[2-3]。由于缺乏早期特异性表征,80%~85%胰腺癌患者在确诊时已错过最佳治疗时机。目前胰腺癌的治疗仍以手术为主,但是仅有10%患者有机会接受手术治疗,其预后仍不理想,5年生存率仅20%[1]。此外,患者还可采用放疗与化疗,但是伴有其他基础疾病的老年患者往往不能耐受。目前,新兴疗法如靶向疗法和免疫疗法在胰腺癌的治疗中应用较少[4]。
铁死亡是一种铁依赖性的非凋亡细胞死亡模式,其本质是由脂质过氧化驱动的氧化性细胞死亡[5-7]。Fe3+与转铁蛋白结合后,通过转铁蛋白受体(transferrin receptor,TFRC)进入细胞内,一部分被还原为Fe2+并被释放入胞质的不稳定铁池中[8]。研究表明,由于Fe2+的高反应活性可产生大量羟自由基,其在胞质中的蓄积是铁死亡发生的重要途经之一[9-10]。研究发现,TFRC作为细胞铁摄取蛋白,其介导的铁摄取增加可致癌症干细胞样细胞对Erastin敏感,并导致细胞死亡增加,而干扰TFRC后可逆转该现象[8]。由此提示,TFRC在以诱导铁死亡发生的癌症治疗策略中起重要作用。
异质核核糖核蛋白A2B1(heterogeneous nuclear ribonucleoprotein A2B1,hnRNPA2B1)属异质核糖核蛋白家族成员,是一种RNA结合蛋白,可阅读6-甲基腺嘌呤(m6A)的修饰位点,通过调控RNA代谢的多个过程参与抗病毒免疫、调节多种癌症的进展[11-12]。研究表明,hnRNPA2B1在结肠癌[13]、肺癌[14]和膀胱癌[15]中均作为癌基因发挥作用,在胰腺癌中参与调控上皮间质转换、影响肿瘤对药物的敏感性[16-17]。最新研究显示,一些甲基化酶可决定细胞是否发生铁死亡,如甲基转移酶样蛋白3(methyltransferase-like 3,METTL3)、甲基转移酶样蛋白4(METTL4)和YTH N6-甲基腺苷RNA结合蛋白1(YTH N6-methyladenosine RNA binding protein 1,YTHDF1)等[18]。hnRNPA2B1作为甲基化阅读蛋白,其是否参与调控胰腺癌细胞发生铁死亡尚不清楚。因此,本研究拟探讨hnRNPA2B1对胰腺癌细胞恶性生物学行为的影响,并在此基础上探究其对铁死亡的影响及其潜在机制。
1 材料和方法
1.1 材料
1.1.1 细胞 人胰腺癌PaTu8988、MIA-paca2、PANC1细胞以及人胚肾HEK-293T细胞均由江苏大学医学院细胞生物学研究室液氮罐保存。
1.1.2 主要试剂 DMEM高糖培养基、PBS、超敏ECL发光液购自美伦生物技术有限公司;胎牛血清购自依科赛生物公司;Matrigel胶购自美国BD公司;Trizol裂解液、2×SYBR Green Mix溶液、CCK8试剂盒购自南京诺唯赞科技生物股份有限公司;Lipofectamine 2000试剂、逆转录试剂盒、C11-BODIPY染料检测试剂盒购自美国Thermo Fisher公司;兔抗人溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11/xCT)抗体、β-微管蛋白抗体、铁蛋白重链1(ferritin heavy chain1,FTH1)抗体购自英国Abcam公司;兔抗人hnRNPA2B1抗体、TFRC抗体购自武汉爱博泰克生物科技有限公司;兔抗人谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)抗体购自美国Cell Signaling公司;羊抗兔二抗购自美国Santa Cruz公司;铁死亡挽救剂Ferrostatin-1、坏死挽救剂Necrostatin-1、凋亡挽救剂ZVAD-FMK、Erastin购于美国Med Chem Express公司;hnRNPA2B1过表达质粒和对照质粒以及hnRNPA2B1干扰质粒和对照质粒购自广州基旦生物科技有限公司;4%多聚甲醛、结晶紫、台酚蓝染色液购自北京兰杰柯科技有限公司;丙二醛检测试剂盒、组织铁测定试剂盒购自南京建成生物工程研究所。
1.1.3 主要仪器 超净细胞操作台购自苏州净化设备公司;细胞恒温培养箱、高速低温离心机购自美国Thermo Fisher公司;双目光学细胞显微镜购自日本Nikon公司;多功能酶标仪800TS购自美国Bio Tek公司;流式细胞仪购自美国BD公司;组织匀浆器购自宁波新芝生物科技股份有限公司;SDS-PAGE电泳仪、荧光定量PCR仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 细胞培养 人胰腺癌PaTu8988、MIA-paca2、PANC1细胞以及人胚肾HEK-293T细胞用含10%胎牛血清的DMEM培养于5% CO2,37 ℃的培养箱中。
1.2.2 CCK8法检测不同浓度Erastin处理后的细胞活性 将PaTu8988、MIA-paca2、PANC1细胞以3 000个/孔接种于96孔板,每孔培养基体系为100 μL,在实验孔外圈每孔添加100 μL PBS防止实验孔培养基挥发;次日细胞贴壁后,用吸引器小功率吸去上清液;根据细胞系各自生长习性,添加含不同浓度梯度的Erastin培养基,PaTu8988细胞为0、1.25、2.5、5、10、20 μmol/L,MIA-paca2细胞为0、2、4、8、16、32 μmol/L,PANC1细胞为0、0.5、1、1.5、2、2.5 μmol/L,每组浓度均设3个复孔,孵育72 h;将每孔含Erastin的培养基更换为100 μL CCK8工作液(无血清培养基与CCK8检测试剂体积比为1∶9),设3个空白孔,避光孵育1~4 h;多功能酶标仪检测各孔450 nm处D值,细胞活性(%)=(D当前Erastin浓度-D空白组)/(D0 μmol/L Erastin组-D空白组)×100%。GraphPad Prism 9.0进一步处理所得数据,计算Erastin IC50。
1.2.3 qRT-PCR检测胰腺癌细胞中hnRNPA2B1mRNA相对表达水平 用Trizol提取PaTu8988、MIA-paca2、PANC1细胞总RNA,采用逆转录试剂盒行逆转录得到对应cDNA;配置10 μL PCR反应体系:4.1 μL DEPC水、5 μL 2×SYBR Green Mix、上下游引物各0.2 μL、0.5 μL cDNA,振荡混匀瞬时离心后置于PCR仪中,反应程序为95 ℃预变性3 min,95 ℃变性10 s,58 ℃退火30 s,72 ℃ 延伸30 s,共40个循环;根据NCBI查找的基因序列设计引物,hnRNPA2B1上游引物为5′-TGGAGGTAGCCCCGGTTATG-3′,下游引物为5′-GGACCGTAGTTAGAAGGTTGCT-3′;将β-肌动蛋白设为内参,以2-ΔΔCt计算hnRNPA2B1mRNA相对表达量,每个样本设3个复孔,实验独立重复3次。
1.2.4 蛋白免疫印迹法检测胰腺癌细胞中hnRNPA2B1蛋白表达 2×SDS上样缓冲液、β-巯基乙醇、蛋白酶抑制剂、苯甲基磺酰氟(phenylmethylsulfonyl,PMSF)按照100∶10∶1∶1的比例制备蛋白裂解液,混匀后充分裂解胰腺癌PaTu8988、MIA-paca2、PANC1细胞;刮取总蛋白置于EP管中,100 ℃煮沸10 min;12 000 ×g离心10 min,取上清液;配置10% SDS-PAGE分离胶,泳道中加入蛋白,55 V电泳50 min,75 V电泳60 min;300 mA转膜150 min将蛋白转至PVDF膜;5%脱脂奶粉室温封闭1 h;一抗(hnRNPA2B1抗体、β-微管蛋白抗体均1∶2 000稀释)4 ℃孵育过夜;次日TBST室温洗膜3次,每次7 min;室温孵育二抗(1∶10 000稀释)1 h;TBST室温洗膜3次,每次7 min;借助ECL发光液使蛋白条带在电子凝胶成像仪中显影,Image J 5.0对所得图片进行灰度分析。
1.2.5 生物信息学分析 通过基因表达在线分析平台GEPIA(http://gepia.cancer-pku.cn/index.html)分析hnRNPA2B1在胰腺癌和正常胰腺组织中的表达水平,筛选条件“gene:hnRNPA2B1”,“Datasets:PAAD”,“Matched Normal data:Match TCGA normol and GTEx data”,“Log Scale:Yes”,“Jitter Size:0.4”;通过数据集GSE85916筛选70个胰腺癌患者样本,根据hnRNPA2B1表达水平,选取50%处为截断值,将样本分为高表达组(n=35)和低表达组(n=35),采用Kaplan-Meier算法进行生存分析。
1.2.6 构建稳定转染细胞系
1.2.6.1 病毒包装 将人胚肾HEK-293T细胞接种于6孔板中,使其贴壁后细胞密度为6孔板单孔的40%~60%;配置病毒包装液,5 μL PEI转染试剂与100 μL无血清培养基混匀作为PEI管,0.75 μg psPAX2质粒、0.25 μg pMD2.G质粒、1 μg目的质粒(sh-Control质粒、sh-hnRNPA2B1质粒、Vector质粒、Flag-hnRNPA2B1质粒)与100 μL无血清培养基混匀作为质粒管,瞬时离心后静置5 min;将PEI管和质粒管混匀,瞬时离心后静置25 min得到200 μL转染复合物;弃培养基,重新加入2 mL含10%血清的培养基,将转染复合物滴入对应的孔,轻微晃动混匀,置于细胞培养箱孵育;48 h后收取上清液,8 000×g离心10 min,取上清液置于-80 ℃保存备用。
1.2.6.2 转染细胞 根据hnRNPA2B1基础表达量的高低选择在PaTu8988细胞中转染干扰质粒,PANC1细胞中转染过表达质粒;将PaTu8988细胞分为空载组(sh-Control)、干扰质粒组(sh-hnRNPA2B1)和裸细胞组,PANC1细胞分为空载组(Vector)、过表达质粒组(Flag-hnRNPA2B1)和裸细胞组,接种于6孔板中,接种密度同“1.2.6.1”;次日按照以下比例配置培养基:10%血清培养基1 mL、病毒液1 mL、聚凝胺2 μL;24 h后,重复第2天步骤更换培养基;第4天开始根据质粒所带抗性在含10%血清培养基中加入嘌呤霉素筛选成功转染的细胞,根据细胞状态从1 ng/L逐渐加大嘌呤霉素浓度筛选,直至裸细胞组细胞全部死亡。
1.2.6.3 验证感染效率 取“1.2.6.2”成功转染细胞即sh-Control组、sh-hnRNPA2B1组和Vector组、Flag-hnRNPA2B1组,提取总RNA、蛋白,分别通过qRT-PCR、蛋白免疫印迹法验证效率,具体方法同“1.2.3”、“1.2.4”。
1.2.7 细胞表型实验检测hnRNPA2B1对胰腺癌细胞生物学行为的影响
1.2.7.1 细胞增殖实验 将成功转染干扰质粒的PaTu8988细胞即sh-Control组、sh-hnRNPA2B1组和成功转染过表达质粒的PANC1细胞即Vector组、Flag-hnRNPA2B1组共4组细胞以1 000个/孔接种于96孔板,每组设置3个复孔,实验孔外圈每孔添加100 μL PBS防止实验孔培养基挥发,24 h细胞贴壁后将培养基更换为CCK8工作液,置于培养箱中孵育40 min后检测各组细胞活性。
1.2.7.2 迁移实验 将成功转染干扰质粒的PaTu8988细胞即sh-Control组、sh-hnRNPA2B1组和成功转染过表达质粒的PANC1细胞即Vector组、Flag-hnRNPA2B1组共4组细胞接种于Transwell小室内,每孔8×104个细胞,小室内为100 μL无血清培养基,小室外加500 μL含10%血清培养基,每组设置3个复孔,孵育14 h;弃培养基,PBS清洗3次;4%多聚甲醛室温固定30 min;PBS清洗3次;结晶紫染液室温染色20 min;PBS清洗3次;用棉签轻轻擦除小室内面残留结晶紫,晾干拍照。
1.2.7.3 侵袭实验 提前将基质胶铺于Transwell小室内,置于培养箱中至少30 min,基质胶凝固后吸去多余培养基;由于基质胶黏稠,以基质胶∶无血清培养基体积比=1∶25比例稀释,每孔稀释后的基质胶最终所加体系为100 μL;将成功转染干扰质粒的PaTu8988细胞即sh-Control组、sh-hnRNPA2B1组和成功转染过表达质粒的PANC1细胞即Vector组、Flag-hnRNPA2B1组共4组细胞接种于Transwell小室内,细胞接种、固定、染色、拍照具体方法同“1.2.7.2”。
1.2.8 台酚蓝染色检测细胞活性 将成功转染干扰质粒的PaTu8988细胞根据所接受的药物处理进行分组:sh-Control组,sh-Control+Erastin(18.020 μmol/L)组,sh-hnRNPA2B1组,sh-hnRNPA2B1+Erastin(18.020 μmol/L)组,sh-hnRNPA2B1+Erastin(18.020 μmol/L)+Ferrostatin-1(1 μmol/L)组,sh-hnRNPA2B1+Erastin(18.020 μmol/L)+ZVAD-FMK(5 μmol/L)组,sh-hnRNPA2B1+Erastin(18.020 μmol/L)+Necrostatin-1(2.5 μmol/L)组;各组细胞与药物共孵育72 h;收集培养皿底贴壁活细胞和漂浮的死细胞,PBS重悬;取100 μL细胞重悬液与100 μL 0.4%台酚蓝染液,混匀,室温染色5 min;镜下分别对活细胞(未染成蓝色)及死细胞(染成蓝色)计数,计算细胞存活率;成功转染过表达质粒的PANC1细胞以同样的方法进行分组并计算药物处理后各组细胞存活率。细胞存活率(%)=(细胞总数-蓝色细胞数)/细胞总数×100%。
1.2.9 脂质过氧化物含量的检测 将成功转染干扰质粒的PaTu8988细胞即sh-Control组、sh-hnRNPA2B1组和成功转染过表达质粒的PANC1细胞即Vector组、Flag-hnRNPA2B1组共4组细胞分别予以对照(0 μmol/L Erastin)和Erastin(PaTu8988细胞:18.020 μmol/L;PANC1细胞:2.947 μmol/L)处理72 h;各组细胞中加入无血清DMEM配置的2 μmol/L C11-BODIPY染料工作液,于培养箱中避光孵育30 min;室温800 r/min离心5 min;根据细胞量加入适量含2%血清的PBS重悬,避光置于冰上;选择FITC通道进行流式分析,所得数据采用Flow 10软件处理并计算出各组平均荧光强度。
1.2.10 丙二醛含量检测 取“1.2.9”处理72 h的4组细胞;根据细胞数加入适量PBS,收集细胞于组织匀浆器中以300 W功率破碎得到细胞匀浆,每次超声3~5 s,间隔30 s,重复4~5次,超声前将转子置于-80 ℃冰箱预冷,防止破碎过程中温度过高;采用丙二醛测试盒制备各组待检样品;取各组待检样品1.5 mL至比色皿中,置于分光光度计中测定532 nm处D值;结合蛋白浓度,计算丙二醛含量。丙二醛含量(nmol/mL)=(测定D值-空白D值)/(标准D值-空白D值)×标准品浓度(10 nmol/mL)×待测样本蛋白浓度(mgprot/mL)。
1.2.11 组织中铁含量测定 取“1.2.9”处理72 h的4组细胞;按“1.2.10”制备细胞匀浆;采用组织铁测定试剂盒制备各组待检样品;取各组待检1.5 mL至比色皿中,置于分光光度计中测定520 nm处D值;结合蛋白浓度,计算组织中铁含量。铁含量(mg/gprot)=(D测定-D空白)/(D标准-D空白)×标准品浓度(2 mg/mL)/待测样本蛋白浓度(mgprot/mL)。
1.2.12 qRT-PCR检测TFRC、FTH1、GPX4、xCTmRNA相对表达水平 取“1.2.6.2”成功感染细胞即sh-Control组、sh-hnRNPA2B1组和Vector组、Flag-hnRNPA2B1组,提取总RNA,具体方法同“1.2.3”。
1.2.13 蛋白免疫印迹法检测TFRC、FTH1、GPX4、xCT蛋白表达量 取“1.2.6.2”成功转染细胞即sh-Control组、sh-hnRNPA2B1组和Vector组、Flag-hnRNPA2B1组,提取总蛋白,具体方法同“1.2.4”。
1.3 数据处理与统计分析
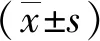
2 结果
2.1 不同胰腺癌细胞系中Erastin IC50与hnRNPA2B1表达量
根据不同浓度Erastin处理后的细胞活性,计算出PaTu8988、MIA-paca2、PANC1细胞的IC50分别为18.020、15.760、2.947 μmol/L(图1A-C)。qRT-PCR和蛋白免疫印迹结果显示,在mRNA和蛋白水平上,PaTu8988细胞中hnRNPA2B1表达量最高,MIA-paca2细胞次之,PANC1细胞中表达量最低(图1D-E,F值分别为36.43,478.90,P均<0.05)。3种胰腺癌细胞对Erastin诱导铁死亡的抵抗能力与各自hnRNPA2B1的表达水平成正相关。由此,选择PaTu8988细胞转染sh-Control、sh-hnRNPA2B1质粒行干扰实验,Erastin浓度为18.020 μmol/L;选择PANC1细胞转染Vector、Flag-hnRNPA2B1质粒行过表达实验,Erastin浓度为2.947 μmol/L。

*:P<0.05,与0 μmol/L Erastin组相比;#:P<0.05,与PaTu8988细胞相比;A-C:CCK8法分别检测Erastin处理后胰腺癌PaTu8988、MIA-paca2、PANC1细胞活性;D:qRT-PCR检测hnRNPA2B1 mRNA相对表达量;E:蛋白免疫印迹法检测hnRNPA2B1蛋白相对表达量
2.2 hnRNPA2B1在胰腺癌中的表达和生存分析
通过GEPIA在线网站分析TCGA和GTEx数据库,其中胰腺癌患者179例,健康对照者171例,与正常组织相比,hnRNPA2B1在肿瘤组织中表达明显升高(图2A,P<0.05)。通过GEO在线数据库下载GSE85916数据集并分析,hnRNPA2B1高表达组胰腺癌患者总体存活率明显低于低表达组(图2B,P=0.018)。由此表明,胰腺癌患者hnRNPA2B1表达量与其不良预后呈正相关。

*:P<0.05;A:GEPIA分析胰腺癌组织和正常胰腺组织中hnRNPA2B1相对表达量;B:hnRNPA2B1高表达组和低表达组胰腺癌患者生存曲线
2.3 hnRNPA2B1增强胰腺癌细胞的恶性生物学行为
与sh-Control组相比,sh-hnRNPA2B1组细胞迁移和侵袭能力明显减弱(图3A,t=13.92,26.81,P均<0.05),细胞增殖活力自第4天开始显著降低(图3B,P均<0.05)。与Vector组相比,Flag-hnRNPA2B1组细胞迁移和侵袭能力明显增强(图3C,t=13.55,11.62,P均<0.05),增殖活力自第3天开始显著增加(图3D,P均<0.05)。由此表明,hnRNPA2B1促进胰腺癌细胞的生物学行为向恶性转化。

*:P<0.05;#:P<0.05,与相应的对照组相比;A、C:Transwell实验分别检测hnRNPA2B1对胰腺癌PaTu8988、PANC1细胞迁移和侵袭能力的影响(×200);B、D:细胞增殖实验分别检测hnRNPA2B1对胰腺癌PaTu8988、PANC1细胞增殖能力的影响
2.4 下调hnRNPA2B1表达增强胰腺癌PaTu8988细胞对铁死亡的敏感性
qRT-PCR和蛋白免疫印迹结果显示,与sh-Control组相比,sh-hnRNPA2B1组hnRNPA2B1mRNA和蛋白相对表达量均显著降低(图4A-B,P均<0.05)。经Erastin处理后,与sh-Control组相比,sh-hnRNPA2B1组细胞活性明显降低,脂质过氧化物、丙二醛和铁含量明显增加(图4C-F,P均<0.05)。sh-hnRNPA2B1组经Erastin处理后加入Ferrostatin-1、ZVAD-FMK或Necrostatin-1进行挽救,只有加入Ferrostatin-1组的细胞活性明显升高(图4C,t=9.52,P<0.05),说明抑制hnRNPA2B1表达可通过诱导发生铁死亡致细胞活性下降,而非诱导发生凋亡或坏死。由此可见,抑制hnRNPA2B1表达后,胰腺癌细胞对铁死亡的敏感性增加。
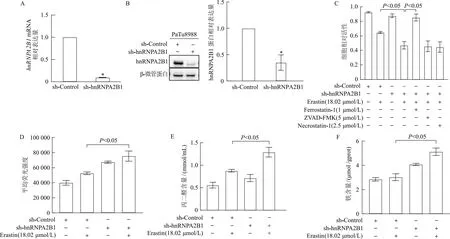
*:P<0.05,与sh-Control组相比;A:qRT-PCR检测hnRNPA2B1 mRNA相对表达量;B:蛋白免疫印迹法检测hnRNPA2B1蛋白相对表达量;C:台酚蓝染色法检测不同药物处理后细胞活性;D:流式细胞术检测脂质过氧化物含量;E:比色法检测丙二醛含量;F:比色法检测铁含量
2.5 上调hnRNPA2B1表达增强PANC1细胞对铁死亡的抵抗
qRT-PCR和蛋白免疫印迹结果显示,与Vector组相比,Flag-hnRNPA2B1组hnRNPA2B1mRNA和蛋白相对表达量均明显升高(图5A-B,t=13.92,11.14,P均<0.05)。经Erastin处理后,与Vector组相比,Flag-hnRNPA2B1组细胞活性明显上升,脂质过氧化物、丙二醛和铁含量明显降低(图5C-F,P均<0.05)。Flag-hnRNPA2B1组经Erastin处理后加入Ferrostatin-1、ZVAD-FMK或Necrostatin-1进行挽救,只有加入Ferrostatin-1组细胞活性明显升高(图4C,t=6.92,P<0.05),说明增加hnRNPA2B1表达可通过抵抗铁死亡发生致细胞活性升高,而非凋亡或坏死。由此可见,增加hnRNPA2B1表达可增强胰腺癌细胞对铁死亡的抵抗。

*:P<0.05,与Vector组相比;A:qRT-PCR检测hnRNPA2B1 mRNA相对表达量B:蛋白免疫印迹法检测hnRNPA2B1蛋白相对表达量;C:台酚蓝染色法检测不同药物处理后细胞活性;D:流式细胞术检测脂质过氧化物含量;E:比色法检测丙二醛含量;F:比色法检测铁含量
2.6 hnRNPA2B1抑制胰腺癌细胞TFRC表达
qRT-PCR和蛋白免疫印迹结果显示,与sh-Control组相比,sh-hnRNPA2B1组TFRC、FTH1mRNA和蛋白相对表达量均明显升高(图6A-B,P均<0.05),GPX4、xCTmRNA和蛋白相对表达量变化差异均无统计学意义;与Vector组相比,Flag-hnRNPA2B1组TFRC、FTH1mRNA和蛋白相对表达量均明显降低(图6C-D,P均<0.05),GPX4、xCTmRNA和蛋白相对表达量变化差异均无统计学意义。由此表明,hnRNPA2B1并非通过抗氧化体系(谷胱甘肽系统)调控胰腺癌细胞的铁死亡抵抗,而是通过TFRC调控胰腺癌细胞的铁代谢使之发生铁死亡抵抗。

*:P<0.05,与各自对应的对照组相比;A、C:qRT-PCR检测铁死亡相关mRNA相对表达量;B、D:蛋白免疫印迹法检测铁死亡相关蛋白相对表达量
3 讨论
Erastin作为铁死亡诱导剂的一种,可以通过多种分子如胱氨酸-谷氨酸转运受体、电压依赖的阴离子通道和p53等诱导细胞发生铁死亡从而特异性杀死肿瘤细胞[19]。本研究发现,与低表达hnRNPA2B1的胰腺癌PANC1细胞相比,高表达hnRNPA2B1的胰腺癌PaTu8988细胞对Erastin的抵抗力更强,提示hnRNPA2B1可能参与调控胰腺癌细胞对铁死亡的易感性。同时,生物信息学分析以及相关功能学实验结果显示,hnRNPA2B1在胰腺癌的进展中发挥促癌作用。研究表明,hnRNPA2B1可通过多种机制促进多种肿瘤的恶性进展,如增强Lin28B表达促进卵巢癌细胞增殖,介导淋巴结转移相关转录物2(LNMAT2)包装成外泌体促进膀胱癌的转移等[20-21],但其对肿瘤细胞铁死亡的影响仍不明确。
脂质过氧化物作为铁死亡过程的终末产物[6],是检测铁死亡的金指标。本研究结果显示,抑制hnRNPA2B1mRNA和蛋白表达,细胞中脂质过氧化物含量均明显增加,过表达hnRNPA2B1则反之,表明hnRNPA2B1可介导胰腺癌细胞对铁死亡的抵抗。肿瘤细胞的生长、增殖需要大量的铁,大多数肿瘤细胞表现出TFRC表达上调,如肝癌细胞[8,22]。但是,本研究结果显示,hnRNPA2B1通过负性调控TFRC表达,限制人胰腺癌PaTu8988、PANC1细胞的铁摄取从而引起铁死亡抵抗,表明TFRC表达调控肿瘤细胞对氧化应激的敏感性,与既往研究结果相符,即铁死亡过程依赖铁[10,23-24]。同时,FTH1作为一种储铁蛋白,在干扰或者过表达hnRNPA2B1后,其表达量变化趋势与TFRC相同,但变化幅度小于TFRC,提示FTH1表达变化可能是肿瘤细胞基于hnRNPA2B1/TFRC轴引起的胞内铁含量变化的一种反馈性调节。hnRNPA2B1对胞内总铁含量的调控在一定程度上解释了差异性表达hnRNPA2B1的胰腺癌细胞对铁死亡敏感性的不同。胞内铁以氧化态的Fe3+和还原态的Fe2+两种形式存在,而参与芬顿反应生成细胞内活性氧,诱发铁死亡的是还原态Fe2+[25],所以,作为抵抗铁死亡发生的因子——hnRNPA2B1是否能在限制铁摄取的同时进一步保证胞内铁离子以Fe2+形式大量存在有待进一步证实。
TFRC作为细胞内铁稳态的关键调控因子,其介导的铁死亡抵抗是发生癌变的主要原因之一[26]。以往研究发现,针对TFRC表达的调控可从多个水平进行,Mycn原癌基因与TFRC启动子结合从转录水平调控其表达,增强神经细胞瘤细胞对铁死亡的敏感性[27];环状RNA RAP鸟嘌呤核苷酸交换因子5阻断RNA结合fox-1同系物2与TFRC前体RNA的结合,从转录后水平介导其选择性剪接,增强子宫内膜癌细胞对铁死亡的抵抗[28];含有E3泛素蛋白连接酶的β-转导蛋白重复序列介导TFRC泛素化降低其蛋白稳定性,增强肝癌细胞对铁死亡的抵抗[26]。本研究中hnRNPA2B1表达在mRNA和蛋白水平的下调均促进TFRC表达,过表达则反之。研究表明,hnRNPA2B1可识别并结合RNA特定序列,参与其降解、加工和翻译等[12]。由此推测,hnRNPA2B1可能从转录后水平介导对TFRC的负性调控,具体机制有待进一步研究。
综上所述,hnRNPA2B1抑制TFRC表达,限制铁摄取从而引起胰腺癌细胞对铁死亡的抵抗。但是,hnRNPA2B1负性调控TFRC表达的具体机制有待进一步研究。作为最广泛的程序性死亡方式之一,铁死亡在癌症治疗中潜力大,对于高表达hnRNPA2B1的胰腺癌患者,可予以靶向hnRNPA2B1的抗癌治疗。

