ELP-SOD融合蛋白的纯化及其脂质体制备
朱月蓉, 陈星宇, 冯娇燕, 周奔, 樊燕蓉
(1. 东部战区总医院检验科, 江苏 南京 210002; 2. 南京理工大学环境与生物工程学院, 江苏 南京 210014)
超氧化物歧化酶(superoxide dismutase,SOD)是一类广泛存在于生物界的金属酶类,根据其活性中心结合的金属离子不同,主要可分为Cu/Zn-SOD、Mn-SOD和Fe-SOD,人类的细胞质中以Cu/Zn-SOD为主要种类。SOD具有催化超氧阴离子自由基发生歧化反应,平衡机体内氧自由基的功能,是生物体防御活性氧毒害的关键性防线。SOD较强的抗氧化特性使其在抗辐射、抗衰老、抑制肿瘤等方面具有独特的功能[1],在医药[2]、食品[3]和化妆品[4]领域亦有较好的应用前景。
最初生产的SOD蛋白大都源自动植物组织,但存在提取工艺相对复杂、产率低、品质不稳定、生产成本较高、有免疫原性等问题[5-6]。欧洲已从1999年禁止动物源SOD用于人类,这推动了从基因工程菌中获得重组人源SOD的研究。目前重组人源SOD已成功在大肠埃希菌[7-10]、毕赤酵母[11-12]等表达系统中表达,Lin等[9]将重组人源SOD克隆到表达载体,利用大肠埃希菌进行表达,产量为5.9 mg/L培养基。由于以往重组人源SOD蛋白表达量不高,且纯化过程通常需要结合亲和层析、分子排阻等系列的层析方法,对纯化实验设备要求高,操作较为复杂,因此,开发高效、可行的生产系统以获得高产量及高活性的人源SOD受到了广泛关注。
类弹性蛋白多肽(elastin-like polypeptides,ELP)是一种人工合成的基因工程化多肽聚合物,主要是(VPGXG)n五肽重复序列[13],其中Xaa(X)指除了脯氨酸外的氨基酸[14],通常为缬氨酸、丙氨酸、甘氨酸等氨基酸,Xaa(X)可以由除了脯氨酸外的单一氨基酸组成,也可以由上述几种氨基酸以不同比例组成,重复单元n通常为20~120不等。ELP蛋白单独或与外源蛋白在N端或C端形成融合蛋白表达时具有相转变特性,即达到一定温度时ELP蛋白或ELP融合蛋白能发生从溶液到凝聚态的可逆转变,随着体系降低到一定温度,则又能恢复溶液态[15]。因此,利用ELP融合蛋白可逆的温度相变特性,通过简单离心就能分离重组蛋白,实现重组蛋白的可逆相变循环(inverse transition cycling,ITC)非色谱纯化[16],这种蛋白纯化方法有着经济高效的显著优势,因而广泛应用于蛋白纯化标签[17-18]。
基于ELP融合蛋白的可逆热相变性特性,本研究采用基因工程法生产一种由ELP与人源Cu/Zn-SOD连接的ELP-SOD融合蛋白,经过三轮ITC获得纯化人源重组Cu/Zn-SOD,研究了该融合蛋白的稳定性、模拟了体内半衰期和细胞毒性,并且结合脂质体包裹技术,制备了ELP-SOD脂质体,分析了脂质体包裹后ELP-SOD的半衰期及透皮效率。
1 材料与方法
1.1 材料
1.1.1 菌株来源 构建质粒pET28a-SOD-ELP40,并导入大肠埃希菌BL21·DE3中进行表达[18],筛选鉴定阳性表达菌株。
1.1.2 试剂 IPTG、考马斯亮蓝R-250购自生兴生物技术有限公司;EGTA、PEG-8000购自生工生物工程股份有限公司;邻苯三酚购自上海百灵威化学技术有限公司;RPMI细胞培养基、DMEM低糖培养基购自美国Hyclone公司;胎牛血清购自德国Capricorn公司;卵磷脂、胆固醇购自美国Sigma-Aldrich公司。
1.1.3 试剂配制 PBS(1 L):氯化钠8 g,氯化钾0.2 g,十二水合磷酸氢二钠3.49 g,磷酸二氢钾0.2 g,用超纯水溶解并定容至1 L,用0.1 mol/L盐酸调pH至7.4;LB培养基(1 L):氯化钠5 g,胰蛋白胨10 g,酵母提取物5 g,用超纯水溶解补水至1 L。大肠埃希菌裂解液(1 L):20 mL PBS(pH 7.2),29.2 g氯化钠,2.5 mL Tween-20,0.7 mL β-巯基乙醇,20 mL EDTA(0.5 mol/L,pH 8.0),20 mL EGTA(0.5 mol/L,pH 7.0),用超纯水溶解并定容至1 L。
1.1.4 仪器与设备 超声波细胞粉碎机购自宁波新芝生物科技股份有限公司;凝胶成像系统购自上海天能生命科学有限公司;多功能酶标仪购自瑞士TECAN公司;紫外分光光度计购自上海美析仪器有限公司;二氧化碳培养箱购自日本SANYO公司;荧光倒置显微镜购自日本OLYMPUS公司;旋转蒸发仪购自上海市爱朗仪器有限公司;纳米粒度仪ZS90购自马尔文仪器有限公司;TP-6透皮扩散仪购自天津市精拓仪器科技有限公司。
1.2 重组人源SOD的表达及鉴定[18]
委托南京金斯瑞生物科技有限公司提前合成ELP[H33V7] 40基因预先插在pET28a载体的BamH Ⅰ和Xho Ⅰ之间;其中,ELP[H33V7] 40的N端含有N10,C端含有R9,形成pET28a-N10-ELP40-R9(pET28a-ELP40)载体。
委托南京金斯瑞生物科技有限公司合成SOD(Cu/Zn-SOD,EC 1.15.1.1,GenBank:AY049787)的PCR引物(内有NdeⅠ或BamH Ⅰ酶切位点)。PCR条件为95 ℃预变性5 min;95 ℃变性25 s,56 ℃退火30 s,72 ℃延伸25 s,循环30次;72 ℃延伸10 min,10 ℃保温。PCR引物序列上游:5′-CGCCATATGGCGACGAAGGCCGTGTGCG-3′,下游:5′-CGCGGATCCCTGCGCAATACCGATAACGCCG-3′。
分别将SOD基因的PCR产物与pET28a-ELP40载体通过NdeⅠ和BamH Ⅰ双酶切和试剂盒纯化,按照NEB公司的M2200S Quick ligation kit说明书分别连接SOD的PCR酶切产物和含有ELP[H33V7] 40的pET28a-ELP40载体的双酶切产物,按照试剂盒说明书连接,通过导入DH5α感受态,37 ℃卡那霉素抗性平板菌落培养,挑取单克隆菌落于3 mL含有终浓度为50 μg/mL的卡那霉素的普通LB培养液37 ℃摇菌过夜,PCR鉴定单克隆菌阳性后,用质粒提取试剂盒提取表达质粒,酶切鉴定阳性后,质粒为pET28a-ELP40-SOD。
提取质粒,转导到大肠埃希菌表达菌BL21·DE3感受态,挑取单克隆菌,在15 mL试管中加入3 mL含有终浓度为50 μg/mL的卡那霉素的普通LB培养液37 ℃摇菌过夜;然后在50 mL试管中加入10 mL含有终浓度为50 μg/mL的卡那霉素的普通LB培养液,加入0.5 mL菌液37 ℃摇菌2~3 h,当光密度(D)值达到0.4~0.6时,加入1 mmol/L的IPTG 37 ℃摇菌表达4 h,或先将菌液降温至15 ℃,再加入1 mmol/L的IPTG 15 ℃摇菌表达16 h。分别收集1 mL表达菌,8 000 r/min离心5 min,加入100 μL电泳缓冲液,超声破碎,100 ℃加热10 min,离心,分别收集全菌液、沉淀和上清液。SDS-PAGE电泳鉴定表达菌中ELP-SOD融合蛋白表达分子量和表达量。
1.3 ELP-SOD融合蛋白的纯化及酶活性测定
取200 μL携带目的蛋白基因(质粒为pET28a-ELP40-SOD)的高表达大肠埃希菌(-80 ℃冷冻)接种于500 mL LB培养基中,37 ℃、140 r/min摇床培养20 h,以2%的接种量转接于1 L的LB培养基,37 ℃培养至D(600 nm)达到0.6,加入1 mmol/L的IPTG 37 ℃摇菌表达4 h后收取发酵液。
粗酶液提取:培养好的发酵液以3 000 r/min离心20 min,收集菌泥,加3倍体积的大肠埃希菌裂解液溶解一定时间,进行1次超声-冻融循环,即超声一次(750 W,10 min),-80 ℃冷冻,取出溶解,13 000 r/min离心20 min,收集上清液,保存于-80 ℃冰箱。此上清液即为粗酶提取液。
ITC纯化蛋白:取适量粗酶液加入1.5 mol/L NaCl,4 ℃冰浴1 h;13 000 r/min、4 ℃离心20 min,取上清液,加20 mg/mL PEG-8000,37 ℃水浴20 min;13 000 r/min、37 ℃离心20 min,弃上清液,沉淀加适量PBS溶解,此为1个循环,总共循环3次。
ELP-SOD纯度检测:对纯化的酶液进行SDS-PAGE,通过Tanon3500凝胶成像系统扫描得到电泳图片,并利用Image studio软件对电泳图片进行条带纯度分析。
ELP-SOD酶活性测定:采用改良的邻苯三酚自氧化法(325 nm法)测定SOD融合蛋白的酶活性。酶活单位定义:在一定条件下,1 mL的反应液中,每分钟控制邻苯三酚在325 nm波长处的自氧化速率达50%时的酶量定为一个活力单位,测得数据按下列公式计算酶活性:

A1:邻苯三酚自氧化速率,单位为D/min;A2:加入SOD酶液后的自氧化速率,单位为D/min;a:邻苯三酚的用量(mL);b:SOD酶液的用量(mL)。
1.4 ELP-SOD融合蛋白的pH稳定性测定
将10 mmol/L PBS用NaOH或HCl溶液分别调pH至3.0、5.0、7.0、7.4、8.0、9.0、11.0,纯化所得的酶液用不同pH的PBS进行10倍稀释,每个pH梯度设置3个平行,于25 ℃水浴锅温育2 h后测定各组酶活[19],以pH 7.4的PBS稀释处理的酶液作为初始酶活,得到酶活保留率与溶液pH的关系曲线。
1.5 ELP-SOD融合蛋白的热稳定性测定
将纯化所得的酶液取适量分别于25 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃水浴30 min后[20],冷却至室温,测定各组酶活,每个温度梯度设置3个平行,以25 ℃水浴30 min的酶液为初始酶活,得到酶活保留率与温度的关系曲线。
1.6 添加Cu2+/Zn2+后ELP-SOD酶活性测定
将纯化的ELP-SOD蛋白与最佳终浓度的Cu2+/Zn2+(Cu2+浓度为0.90 mmol/L、Zn2+浓度为0.45 mmol/L)混合,蛋白的终浓度为0.04 mg/mL,每组设3个平行,4 ℃反应1、2、4、10、16 h时取样用邻苯三酚法测定ELP-SOD酶活。之后,取5 mL酶液于透析袋(8 000~14 000 Da)中,冰浴透析,4 h换1次液,同时取透析袋内蛋白溶液0.3 mL,测定蛋白溶液中剩余Cu2+浓度,直至达到标准后停止透析。测定透析前后SOD-ELP的酶活,分析透析过程对SOD-ELP酶活的影响。
1.7 ELP-SOD融合蛋白的模拟体内半衰期[21]
SPF级SD大鼠进行股动脉取血,以大鼠血浆进行模拟体内半衰期实验。实验分3组,实验组为ELP-SOD(0.25 mg/mL),阳性对照组为纯化SOD蛋白(购自杭州纽龙生物科技有限公司,0.25 mg/mL),空白对照组为PBS溶液。实验时每组样品液含有50%大鼠血浆、40% PBS及10%各自对应的蛋白(空白对照组为PBS补足体积),加入后混匀,静置于37 ℃恒温培养箱中培养0、2、4、6、8、10、20、32、48 h后分别取样测定酶活,并按下式计算半衰期[19]:
t1/2:半衰期(酶活力下降为初始酶活的一半所经历的连续工作的时间,单位为h);E0:初始酶活;E:t时的酶活力。
1.8 ELP-SOD融合蛋白细胞毒性试验
利用MTT法检测ELP-SOD对人脐静脉内皮细胞(HUVEC)和小鼠成纤维细胞(L929)的毒性。HUVEC用含10%胎牛血清的RPMI 1640培养基,L929细胞用含10%胎牛血清的DMEM培养基,分别置于37 ℃、5% CO2浓度的培养箱中进行培养。细胞生长至80%~90%时,用0.25%的胰酶进行消化,1 000 r/min离心5 min收集细胞,PBS洗涤2次,然后用相应的培养基配成5×104个/mL的细胞悬液备用。分别将两种细胞悬液接种于96孔板中,每孔100 μL,于37 ℃、5% CO2条件下培养24 h。
吸去原培养液,用PBS清洗1次,每孔加入100 μL用培养基(含2.5%胎牛血清)稀释的ELP-SOD蛋白酶液。分为4个浓度梯度,分别为1.5%、3%、6%、12%(对应酶活性分别为10.5、21.0、42.0、84.0 U/mL),每组设置9孔平行样,于37 ℃、5% CO2条件下分别培养24、48、72 h。对照组每孔加100 μL RPMI细胞培养基(含2.5%胎牛血清)。
培养结束后,每孔加入10 μL配置好的MTT溶液(5 mg/mL),放入细胞培养箱继续孵育4 h;吸弃孔内培养液,每孔加入100 μL DMSO,轻轻敲打96孔板框架使其充分溶解,用酶标仪在490 nm处测定D值。增殖抑制率(%)=(空白对照组D值-实验组D值)/空白对照组D值×100%。
1.9 ELP-SOD融合蛋白脂质体制备及包封率测定
薄膜水化法制备ELP-SOD脂质体:将总膜材浓度为9.6 mg/mL的卵磷脂和胆固醇(质量比为2∶1)溶于一定体积氯仿中,30 ℃旋转蒸发除去氯仿,在茄形瓶内壁形成一层均匀的脂膜,加入一定体积ELP-SOD融合蛋白(0.25 mg/mL,溶于pH 6.8的PBS中),在37 ℃水浴下水化一段时间,所制得的ELP-SOD脂质体用超声细胞破碎仪在260 W条件下超声10 min,接着依次滤过0.45 μm滤器和0.22 μm滤器,4 ℃无菌保存备用。经ZS90纳米粒度仪测量ELP-SOD脂质体的平均粒径、电位和聚合物分散性指数(PDI),以衡量ELP-SOD脂质体的大小、电荷量和均一度。
ELP-SOD脂质体酶活包封率的测定:取一定体积的ELP-SOD脂质体于100 kD超滤管(Amicon,Ultra-4),5 000×g离心20 min,收集滤液并且记录滤液体积,滤液即为游离的ELP-SOD,测定滤液酶活性。ELP-SOD脂质体用1%的Triton X-100破膜0.5 h,得到破膜的脂质体,经过适当稀释后测定ELP-SOD的总活性。酶活包封率计算公式如下:

A:ELP-SOD的总活性(U/mL);a:超滤时加的ELP-SOD脂质体体积(mL);B:超滤得到的滤液活性(U/mL);b:超滤得到的滤液体积(mL)。
ELP-SOD脂质体蛋白包封率的测定:按上述方法用超滤管分离游离的ELP-SOD,实验采用BCA试剂盒法(美国THERMO公司)测定滤液的蛋白浓度,并按照下式计算ELP-SOD脂质体的蛋白包封率:

a:超滤时加的ELP-SOD脂质体体积(mL);C1:ELP-SOD脂质体总蛋白浓度(mg/mL);b:超滤得到的滤液体积(mL);C2:滤液蛋白浓度(mL)。
1.10 ELP-SOD脂质体的模拟体内半衰期
以大鼠血浆进行模拟体内半衰期实验。实验分3组,实验组为ELP-SOD脂质体,阳性对照组为同法制备的SOD脂质体(SOD蛋白购自杭州纽龙生物科技有限公司),空白对照为PBS溶液。实验时每组样品液体积中50%大鼠血浆、40% PBS及10%各自对应的脂质体(阴性对照组为PBS补足体积),加入后混匀,静置于37 ℃恒温培养箱中培养0、2、4、6、8、10、20、32、48 h后分别取样测定酶活,并按照步骤“1.7”给出的公式计算ELP-SOD脂质体的半衰期。
1.11 ELP-SOD脂质体的透皮效应
小鼠离体皮肤的制备:取6只健康SPF级雄性ICR小鼠颈椎脱臼处死,用脱毛剂将小鼠腹部皮肤脱毛处理,用生理盐水洗净残留在小鼠腹部的脱毛剂后,剥下小鼠腹部皮肤,用镊子刮净离体皮肤内侧的组织,用PBS浸泡离体皮肤备用。
体外透皮实验:采用TP-6透皮扩散仪进行体外释放实验。用Franz扩散池考察ELP-SOD脂质体运载ELP-SOD的透皮效率。Franz扩散池由上下两个磨口玻璃容器对合而成,分为接收池和供给室,释药面积为1.13 cm2,接收池的容积为15 mL。实验时取15 mL PBS充满Franz接收池,加入磁性转子,将小鼠皮肤用不锈钢夹固定于接收池与供给室之间(内侧皮肤朝下,与PBS接触,且不能有气泡残留),供给室分别加入ELP-SOD脂质体0.5 mL和0.25 mg/mL ELP-SOD蛋白溶液0.5 mL,将Franz扩散池置于37 ℃恒温水池,调节磁力搅拌器转速为350 r/min,每隔2 h取大约1 mL样品,然后用等量PBS补足体积,持续24 h,每组设6个平行样。
分别测定两组样品的SOD酶活性(ELP-SOD脂质体组需加Triton X-100破膜,Triton X-100终浓度为0.5%),按照以下公式计算ELP-SOD脂质体的透过率:透过率(%)=(a×b/c×d)×100%;其中,a:Franz扩散池总体积(mL);b:取样测得的样品SOD活性(U/mL);c:供给室加入样品体积(mL);d:加样前样品SOD活性(U/mL)。
1.12 统计学分析
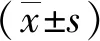
2 结果
2.1 ELP40-SOD的表达量检测结果
以牛血清白蛋白(BSA)作为测量标准品,GS-900成像仪(SH1WBA10698)进行凝胶透射图像扫描(图1),测算SDS-PAGE图中目的蛋白的表达水平。对比电泳图上的蛋白标准参照物(Marker)可以看出,目的蛋白ELP40-SOD的分子量在48 kDa左右,在普通LB培养基采用普通摇床进行37 ℃表达4 h,pET28a载体表达的ELP40-SOD量最高是10 mg/L。
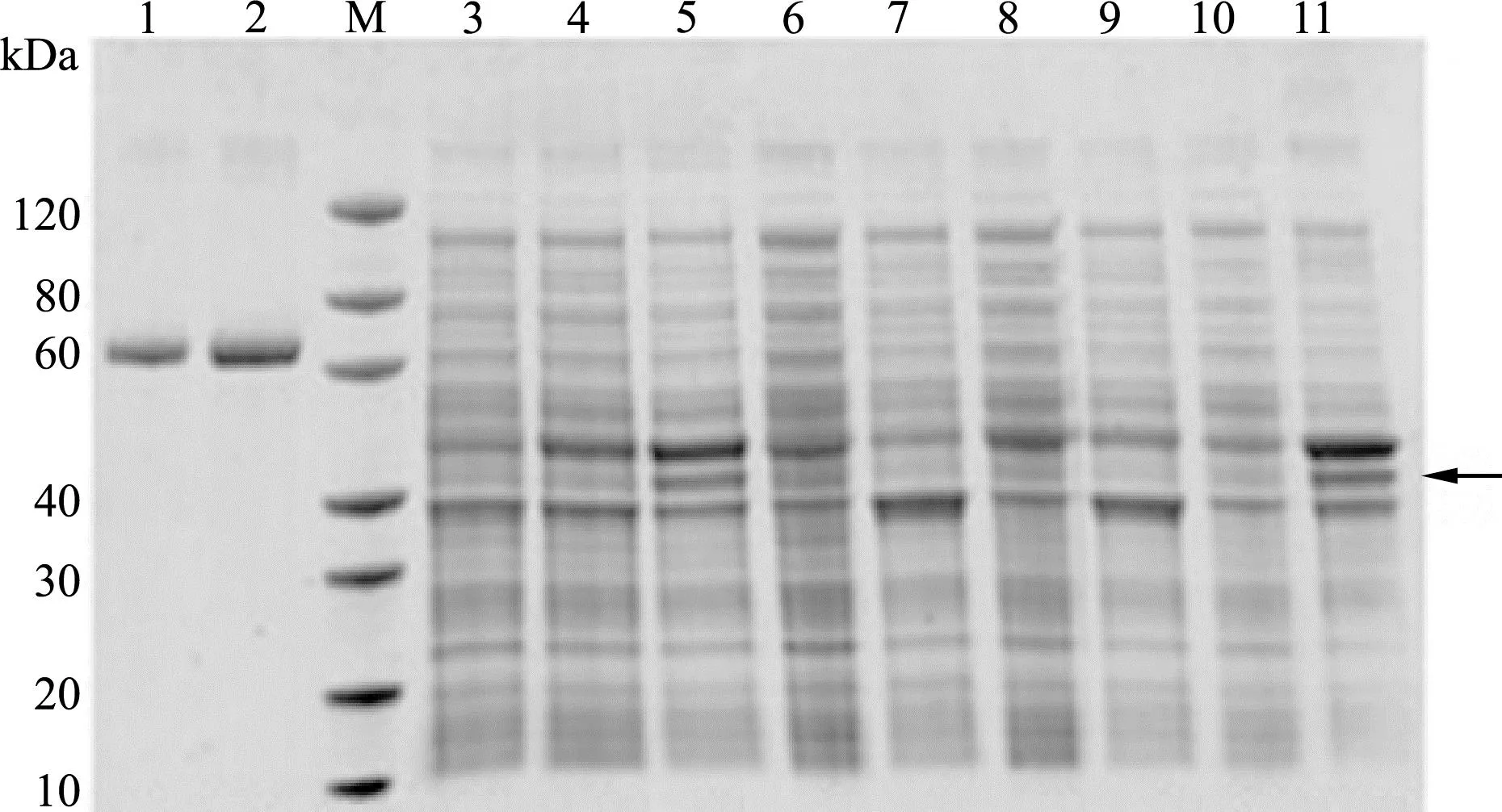
1、2分别为牛血清白蛋白标准品1 μg、2 μg;3为未加IPTG诱导样品全菌裂解液;4、8、9分别为用15 ℃ 16 h表达的全菌裂解液、裂解液上清和沉淀;5、6、7分别为37 ℃表达4 h的全菌裂解液、裂解液上清和沉淀;10、11分别为37 ℃表达4 h的细菌裂解液沉淀和上清。ELP40-SOD的最高表达量(箭头指示)测定为10 mg/L
2.2 ELP-SOD融合蛋白的纯化结果
由图2可见,经第一轮ITC纯化后,蛋白溶液中除了ELP-SOD外还有较多其他杂蛋白,需要继续纯化;粗酶液经三轮ITC纯化后,SDS-PAGE蛋白电泳显示ELP-SOD融合蛋白可以基本达到电泳纯。ITC纯化蛋白一般循环3~5次,融合蛋白经三轮ITC纯化,目的蛋白的纯度已经达到95%以上,兼顾蛋白得率考虑,因此ELP-SOD融合蛋白纯化进行三轮ITC。图3为三轮ITC纯化后的ELP-SOD,经邻苯三酚自氧化法沉淀,通过Image studio软件分析可得纯度为97.8%,酶比活达到4 894.5 U/mg,得率为0.96 mg/L,其中纯化倍数5.98,恢复率28.5%。说明用三轮ITC法纯化ELP-SOD融合蛋白可以基本达到电泳纯,纯化后的蛋白酶比活较高,且纯化过程仅需控温离心,操作简便,因此后续实验所用的ELP-SOD融合蛋白均由三轮ITC法纯化。

1:全菌裂解液;2:裂解液沉淀;3:裂解液上清;4:粗酶液一轮ITC纯化后样品;5:三轮ITC纯化后样品

1-4为ITC三轮纯化后的4个平行样品
2.3 ELP-SOD融合蛋白的pH稳定性
将目的蛋白用不同pH的缓冲液进行稀释,以考察pH对ELP-SOD融合蛋白酶活性的影响。实验结果见图4,ELP-SOD在pH 5.0~8.0的范围内酶活均能保留在90%以上,说明该范围内的pH对酶活影响较小,蛋白较为稳定。当pH>8.0或者pH<5.0时,酶活下降较快,但是仍保持在80%以上,因此,ELP-SOD融合蛋白在一定pH范围内能保持较高的稳定性。

图4 ELP-SOD融合蛋白pH稳定性曲线
2.4 ELP-SOD融合蛋白的热稳定性
将目的蛋白在不同温度下保持一定时间,以考察温度对ELP-SOD融合蛋白酶活性的影响。由图5可见,当温度低于60 ℃时ELP-SOD的活性较为稳定,温度超过60 ℃后酶活急剧下降,到80 ℃时ELP-SOD融合蛋白几乎完全失活。因此,ELP-SOD在温度小于60 ℃的环境下有较好的稳定性。

图5 ELP-SOD融合蛋白温度稳定性曲线
2.5 外源添加Cu2+和Zn2+提高ELP-SOD酶活性
外源添加Cu2+和Zn2+可以有效提高ELP-SOD的酶活性,其酶活随作用时间的变化曲线如图6所示,在1 h之内酶活迅速升高,已经达到初始酶活的416%,之后的16 h内酶活没有显著提升(t检验结果显示各点没有显著性差异),因此酶液与Cu2+/Zn2+混合液于4 ℃反应1 h即可达到稳定,酶活达到8 281 U/mg。该蛋白混合液于透析袋中冰浴透析72 h后,溶液中残留的Cu2+和Zn2+浓度小于10 ppm,符合中国药典对于SOD中重金属含量的标准,透析后的酶活为7 291.2 U/mg,是透析前酶活的88%。

图6 外加Cu2+/Zn2+混合液提高ELP-SOD酶活随时间的变化曲线
2.6 ELP-SOD融合蛋白的模拟体内半衰期实验结果
由图7可以看出,随着孵育时间的延长,ELP-SOD融合蛋白和SOD纯品都具有较好的稳定性,例如在37 ℃孵育48 h后,空白对照组酶活仅为初始酶活的53.4%,SOD组酶活为初始酶活的78.4%,而ELP-SOD组仍保留了84.1%。此外,ELP-SOD融合蛋白的半衰期为(59.00±5.95)h,SOD的半衰期为(49.80±6.92)h,差异有统计学意义(t=6.965,P<0.05)。由此可见,融合蛋白中ELP的加入不仅简化了蛋白纯化过程,而且能够有效保留酶活性,延长酶在体内的模拟半衰期。

图7 ELP-SOD在血浆中的酶活保留率随时间的变化
2.7 ELP-SOD融合蛋白细胞毒性实验结果
如图8及图9所示,含有不同浓度ELP-SOD的培养基分别与HUVEC和L929细胞孵育,在24 h内对细胞增殖有一定的促进作用;在孵育48 h后,ELP-SOD对于HUVEC增殖没有明显的促进或者抑制作用,而在低浓度下对于L929细胞仍存在一定的促进作用;当含有ELP-SOD的培养基与细胞共孵育72 h时,对于HUVEC细胞在高浓度下(42、84 U/mL)出现一定的抑制作用,而对L929细胞的增殖仍然没有显著抑制和促进作用。实验结果表明,低浓度的ELP-SOD对于细胞增殖有促进作用,当浓度较高(84 U/ml)且孵育时间够长时(72 h)才开始表现出一定的增殖抑制(<30%),因此可以说明ELP-SOD有较好的生物安全性。

*:P<0.05
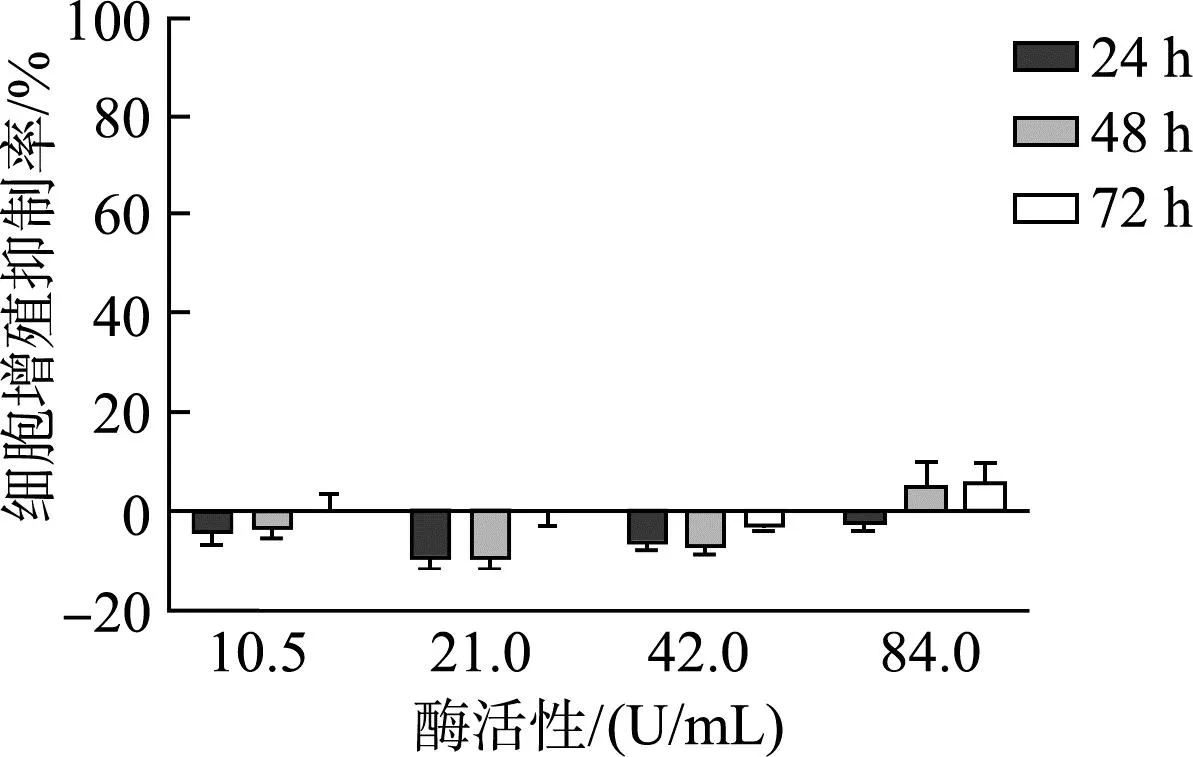
图9 不同浓度ELP-SOD对L929细胞增殖的影响
2.8 ELP-SOD融合蛋白脂质体制备
经ZS90纳米粒度仪测量,ELP-SOD脂质体的粒径分布情况如图10所示,脂质体的粒径分布呈现单峰的正态分布,平均粒径小于200 nm(124.8 nm),PDI小于0.3(0.137),说明该脂质体的均一度好,粒径较小且分布均匀。脂质体表面所带的电荷接近20 mV(-19.7 mV),这使脂质体保持较为稳定的形态,不易发生聚集。ELP-SOD脂质体的蛋白包封率为80.8%±3.42%,活性包封率为81.5%±2.17%,都高于80%,说明该脂质体能够对ELP-SOD融合蛋白进行有效的包裹。

图10 ELP-SOD脂质体的粒径分布图
2.9 ELP-SOD脂质体的模拟体内半衰期实验结果
如图11所示,随着孵育时间的增加,以ELP-SOD融合蛋白或SOD制备的脂质体都具有较好的稳定性,但ELP-SOD脂质体的半衰期达到(73.90±1.69)h,高于SOD脂质体(63.40±6.61)h,两组差异有统计学意义(t=4.333,P<0.05),且ELP-SOD融合蛋白的半衰期(59.00±5.95)h与ELP-SOD脂质体的半衰期相比也有统计学差异(t=14.189,P<0.001)。结果表明ELP-SOD融合蛋白制备成脂质体后可以有效延长其在血浆中的半衰期。
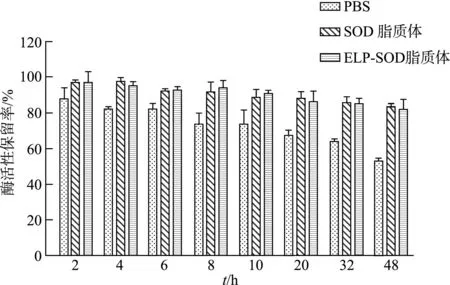
图11 ELP-SOD脂质体在血浆中的酶活保留率随时间的变化
2.10 ELP-SOD脂质体的透皮实验结果
如图12所示,与ELP-SOD融合蛋白相比,其脂质体能够很快透皮扩散入接收池中,8 h达到最高29.93%。之后虽稍有下降,在24 h最低仍然可达到20%左右,高于ELP-SOD融合蛋白,说明脂质体包裹ELP-SOD融合蛋白能够加强其透皮效率。

图12 ELP-SOD脂质体透皮实验结果
3 讨论
ELP具有逆向温度相变特性,其作为标签制备的融合蛋白能随溶液温度或盐浓度改变从可溶性状态变为不溶性状态,因此融合蛋白可用离心、超滤等简单、快速、经济的方法进行融合蛋白分离,尤其便于规模化制备。此外,ELP标签不改变融合蛋白二级结构及酶活,ELP融合蛋白能增加蛋白溶解性,维持其生物活性和物理性质;ELP标签增加蛋白稳定性主要包括提高酶的热稳定性、化学稳定性、抵御酶失活和延长酶的半衰期[22]。本研究将人源SOD与ELP进行融合表达,目的就是在保留蛋白酶活的同时简化纯化工艺和降低成本。本实验利用重组大肠埃希菌表达ELP-SOD融合蛋白,结果提示在37 ℃诱导4 h表达量最高,而且目的蛋白主要在菌液裂解液上清中,最高表达量为10 mg/L。为了提高纯化效率,本实验通过对ITC纯化方案中的一些条件进行优化,经过三轮ITC纯化得到该目的蛋白,其最终纯度为97.8%,酶比活为4 894.5 U/mg。而且ELP-SOD融合蛋白在pH在5.0~8.0的范围、温度低于60 ℃有较好的稳定性。以大鼠血浆对ELP-SOD进行模拟体内半衰期实验,结果显示ELP的接入对于SOD的半衰期有一定的延长作用。细胞毒性实验证明ELP-SOD对HUVEC和L929细胞的增殖影响较小,有较好的生物安全性。
针对ELP-SOD作为生物大分子在实际应用中可能存在的生物利用率低、易被蛋白酶分解等问题,本实验结合脂质体包裹技术,制备了ELP-SOD脂质体,平均粒径为124.8 nm,电位-19.7 mV,包封率达到80%以上,且模拟体内半衰期实验表明脂质体能进一步有效延长ELP-SOD融合蛋白的半衰期。并且ELP-SOD脂质体的透皮效率明显高于ELP-SOD融合蛋白,说明脂质体的包裹促进了ELP-SOD的透皮效应,有助于该融合蛋白进入皮肤发挥作用,提高生物利用度,这在皮肤科局部外用药物、日用化妆品等方面将会有很好的发展前景。
本实验采用基因工程法构建了ELP-SOD融合蛋白,利用其可逆热相变性简化了纯化步骤,降低了纯化成本,解决了SOD来源的问题。后续研究中还可以对大肠埃希菌的发酵条件进行优化,提高ELP-SOD的产量;也可以通过实验在大肠埃希菌培养基中直接添加一定浓度和比例的Cu2+、Zn2+,来进一步提高ELP-SOD融合蛋白的初始酶活,为重组人源SOD在医疗、保健、化妆品等领域的应用奠定基础。

