多囊卵巢综合征大鼠和小鼠模型的生殖与代谢特点及选择应用
林梓欣, 曾国美, 林颖, 方洁妮, 胡芳远, 李洁, 郑汝群, 胡敏, 李娟
(1. 广州医科大学第一临床学院, 广东 广州 510120; 2. 广州医科大学附属第一医院中医科, 广东 广州 510120)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期妇女常见的生殖内分泌疾病,以稀发排卵或持续性无排卵、高雄激素血症、卵巢多囊样改变、不孕及胰岛素抵抗等为主要临床特征,严重影响女性患者的身心健康。关于PCOS发病机制的研究也在不断深入。良好的动物模型对PCOS的研究十分重要。目前PCOS动物模型造模方法繁多,但尚缺少针对PCOS动物模型表型的整理以及大鼠和小鼠模型对比的综述。PCOS除具有生殖异常的特征外,还可能存在糖脂代谢的异常特征。在实际实验操作中,根据不同的实验目的,需要选择不同的动物模型。通过实践及文献分析发现,虽然是同一种造模方法,在大鼠和小鼠上给予相同的药物,或者不同阶段给药,都可能会产生不同的表型。因此,为了方便实验研究者选取最佳的造模方式,本综述对目前常用的PCOS大鼠和小鼠经典模型及其临床表现进行总结归类、对比分析,旨在指导研究者有针对性地选择最适宜的模型。
1 生殖异常的PCOS大鼠和小鼠模型
通过文献研究发现,采用来曲唑灌胃的成年大鼠和小鼠、雌激素造模的小鼠、米非司酮造模的大鼠和小鼠、睾酮造模的Swiss小鼠,以及给予妊娠期C57BL/6J小鼠双氢睾酮的子代仅明确表明具有生殖异常的表现,对于代谢异常的表现仍缺少有力的证据。
1.1 来曲唑造模法
来曲唑是一种口服的非甾体高效选择性的第三代芳香化酶抑制剂,为人工合成的苄三唑类衍生物。来曲唑一方面抑制雌激素对下丘脑的负反馈作用,从而导致垂体促性腺激素分泌增加;另一方面可以阻止体内雄激素向雌激素转化,导致雄激素堆积,两方面同时作用可以诱导卵巢呈多囊样改变。
Kafali等[1]首次采用来曲唑建立PCOS大鼠模型,给予6周龄大鼠不同剂量来曲唑灌胃,21 d后发现不同剂量诱导的模型均表现为卵巢囊肿比例升高、卵巢包膜增厚和黄体数量减少。尽管对卵巢重量没有显著影响,但它能剂量依赖性地抑制子宫重量。此外,孕酮水平降低,睾酮和促黄体生成素(luteinizing hormone,LH)均升高,促卵泡刺激激素(follicle-stimulating hormone,FSH)水平在高、中剂量组(0.5和1.0 mg/kg)升高,在低剂量组(0.1 mg/kg)轻微下降,尤其卵巢的病理改变与人类PCOS非常相近。Kirici等[2]选取10~12周龄SD大鼠采用来曲唑诱导建立PCOS模型,将来曲唑(1 mg·kg-1·d-1)在1%羧甲基纤维素钠和0.9%生理盐水中溶解,连续灌胃21 d后发现PCOS组与其他组相比,表现为囊泡数量明显增加,闭锁卵泡数量增加,且PCOS组血清睾酮水平明显高于其他各组,而各组间的LH、FSH和胰岛素水平均无差异。
Torres等[3]分别给予4周龄和8周龄C57BL/6NHsd小鼠皮下埋植来曲唑缓释剂(50 μg/d)连续5周,5周后发现青春期和成年雌性小鼠均具有PCOS的生殖特征,包括高雄激素血症、LH升高、无排卵和卵巢多囊样改变。然而,与青春期小鼠不同的是,成年雌性小鼠无明显的卵巢重量增加、体重增加和腹部肥胖,空腹血糖和胰岛素水平轻微升高,但无胰岛素抵抗。说明其代谢特征与来曲唑干预的节点有关,青春期接受来曲唑干预更易造成小鼠代谢异常,而成年期接受来曲唑干预小鼠仍维持正常的胰岛素敏感性。
1.2 雌激素造模法
高雌激素诱导PCOS模型的机制为可诱导出PCOS垂体内分泌环境的典型特征,雌激素通过正反馈调控LH分泌,高雌激素刺激使垂体对促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)刺激的敏感性增加,GnRH致使LH水平升高,另一方面雌激素的持续刺激通过负反馈调节抑制垂体FSH的分泌。
Chapman等[4]对雌性(C57BL/6J×A/J)F1(B6A)小鼠在5~7日龄时连续3 d皮下注射20 μg戊酸雌二醇,发现100日龄时成年小鼠表现出卵巢多囊样改变以及黄体减少,且通过进一步研究发现,胸腺切除的小鼠注射雌二醇后并不能导致卵巢多囊样改变,因而提出了卵巢囊肿是由类固醇治疗后引起的自身免疫性疾病的观点。Moayeri等[5]对4周龄的NMRI小鼠每天皮下注射4 mg/100 g戊酸雌二醇,诱导20 d后与正常小鼠相比,模型组小鼠初级卵泡减少,窦前卵泡增多,囊性卵泡增多,黄体数减少;颗粒细胞厚度明显减少,卵母细胞直径变小,而膜厚度异常增加;血清FSH水平降低,而LH显著升高。Falahatian等[6]给8周龄的NMRI小鼠单次肌内注射戊酸雌二醇(40 mg/kg),随访8周后小鼠出现动情周期紊乱,睾酮、孕酮、雌激素水平较对照组增加,同时HE染色发现PCOS模型的卵巢中初级和原始卵泡数量显著减少,窦前卵泡数量显著增加,黄体数减少,卵巢囊肿数量增加。
1.3 米非司酮造模法
米非司酮是一种口服堕胎药,属于对孕酮受体具有很强亲和力的类固醇。健康妇女在卵泡期服用米非司酮可破坏卵泡的正常发育,减少LH增加,且抑制排卵。
杨艳东[10]对6~8周的昆明种小鼠连续给予米非司酮灌胃(0.065 mg米非司酮溶于0.1 mL麻油中)24 d,发现长期小剂量的米非司酮可抑制小鼠卵泡发育,但随停药时间的延长这种损伤会逐渐恢复,在停药24 d动情周期消失,停药48 d动情周期明显延长,96 d动情周期逐渐恢复规律。但该方法同样缺少对小鼠代谢方面的研究,也没有反映小鼠激素水平的变化。
因此,米非司酮造模法在大鼠和小鼠模型中,对代谢方面的研究仍十分有限。针对代谢紊乱的PCOS研究,不建议选择该模型。
1.4 雄激素造模法
高雄激素血症是PCOS的显著特征,体内循环雄激素水平的升高可阻碍卵泡发育成熟及导致囊肿形成。因此采用外源性雄激素造模是目前应用最多的造模方法。其中,睾酮是生殖激素中的主要雄激素,由男性的睾丸或女性的卵巢分泌,肾上腺亦分泌少量睾酮。在体内,睾酮通过雄激素受体的介导直接促进卵泡的早期发育,而在排卵前则作为前体合成雌激素,通过雌激素受体介导而发挥作用。过量睾酮使垂体对下丘脑刺激的敏感性降低、LH持续性分泌并导致排卵性LH峰消失,同时抑制FSH的促排卵作用,最终导致不排卵[11]。
Edwards[12]在新生Swiss小鼠出生后的前3天里每天给予100 μg的睾酮或者丙酸睾酮,发现可以导致小鼠不排卵和卵巢多囊样改变,但该研究未检测代谢方面的变化。
1.5 双氢睾酮造模法
除睾酮外,还存在双氢睾酮、脱氢表雄酮等其他雄激素。为模拟PCOS状态,脱氢表雄酮、双氢睾酮等雄激素均常用于诱发动物体内的高雄激素血症。
双氢睾酮是一种可以由睾酮经过5-α还原酶催化产生且不能被转化为雌激素的雄激素。脱氢表雄酮造模无法排除高雄激素血症是由雌激素转化而来还是雄激素过高直接引起的,而双氢睾酮造模法更具有针对性。实验中常通过皮下注射双氢睾酮或埋置双氢睾酮缓释片的方法来诱导构造PCOS动物模型。
胡巧云等[13]选择6~8周龄C57BL/6J小鼠,在其妊娠16~18 d时皮下注射双氢睾酮(250 μg/d),将双氢睾酮母鼠产下的雌性子代小鼠作为研究对象,结果显示小鼠体重不受母鼠产前高双氢睾酮暴露的影响,但卵巢重量及卵巢与体重的比值上升,动情周期尤其是动情间期时程明显延长。卵巢内出现大的空泡,同时闭锁卵泡数量增加,窦状卵泡、成熟窦状卵泡和黄体均减少,提示小鼠生育能力下降。血清中雌二醇、孕酮和FSH水平降低,而睾酮、LH水平、LH/FSH比值明显升高,血清中呈现明显的“高雄低雌”的典型症状。
2 生殖和代谢异常的PCOS大鼠和小鼠模型
虽然采用了同种药物,在对不同的动物,如大鼠或小鼠,不同的品系,或者在不同的年龄阶段或妊娠期,不同的给药方式等,均可能带来不一样的模型特征。
2.1 来曲唑造模法
为了诱导出同时具有代谢和生殖表型的PCOS大鼠模型,Maliqueo等[14]给予21日龄的青春期Wistar大鼠皮下植入不同剂量来曲唑缓释剂,90 d后发现100或200 μg/d两种来曲唑剂量均导致大鼠体重增加,腹股沟脂肪堆积,无排卵、卵巢增大伴卵泡闭锁和多发囊肿,内源性高雄激素血症以及雌激素水平降低。此外,每天服用200 μg的大鼠还存在胰岛素抵抗,腹股沟和肠系膜脂滴中的脂肪细胞增大,LH循环水平升高,FSH水平降低,卵巢17α-羟化酶(Cyp17A1)mRNA表达增加。表明从青春期开始,连续给予雌性大鼠来曲唑200 μg/d,持续90 d,可产生具有生殖和代谢特征的PCOS模型。
Kauffman等[15]给予4周龄青春期雌性C57BL/6N小鼠皮下植入来曲唑(50 μg/d)5周后,小鼠表现为血清睾酮水平升高,雌二醇水平正常,与PCOS患者相似。与对照组相比,来曲唑诱导的小鼠卵巢更大、多囊样改变且黄体减少,动情周期消失,并且不孕。血清LH水平升高,而血清FSH水平显著降低。与对照组相比,来曲唑组小鼠体重增加更多,腹部肥胖增多,脂肪细胞大小增加,脂肪炎症水平升高,糖耐量受损,反映了类似PCOS患者的代谢表型。Bhattarai等[16]选取21日龄ICR雌性小鼠和C57BL/6雌性小鼠给予来曲唑1 μg/g,连续灌胃21 d,PCOS组均出现不规则的动情周期,表现为动情期缩短,间期延长,且来曲唑喂养的小鼠体重在第3周显著增加。
尹萍等[17]选取3周龄雌性大鼠喂养45%高脂饲料16周,于第6周龄开始灌胃来曲唑直至造模结束。结果显示,模型组大鼠体重增加,卵巢、腹股沟脂肪质量增加,子宫、垂体质量及脏器指数显著减少,卵巢呈多囊样改变,颗粒细胞层减少,白膜增加。此外,三酰甘油和低密度脂蛋白升高,糖耐量曲线下面积增加,血清睾酮水平上升,空腹胰岛素水平升高,胰岛素敏感性降低。Zhang等[18]给予8周龄SD大鼠高脂饲料联合来曲唑灌胃(1.0 mg·kg-1·d-1)21 d后,模型组表现出动情间期明显延长的不规则周期,体重和血糖显著升高,FSH显著降低,LH、睾酮显著升高。此外,Zheng等[19]通过给予8周龄C57BL/6J小鼠皮下注射来曲唑(50 μg/d)联合高脂饮食喂养6周,同样成功获得了PCOS合并胰岛素抵抗的小鼠模型。表明来曲唑联合高脂饲料可以建立典型的生殖代谢异常的PCOS模型,且伴有明显的肥胖,为常用的PCOS造模方法。
2.2 雌激素造模法
雌激素造模多选用SD大鼠,较少使用Wistar大鼠。邵华[20]给予8~12周龄雌性SD大鼠肌内注射戊酸雌二醇,结果显示,30 d后与对照组和空白组相比,高剂量(4 mg)、低剂量(2 mg)戊酸雌二醇组的大鼠出现动情周期紊乱、卵巢表面苍白,可见较多囊状卵泡;组织学检查颗粒细胞层明显减少;激素水平上,睾酮与雄烯二酮的水平并无明显升高,推测戊酸雌二醇诱导的PCOS模型与高雄激素无明显关系。且注射4 mg戊酸雌二醇30 d后卵巢多囊性改变最为典型。Fazel等[21]对有3个连续规则动情周期的SD大鼠连续皮下注射戊酸雌二醇(4 mg),4周后发现PCOS大鼠体重明显增加,卵巢重量显著增加,子宫重量明显降低;血清LH、睾酮和雌二醇水平升高,而FSH和孕酮水平下降,高密度脂蛋白降低,三酰甘油水平和三酰甘油/高密度脂蛋白的比值升高;血糖和胰岛素水平、胰岛素抵抗指数(homeostasis model assessment insulin resistance,HOMA-IR)、胰岛素样生长因子-1均升高。卵巢形态学表现与邵华[20]的模型一致。
2.3 双氢睾酮造模法
严晓南[22]在SPF级SD大鼠妊娠第16~19 d颈背部皮下注射0.5 mL双氢睾酮油剂(10 mg/mL)或0.5 mL溶剂,子代雌鼠出生后第4~8周的研究结果显示,子代雌鼠在青春期体重增长明显加快,卵巢内有大量卵泡成囊状改变,卵泡总数、囊状卵泡和闭锁卵泡的数量均明显增多,但卵巢重量和卵巢重量/体重的比值两组间均无显著差异。血清睾酮和雌二醇水平与对照组比较无显著差异。空腹血糖、胰岛素和瘦素水平均明显升高,HOMA-IR亦显著增高。8周龄时体内游离脂肪酸明显升高。
Mannerås等[23]对21日龄Wistar雌性大鼠皮下埋置双氢睾酮缓释片(7.5 mg/90 d),结果显示双氢睾酮组大鼠体重增加,脂肪增多,体脂率上升,动情周期紊乱,卵巢面积和重量下降,囊性卵泡和闭锁卵泡数量增加,血浆睾酮、雌二醇浓度无明显变化,孕酮水平下降。同时,PCOS模型大鼠瘦素水平升高,总胆固醇、三酰甘油、高密度脂蛋白无明显变化,平均葡萄糖输注率、胰岛素敏感指数均下降,表明PCOS模型大鼠出现胰岛素抵抗。说明21日龄的青春期大鼠皮下埋植含7.5 mg的双氢睾酮缓释片饲养到90 d具备了PCOS样的生殖障碍和代谢紊乱特征。Pruett等[24]对4周龄SD雌性大鼠皮下埋植双氢睾酮缓释片(7.5 mg/90 d),8周后与对照组相比,同样发现PCOS大鼠模型出现体重明显增加,体重指数增加,脂肪量/肌肉量的比值增加。
van Houten等[25]对出生19 d的青春期前雌性小鼠皮下植入双氢睾酮缓释药丸90 d(含2.5 mg双氢睾酮,27.5 μg/d)后,发现小鼠出现动情周期不规则,体重增加,卵巢闭锁卵泡增加,多数闭锁卵泡具有囊肿样结构,脂肪细胞体积增大,瘦素水平升高,脂联素水平下降,同时伴有葡萄糖不耐受。脂联素具有抗炎、抗动脉粥样硬化和增加胰岛素敏感性等作用,其血清水平降低易致胰岛素抵抗[26]。
2.4 脱氢表雄酮造模法
脱氢表雄酮是孕烯醇酮转化为雄烯二酮的中间产物,通过外源性提高脱氢表雄酮水平使雄烯二醇水平升高,进而导致睾酮、雌酮水平升高,造成PCOS高雄激素血症。升高的雌酮通过负反馈调节抑制FSH分泌释放,使其相对不足而导致卵泡发育停滞,出现排卵障碍及卵巢多囊样改变。
该法1991年由Lee等[27]提出,国内外众多学者对此模型进行了更深一步的研究。王娜梅[28]选取23日龄SD雌性大鼠,每日于颈背部皮下注射脱氢表雄酮(6 mg/100 g体重+0.2 mL油剂),20 d后大鼠失去规律的动情周期,卵巢体积增大,呈多囊样改变;FSH、LH、睾酮水平明显高于对照组;糖耐量异常,空腹胰岛素及HOMA-IR明显高于对照组。胆固醇、脂肪湿重、脂体比明显高于对照组。Yu等[29]连续给予6周龄SD大鼠皮下注射脱氢表雄酮(60 mg·kg-1·d-1)共21 d,3周后检测血糖和血清激素水平,模型组与对照组相比血清葡萄糖、睾酮、LH水平明显升高,血清雌二醇、性激素结合球蛋白(sex hormone binding globulin,SHBG)、FSH水平明显降低,游离睾酮指数和LH/FSH比值明显升高。Zheng等[30]也同样发现SD大鼠注射脱氢表雄酮(6 mg/100g)20 d后,大鼠出现周期紊乱,HOMA-IR显著升高,子宫和卵巢重量增加,子宫内膜腺体增生和卵巢形态改变,模型组卵巢皮质层原始卵泡数量正常,闭锁卵泡数量增加,有多个黄体化的囊性卵泡,卵泡在光镜下未见卵母细胞或辐射冠。此外睾酮、雌二醇、LH、LH/FSH比值增加。这些研究均表明脱氢表雄酮可诱导SD大鼠出现与PCOS患者相似的生殖和代谢异常的改变,是研究PCOS生殖及代谢异常的较理想动物模型[31]。
Solano等[32]用21日龄的Balb/c小鼠,连续注射脱氢表雄酮(60 mg·kg-1·d-1)20 d以诱导PCOS小鼠模型。该模型小鼠出现卵巢多囊样改变,多囊样卵泡膜和颗粒细胞层变薄,血清中雌二醇水平升高,体重增加,空腹胰岛素、空腹血糖及HOMA-IR升高。Lai等[33]选用21日龄C57BL/6J雌性小鼠,以脱氢表雄酮(6 mg/100 g)连续处理20 d,同时给予高脂饮食。实验结果显示,小鼠卵巢出现明显多囊样改变,颗粒细胞层变薄、闭锁卵泡增加、黄体数量减少;动情周期紊乱,血清睾酮明显升高,体重增加,糖耐量异常以及存在胰岛素抵抗。
2.5 胰岛素联合人绒毛膜促性腺激素造模法
人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)可抑制卵泡颗粒细胞有丝分裂使颗粒细胞数量变少,胰岛素刺激卵巢卵泡膜细胞和间质细胞合成雄激素,降低血中SHBG含量,从而使雄激素的浓度升高,在二者共同作用下,可诱导出高雄激素血症及卵泡闭锁,形成多囊样改变[34]。
本方法最早由Poretsky等[35]创建,其在前人基础上发现高胰岛素环境可促使类LH样作用下的囊性卵泡和卵巢体积增长,同时注射胰岛素及雌激素可使实验动物(85日龄SD雌性大鼠)出现卵巢多囊样和无排卵。徐晓娟等[36]采用6周龄SD雌性大鼠,胰岛素联合HCG模型组于大鼠颈背部连续皮下注射诺和灵30R(2 IU/d)和HCG(3 IU/d)28 d。研究结果表明,该造模方法可使SD大鼠出现动情周期紊乱,无排卵前的成熟卵泡,卵巢脏器指数、睾酮、LH、三酰甘油、HOMA-IR升高,总胆固醇降低,同时具有胰岛素抵抗和卵巢多囊样改变的特点。
Hong等[37]选用8周龄C57BL/6雌鼠,采用胰岛素联合HCG造模法,皮下注射胰岛素(剂量从0.5 IU/d开始,每天增加0.5 IU,直至6.0 IU/d),以诱导小鼠高胰岛素血症和胰岛素抵抗。同时每日2次皮下注射HCG(6.0 IU/d),诱导小鼠高雄激素血症,共注射21 d。小鼠经胰岛素和HCG干预后,与对照组相比,子宫和卵巢重量、子宫和卵巢脏器系数均增加,同时血清雌二醇、FSH、LH水平,LH/FSH比值,以及空腹血糖、空腹胰岛素均显著升高。模型组小鼠卵巢呈囊性窦泡,窦腔增大,颗粒细胞层减少,排列松散,卵母细胞消失,黄体减少。子宫直径较大,说明小鼠生殖器官存在广泛炎症。同时,模型组子宫腔内上皮细胞和细胞层数减少。
2.6 雄激素造模法
Demissie等[38]对怀孕的成年雌性大鼠在妊娠第16~19天进行游离睾酮或溶剂注射,雌性后代被喂予常规或高脂肪饮食。在60日龄时,产前雄激素化(prenatelly androgenized,PA)大鼠的体重、子宫旁脂肪和皮下脂肪、血清胰岛素、胆固醇和三酰甘油水平以及肝脏的三酰甘油含量与对照组相比显著增加。该实验结果表明,在成年雌性大鼠中,短暂的产前雄激素暴露会产生代谢综合征的特征,而高胰岛素血症可能是PA的直接结果。给予9日龄SD大鼠皮下注射丙酸睾酮(1.25 mg)造模,于70日龄开始阴道涂片,连涂10 d后发现大鼠出现囊性卵泡,卵巢颗粒细胞数量减少,无黄体,体重增加,雌二醇和瘦素水平升高,FSH降低,但同时存在LH水平的不升反降与PCOS相反的情况[39]。
3 结语
以上为现阶段国内外大鼠、小鼠较为常用的PCOS造模方法,各模型的生殖及代谢特征见表1。
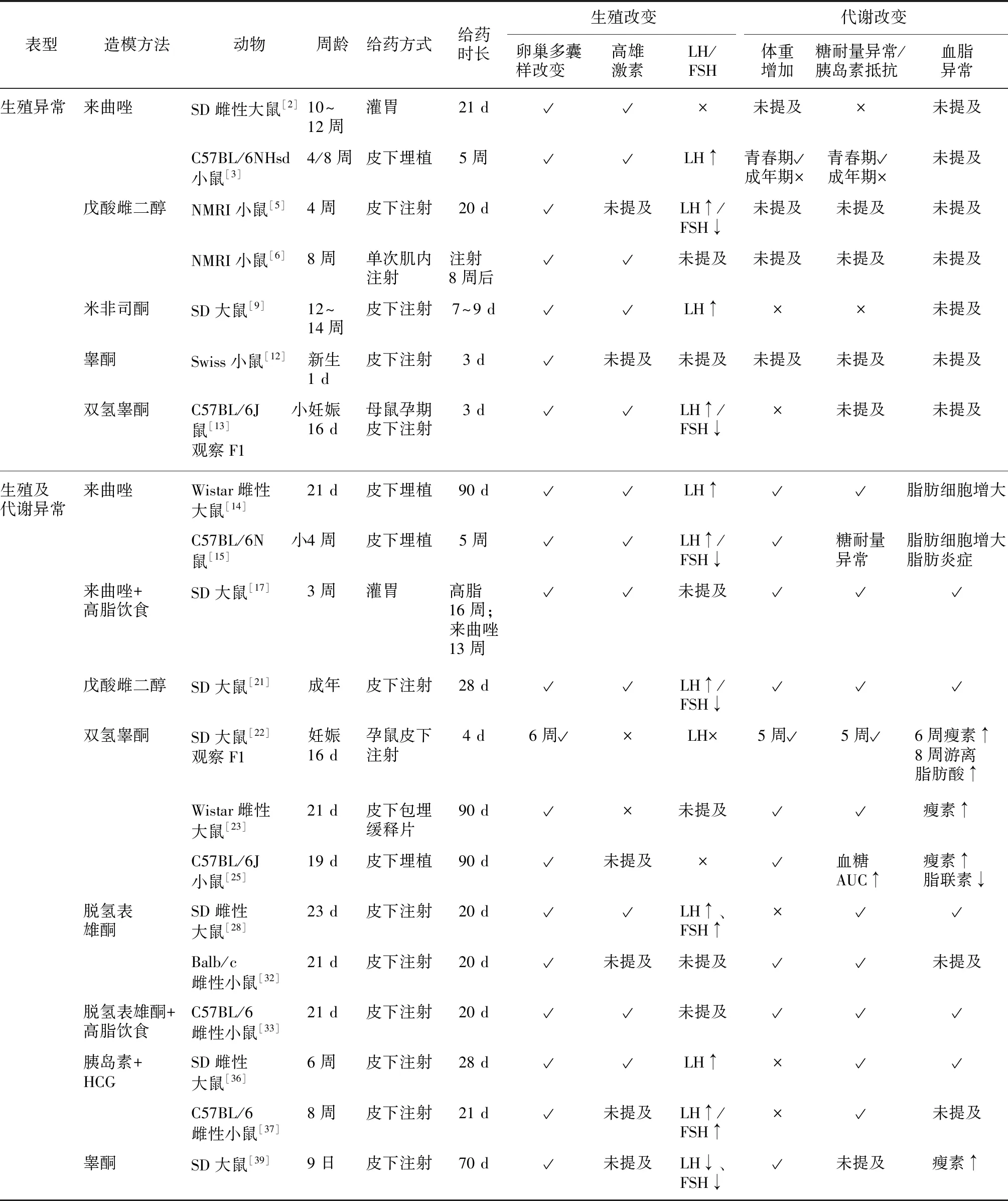
表1 PCOS大鼠和小鼠模型的生殖与代谢特点
来曲唑诱导的PCOS模型在卵巢改变方面与人类PCOS表现相似,均表现为卵巢体积明显增大,具有大量典型囊状卵泡,同时伴有睾酮水平升高,体重增加,是较为成功的卵巢多囊样改变的PCOS模型。并且青春期给予来曲唑可诱导出同时具有生殖和代谢表型的PCOS大鼠和小鼠模型。而成年期给予大鼠和小鼠来曲唑,仅可诱导出生殖异常的PCOS大鼠和小鼠模型。
雌二醇诱导的PCOS模型激素分泌水平与人类PCOS相似,但由于不同研究报道存在差异,该模型缺乏稳定性,且形成的囊性卵巢体积减小,雌激素干扰下丘脑-垂体轴,不适于PCOS形态学和治疗效果的相关研究。
双氢睾酮诱导的PCOS模型是最常用的造模方法之一,具有典型、多元化且成功率高的优点。通过皮下注射或埋置双氢睾酮缓释片建立PCOS模型对大鼠和小鼠都适用,同时具备生殖和代谢异常改变。PCOS模型大鼠卵巢重量减少,而PCOS模型小鼠卵巢重量趋于增加,但与正常组小鼠相比无显著差异。此外,小鼠模型卵巢囊性卵泡数量增加,但卵泡分布并不完全类似PCOS女性,同时LH水平有降低趋势但与对照组相比无差异[25]。此外,双氢睾酮作为动物体内自身活性的部分,外源性给予雄激素可能无法反映PCOS患者相关激素合成和代谢的真实状态。因此,这类模型不建议用于探索PCOS高雄激素血症发病机制,而只适用于研究高雄激素血症的继发症状,具有一定的局限性。
脱氢表雄酮诱导的PCOS动物模型选用未性成熟的雌性大鼠和小鼠,可出现持续和稳定的无排卵现象,但该模型的囊性卵泡膜细胞层较薄,不同于PCOS患者的囊性卵泡膜细胞层较厚[40]。同双氢睾酮一样,大鼠和小鼠均具有生殖和代谢的异常改变,但需要注意的是,因造模药物为脱氢表雄酮,存在模型体内升高的脱氢表雄酮难以区分是内源性还是外源性的雄激素不足。
双氢睾酮、脱氢表雄酮和胰岛素联合HCG的PCOS模型,除具有卵巢多囊样改变外,还具有胰岛素抵抗、血糖升高等代谢异常的表型。但由于胰岛素联合HCG造模法加入了外源性胰岛素,因而不适用于胰岛素抵抗的研究[41]。
综上,来曲唑诱导的PCOS模型是较为成功的卵巢多囊样改变的模型,为研究PCOS卵巢特征的优选模型,但需要注意的是,虽然来曲唑诱导的大鼠和小鼠PCOS模型均会有生殖异常的典型改变包括动情周期紊乱、卵巢多囊样改变,但成年期模型缺少代谢方面的表征。采用雌激素诱导的PCOS大鼠和小鼠模型,均有卵巢多囊样改变,但该模型缺乏稳定性。而雄激素造模的方法,卵巢体积并未见明显改变,因此这两种方法不适用于PCOS形态学研究。对于发病机制的研究,因无法区分是内源性还是外源性的因素,不建议选择同类激素干预的造模方法。此外,如需观察同时具有生殖和代谢异常的PCOS模型,除给予青春期大鼠和小鼠来曲唑或联合高脂饮食外,还可选用双氢睾酮、脱氢表雄酮及胰岛素联合HCG的造模方法。
由于PCOS是一种多因素造成的异质性疾病,这些模型都无法完全模拟临床上PCOS患者的特征。因此,当考虑选用哪种模型进行研究时,十分重要的一点是要明确研究目的是什么,再根据研究目的选择适宜的模型。
本文总结了常用PCOS模型的生殖和代谢特点,根据不同的研究目的,可更直观地为研究者在动物模型的选择上提供帮助。近年来国内外学者对于PCOS的机制研究不断深入,相信随着实验动物学的发展,未来更理想的PCOS动物模型将会建成,推动PCOS基础研究的同时,为临床研究及应用发展提供更可靠的实验依据。

