净化柱结合超高效液相色谱—串联质谱检测动物源性食品中16种喹诺酮药物
余婷婷 梁 松 黄文慧 何 洁,2 严义勇
(1. 深圳市易瑞生物技术股份有限公司,广东 深圳 518101;2. 深圳职业技术学院集成电路关键材料研究院,广东 深圳 518055)
喹诺酮药物因其成本低、抗菌谱广、见效快等特点[1-2],在畜禽养殖过程中常被“超剂量”使用,导致动物源性食品内药物残留。此外,因其代谢缓慢,会随食用动物源性食品的摄入在人体内蓄积,具有潜在的致癌风险。目前,喹诺酮药物检测的方法主要有薄层色谱法[3]、微生物法[4]、酶联免疫吸附法[5]、高效液相色谱法[6]、高效液相色谱—串联质谱法[7]等。薄层色谱法用于定性分析[8]、微生物法和酶联免疫法因其检测药物种类单一导致应用受限[9]。利用高效液相色谱法对喹诺酮药物进行定性和定量分析,其原理是通过保留时间对物质进行定性,其色谱出峰受杂质干扰较大,会出现杂质与目标化合物保留时间重叠的情况导致结果出现假阳性,此外,该方法对样品中药物残留的提取方式要求较高,无法实现痕量检测[10]。液相色谱-串联质谱法是根据质荷比对每个化合物进行独立检测,分离能力较高、灵敏度高、可实现痕量分析,是目前认可度高的定性定量检测方法,但依然会受杂质干扰[11]。
喹诺酮药物的样品前处理净化方法主要有分子印迹固相萃取[12]、固相萃取[13]、固相微萃取[14]、磁性固相萃取[15]、分散固相萃取[16]、分散液液微萃取[17]、液液微萃取[18]、液液萃取[19]、搅拌棒吸附萃取[20]等。目前使用较为广泛的前处理方式是固相萃取柱,使用时需要对小柱进行填料活化、吸附上样、杂质淋洗、目标洗脱等过程,该方法耗时长,试剂需求量较大。目前使用净化柱对动物源性食品进行净化的研究较少。因此,研究拟采用滤过型净化柱作为前处理净化材料,无需经过上述繁杂步骤,减少溶剂使用量,也可避免由于基质复杂而导致的筛板堵塞[21]等问题,结合过柱仪进行自动化过柱,可在20 s内一次性完成12管样品的净化,可提高大批量样品前处理净化效率,增加检测通量。通过对前处理条件、色谱、质谱分析条件的优化,以基质效应、回收率与精密度作为评价指标,确定16种喹诺酮药物最优的检测方法,建立过柱仪辅助净化柱结合超高效液相色谱—串联质谱检测动物源性食品中16种喹诺酮药物残留的方法,以期为动物源性食品的市场监管中食品安全检测提供依据。
1 材料与方法
1.1 材料、试剂与仪器
羊肉、鸭肉、牛肉、鱼肉、鸡蛋、猪腰、鸭皮等基质样品:样品经高通量组织研磨仪研磨后,于-20 ℃保存备用,市售;
16种喹诺酮药物标准品[噁喹酸(OXO)、氟甲喹(FLU)、诺氟沙星(NOR)、环丙沙星(CIP)、培氟沙星(PEF)、洛美沙星(LOM)、恩诺沙星(ENR)、氧氟沙星(OFL)、沙拉沙星(SAR)、双氟沙星(DIF)、氟罗沙星(FLE)、达氟沙星(DAN)、马波沙星(MAR)、奥比沙星(ORB)、依洛沙星(ENO)、司帕沙星(SPA)]:纯度≥98%,德国Dr. Ehrenstorfer公司;
乙腈、甲醇:色谱级(≥99.9%),美国J. T. Baker公司;
甲酸、氨水:色谱级(≥98%),上海阿拉丁生化科技股份有限公司;
ACQUITY UPLC BEH C18色谱柱:100 mm×2.1 mm,1.7 μm,美国Waters公司;
尼龙滤膜:0.22 μm,天津艾杰尔有限公司;
注射器:常州悦康医疗器材有限公司;
色谱自动进样小瓶:浙江爱吉仁有限公司;
高通量组织研磨仪:XINW-M24型,上海鑫翁科学仪器有限公司;
移液枪:10,20,50,100,1 000,5 000 μL,德国Eppendorf公司;
纯水机:Milli-Q Synergy型,默克化工技术(上海)有限公司;
高速涡旋仪:MS 3 basic小型,德国IKA公司;
台式离心机:DM0412型,深圳市易瑞生物技术股份有限公司;
氮吹仪:UGC-24C型,北京优晟联合科技有限公司;
超高效液相色谱—串联质谱联用仪:SCIEX QTRAP 5500+型,美国AB SCIEX公司。
1.2 试验方法
1.2.1 标准溶液配制 16种喹诺酮药物标准物质用甲醇配制标准储备液(1 mg/mL),-20 ℃密封避光贮藏备用,有效期6个月。用50%乙腈水溶液稀释16种喹诺酮药物的标准储备液,配制成1 μg/mL,100 ng/mL的单标溶液及16种喹诺酮混合标准溶液,4 ℃避光冷藏保存备用,有效期1个月。
1.2.2 样品前处理 取5.0 g基质样品于50 mL离心管中,加入 20 mL 80%乙腈(含0.2%甲酸)提取溶剂,涡旋3 min,4 000 r/min离心2 min,取5 mL上清液于15 mL离心管中,将Speedy Prep®-Quino 1净化柱的橡胶头置于离心管端口,将离心管—净化柱放置于样品架上,使用过柱仪过柱,填料上端滤过的提取液即为净化后的提取液,倒出至样品瓶或样品管中,备用。取适量样品用氮气(45 ℃)吹干,按V0.2% 甲酸水∶V甲醇为9∶1复溶,涡旋混匀,过0.22 μm滤膜,上机检测。
1.2.3 色谱与质谱分析条件
(1) 液相条件:色谱柱为Waters ACQUITY UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm);流动相A为0.2%甲酸水,流动相B为甲醇;流速0.35 mL/min;柱温40 ℃;进样量10 μL;梯度洗脱程序:0.00~5.00 min,90%~70% A;5.00~7.00 min,70%~50% A;7.00~7.10 min,50%~5% A;7.10~10.00 min,5%A;10.00~10.10 min,5%~90% A;10.10~13.00 min,90% A。
(2) 质谱条件:质谱离子源为电喷雾离子源(ESI);采用正离子扫描模式;多反应监测(MRM)检测方式;离子源温度550 ℃;电喷雾电压5 500 V;气帘气压力0.241 MPa(氮气);喷雾气压力0.379 MPa(氮气);辅助气压力0.379 MPa(氮气);离子源温度550 ℃。
1.2.4 方法学验证
(1) 检出限及定量限:空白羊肉基质经过前处理的提取、净化得到样品测试前的复溶液,用此复溶液稀释16种混合标准溶液,配制喹诺酮药物溶液,质量浓度梯度分别为0.05,0.1,0.2,0.5,0.8,1.0,2.0,5.0 ng/mL,UPLC-MS/MS测试后,根据SCIEX OS 软件得到标准曲线、线性方程、线性范围以及相关系数,以3,10倍的信噪比计算每种喹诺酮药物的检出限(LOD)与定量限(LOQ)。
(2) 基质效应:纯溶剂稀释标品,得到纯溶剂空白标准溶液,质量浓度梯度分别为0.05,0.1,0.2,0.5,0.8,1.0,2.0,5.0 ng/mL。空白基质复溶液稀释标品,得到基质标准溶液,质量浓度梯度分别为0.05,0.1,0.2,0.5,0.8,1.0,2.0,5.0 ng/mL。UPLC-MS/MS检测后得到纯溶剂标准曲线和空白基质匹配曲线。按式(1)计算基质效应。
(1)
式中:
ME——基质效应;
K1——空白基质匹配曲线斜率;
K2——纯溶剂标准曲线斜率。
(3) 添加回收率与精密度:精确称取5.0 g空白基质样品,分别加入5,20,100 μg/kg的16种喹诺酮混合标准溶液,按1.2.2的方法对基质样品进行处理,外标法基质匹配曲线定量,以加标回收率及相对标准偏差为评价指标,验证方法的准确性及精密度。
(4) 数据分析:运用 Excel 2010软件进行数据处理、计算,使用SolidWorks建模、绘图,使用Origin绘图,使用SPSS 23.0进行方差分析,试验结果以平均值±标准偏差表示。
2 结果与分析
2.1 色谱条件和质谱条件优化
2.1.1 色谱条件优化 由图1可知,当水相均为0.1%甲酸水,甲醇为有机相时,喹诺酮药物在色谱上相互分离程度较乙腈为有机相时的好,峰型更为尖锐。0.1%甲酸水—乙腈洗脱的噁喹酸及氟甲喹拖尾严重,且乙腈毒性较大,因此选用甲醇为有机相。此外,随着甲酸浓度的增加,部分化合物响应有稍微的降低或增加,但均满足所需的响应需求,为使整体响应值偏高,选用0.2%甲酸水—甲醇作为流动相。
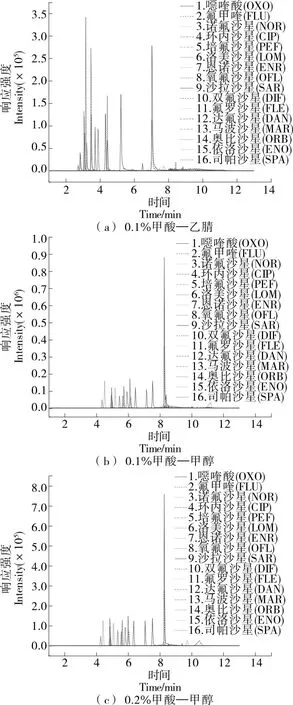
图1 不同流动相下16种喹诺酮药物标准溶液的MRM色谱图
2.1.2 质谱参数优化 由表1可知,16种喹诺酮药物保留时间为4.25~8.26 min,可在10 min内完成定性分析。
2.2 前处理条件优化
2.2.1 净化材料 由图2可知,净化柱从装有提取液的离心管端口下压使得提取液穿过复合填料,此过程中杂质被复合填料吸附,而目标分析物不被吸附,流穿的提取液即为净化后的提取液。分别对净化前和净化后的羊肉基质提取液中的杂质进行紫外测试,结果如图3所示。由图3可知,过柱后的提取液在波长<300 nm时紫外吸收值较未过柱的提取液有一定程度的降低,表明动物源性食品提取液经净化柱过柱后蛋白质等杂质有一定程度的减少,利用净化柱方法净化效果较好。
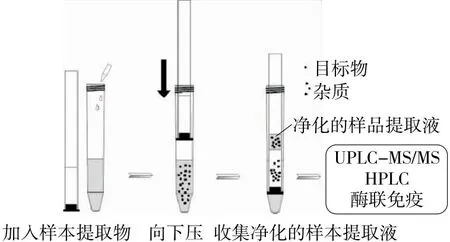
图2 净化柱净化样品提取液过程示意图
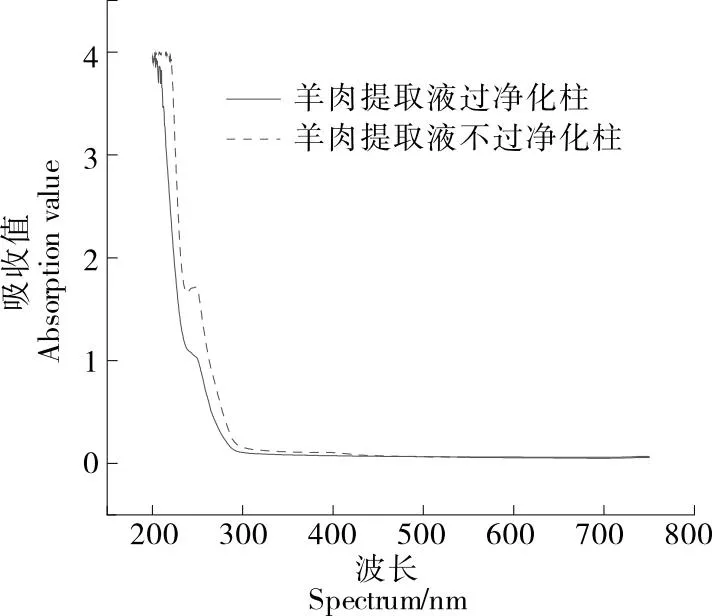
图3 羊肉基质净化前及净化后的紫外吸收对比图
2.2.2 过柱仪辅助净化 过柱仪辅助净化操作过程如图4所示,插入电源适配器通电,将离心管—净化柱放置于样品管架上,然后将待过柱的管架水平居中放入舱内运动板下方,启动仪器开始工作,工作流程结束后运动板自动复位,此时可取出离心管架,完成过柱。
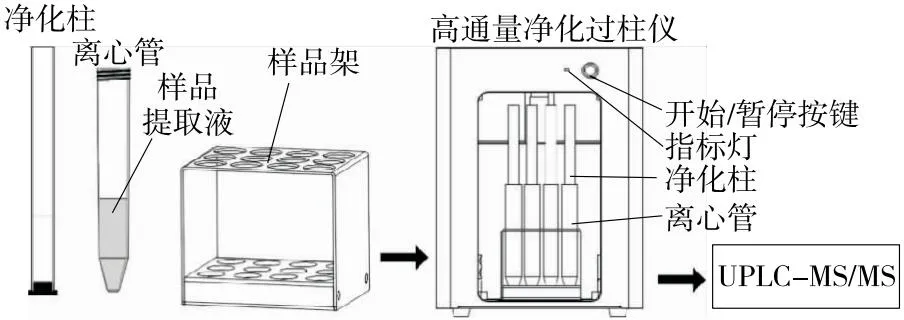
图4 过柱仪过柱示意图
2.2.3 提取溶剂 以羊肉为基质,探究不同浓度的乙腈水对回收率的影响。结果显示,随着有机溶剂的减少,提取液色素含量显著增高,提取液杂质增多,浑浊度增高,当乙腈浓度低于50%时,色素增加得更为明显。因此选择50%,60%,70%,80%,90%,100%乙腈分别对羊肉基质进行提取。当以90%,100%乙腈作为提取液时,大部分喹诺酮药物的回收率较低;当以50%,60%,70%乙腈水作为提取液时,噁喹酸、氟甲喹的回收率较低,尤其是氟甲喹的回收率低于60%。当以80%乙腈水作为提取液时,16种喹诺酮药物的回收率为73.12%~122.41%,提取效果较好。
为进一步提高部分喹诺酮药物的回收率,向80%乙腈水中分别添加氨水及甲酸,结果见表2。由表2可知,与80%乙腈水相比,当提取液中添加0.2%氨水时,大部分喹诺酮药物的回收率显著降低(P<0.05),而添加0.2%甲酸的提取液,9种喹诺酮药物的回收率均显著增加(P<0.05),尤其是依诺沙星的回收率由73.12%提升至97.39%。当甲酸添加量分别增加至0.5%,1.0%时,部分药物的回收率显著降低(P<0.05),可能是因为喹诺酮药物是两性化合物,一定的酸性条件促进了部分喹诺酮药物的溶解,而过酸条件下部分喹诺酮药物可能会有一定程度的降解[22]。与80%甲醇水(含0.2%甲酸)相比,当以80%乙腈水(含0.2%甲酸)作为提取液时,喹诺酮药物的回收率较高且具有显著性差异。因此,最终选择80%乙腈水(含0.2%甲酸)为提取溶剂。
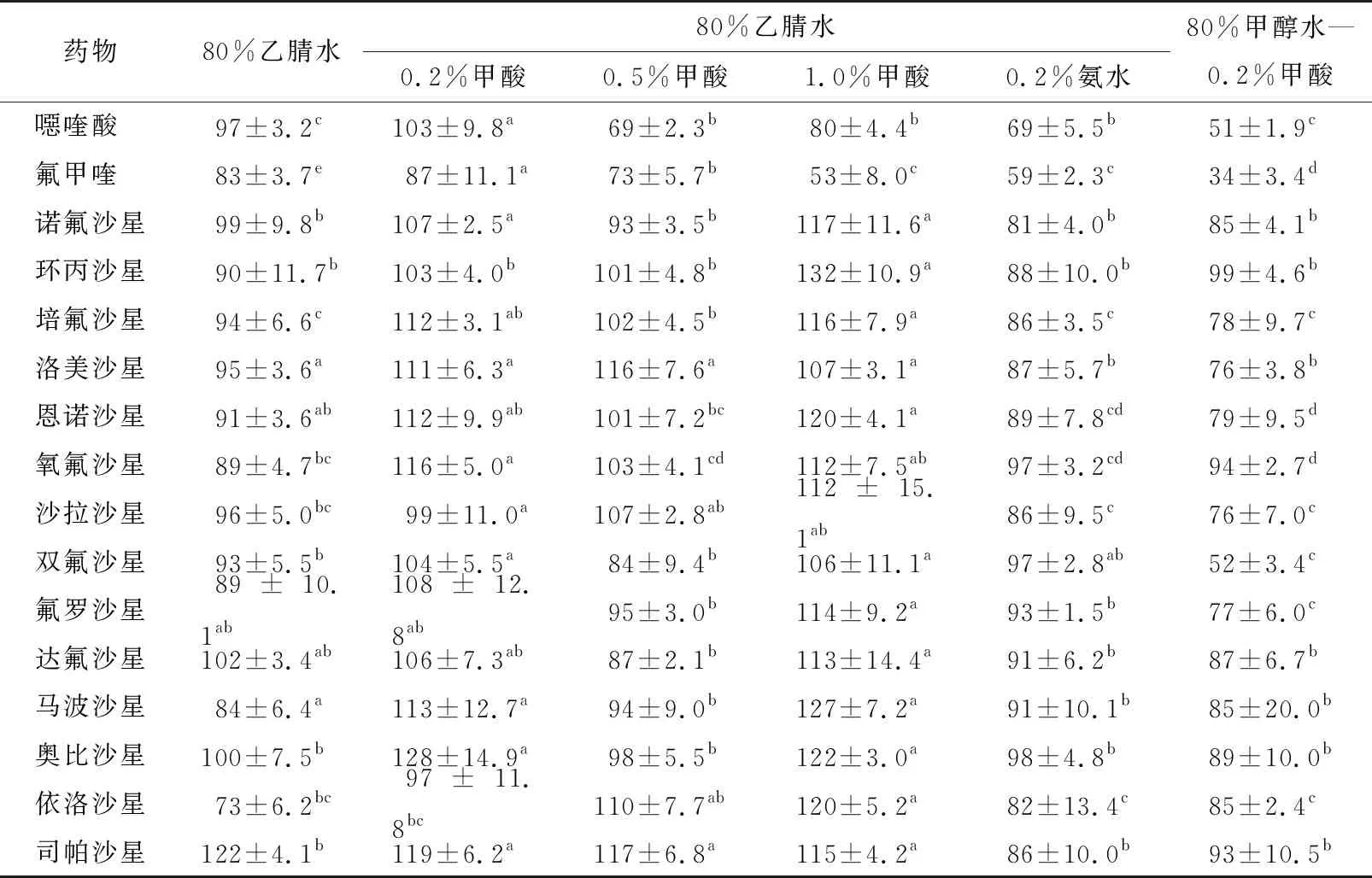
表2 不同提取溶剂下16种喹诺酮药物的回收率†
2.3 方法检出限和定量限
以羊肉基质为例,其基质标曲的检出限、定量限、线性范围、线性方程、相关系数如表3所示。羊肉基质在此方法检测下的16种喹诺酮类药物在1.6~40.0 μg/kg质量浓度范围内线性较好,相关系数r≥0.996 1,检出限为0.14~0.80 μg/kg,定量限为0.47~2.68 μg/kg。
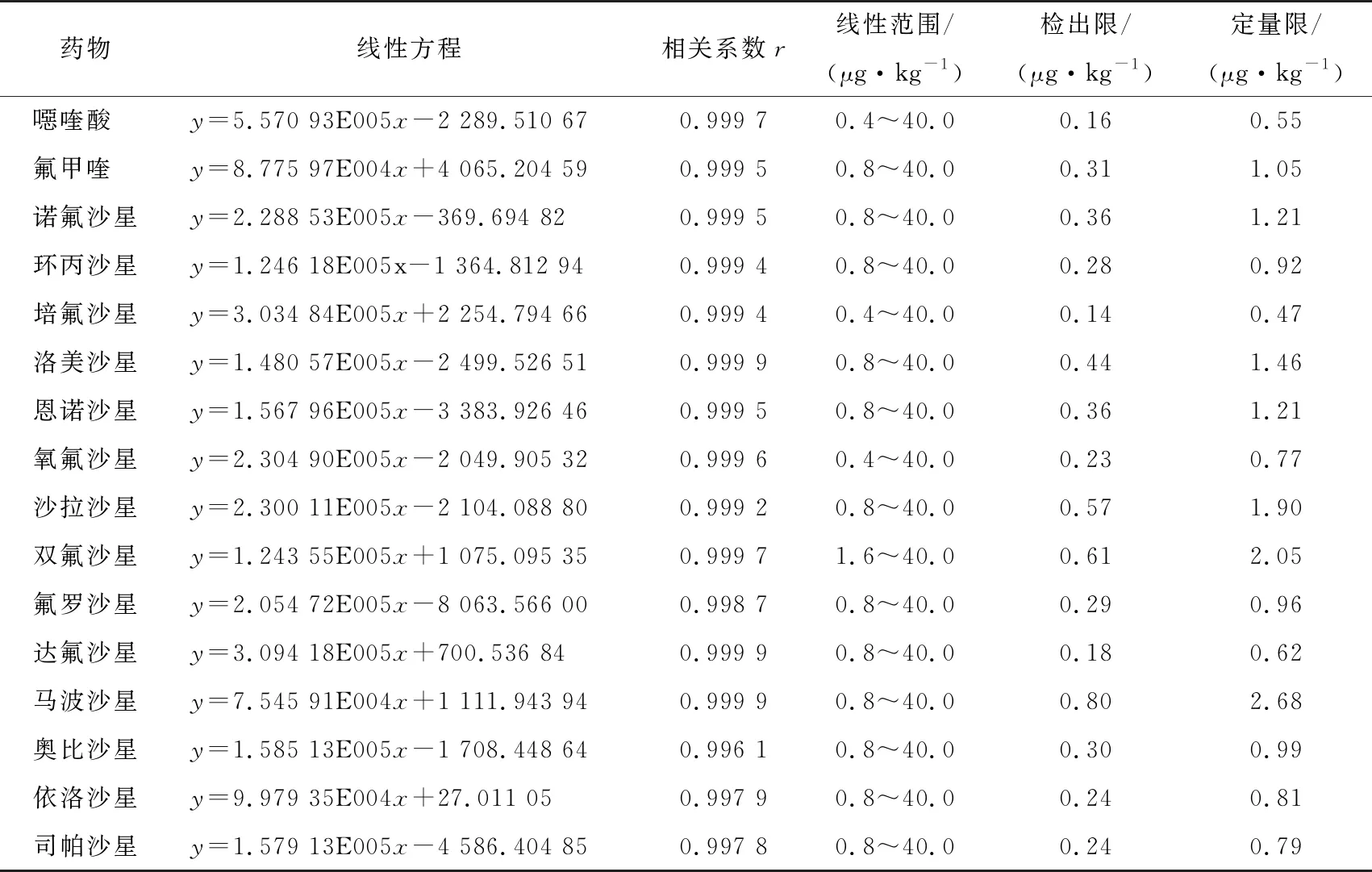
表3 16种喹诺酮药物的线性方程、相关系数、线性范围、检出限及定量限
2.4 基质效应
以羊肉基质为例,由表4可知,16种喹诺酮药物中有6种喹诺酮药物即噁喹酸、氟甲喹、环丙沙星、沙拉沙星、双氟沙星、奥比沙星受基质干扰程度大,表现为强基质效应,其中氟甲喹的基质效应最强,比值为0.29,其余10种基质效应为弱基质效应,可忽略不计。

表4 16种喹诺酮药物基质效应
2.5 回收率与精密度
以羊肉、鸭肉、牛肉、鱼肉、鸡蛋、猪腰、鸭皮为样品基质,使用建立的方法对其进行添加回收试验,进行方法验证和应用,结果见表5。由表5可知,羊肉基质的平均回收率为72%~109%,相对标准偏差为1.7%~11.0%;鸭肉基质的平均回收率为72%~112%,相对标准偏差为0.9%~13.0%;牛肉基质的平均回收率为72%~105%,相对标准偏差为1.6%~13.1%;鱼肉基质的平均回收率为74%~110%,相对标准偏差为2.6%~10.9%;鸡蛋基质的平均回收率为69%~110%,相对标准偏差为1.0%~18.7%;猪腰基质的平均回收率为62%~109%,相对标准偏差为1.5%~13.3%;鸭皮基质的平均回收率为71%~118%,相对标准偏差为1.8%~10.7%;7个基质的平均回收率为62%~112%,RSD为0.90%~18.7%,平均回收率均满足GB/T 27404—2008的要求,表明试验建立的方法适用基质广泛,准确度和精密度良好,稳定性好。
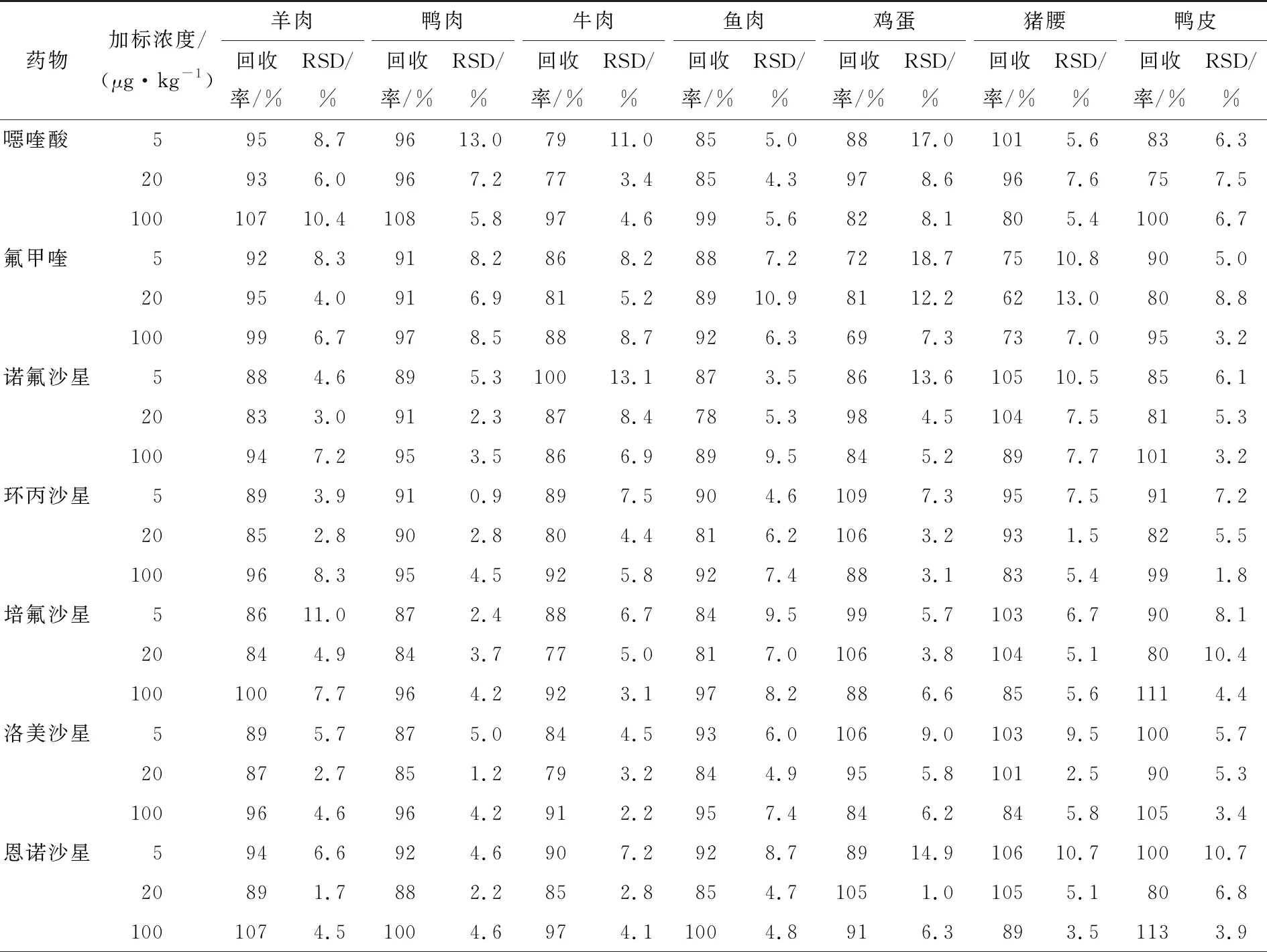
表5 16种喹诺酮药物在不同加标水平下的回收率及精密度
3 结论
建立了一种过柱仪辅助净化柱结合UPLC-MS/MS检测动物源性食品中16种喹诺酮药物的确证性定量方法。样品经80%乙腈水(含0.2%甲酸)提取溶剂进行提取,能减少部分杂质与目标化合物共提取。使用滤过型净化柱对提取液内杂质进行净化,相对于SPE小柱可减少净化过程中活化、淋洗、洗脱等步骤,解决了16种喹诺酮药物因杂质干扰导致的部分化合物回收率差及前处理过程复杂、耗时长的问题,配合使用过柱仪可一次性于20 s内完成12管样品的净化,增大了样品检测通量,提高了前处理净化效率。结合UPLC-MS/MS对每个化合物进行独立检测,其重现性好,灵敏度高,满足定性及痕量分析的检测需求。研究的不足在于对色素较深和基质较为复杂的动物源性食品可能需要进行2次及以上净化或减少净化量从而确保较好的净化效果,而此关键在于净化柱填料的选择及填料的使用量和待净化液量,以期在未来的净化柱产品填料选择以及方法建立上进行进一步优化。

