脓毒症继发急性肺损伤患者血清CCL25和PARK7表达水平及其临床价值研究
阮本良,邵 敏,韩晓洁(.合肥京东方医院重症医学科,合肥 3003;.安徽医科大学第一附属医院重症医学科,合肥 300)
脓毒症(sepsis)是重症监护病房患者死亡的主要原因,全球每年患病例数达5 000 万,死亡例数达1 100 万[1]。急性肺损伤(acute lung injury,ALI)是脓毒症最常见的并发症,可引起急性呼吸窘迫综合征,导致患者死亡[2]。探索脓毒症继发ALI 的生物学标志物,对疾病的早期诊治和预后具有重要意义。C-C 模体趋化因子配体25(C-C motif chemokine ligand 25,CCL25)属于CC 趋化因子家族成员,能与CC 族趋化因子受体9 结合,参与趋化树突状细胞、胸腺细胞和巨噬细胞[3]。研究发现,CCL25 能够激活肺上皮细胞表面的Toll 样受体4(toll like receptors,TLR4),破坏调节性T 细胞(regulatory cells,Tegs)与辅助性T17 细胞(T helper cell 17,Tn17)的平衡稳态,促进脓毒症时ALI 的发生[4]。人帕金森病蛋白7(Parkinson’s disease protein 7,PARK7)属于肽酶C56 蛋白家族成员,具有调节雄激素受体依赖的转录、细胞凋亡等过程[5]。研究发现,PARK7 能与NADPH 氧化酶亚基p47phox 相互作用,激活巨噬细胞,造成脓毒症时肺、心脏等器官组织的损伤[6-7]。目前脓毒症继发急性肺损伤患者血清CCL25,PARK7 表达及临床意义尚不清楚。本研究通过检测脓毒症患者血清CCL25 和PARK7 水平,分析两者在评估脓毒症继发ALI中的临床价值。
1 材料与方法
1.1 研究对象 选取2019年2月~2023年2月合肥京东方医院诊治的138 例脓毒症患者(脓毒症组)。纳入标准:①脓毒症诊断符合《中国脓毒症/脓毒性休克急诊治疗指南(2018)》的标准[8];②年龄>18 岁;③临床资料完整,均签署知情同意书。排除标准:①外科手术、意外创伤及溺水等因素导致的ALI;②并发恶性肿瘤;③并发自身免疫系统疾病或近期应用免疫抑制药物治疗者;④并发严重心、肾等脏器功能障碍;⑤并发血液系统疾病、帕金森病等神经系统疾病。脓毒症组中,男性84 例,女性54 例,平均年龄67.78±6.55 岁,平均体质量指数23.03±2.70kg/m2;参考中华医学会重症医学分会2014年制定的《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南》[9]对ALI 进行诊断,根据脓毒症患者住院期间是否继发ALI,分为ALI组(n=40)和非ALI 组(n=98)。以同期体检的70 例健康人为对照组,男性39 例,女性21 例,平均年龄66.93±6.14 岁,平均体质量指数23.10±2.58kg/m2。脓毒症组和对照组在性别、年龄及体质量指数比较,差异无明显统计学意义(χ2/t=0.511,0.903,0.179,均P>0.05)。本研究经医院伦理委员会批准通过。
1.2 试剂与仪器 人CCL25 酶联免疫吸附检测试剂盒(上海联迈生物科技有限公司,货号LM8H0065),人PAPK 7 酶联免疫吸附检测试剂盒(上海信裕生物科技有限公司,货号XY-PARK7-Hu),全波长酶标仪(美国赛默飞公司,型号Max Plus384)。
1.3 方法
1.3.1 观察指标:收集患者性别、年龄、体质量指数、感染部位(肺部、腹腔和泌尿系统)、高血压史、糖尿病史、冠心病史、有无气管插管机械通气等资料。收集入院后次日实验室检查指标,包括白细胞计数(WBC)、C 反应蛋白(CRP)、降钙素原(PCT)。收集患者入院24h 内肺功能及血气分析指标,包括第1 秒用力呼气容积占预计值百分比(forced expiratory volume in the first second,FEV1%)、第1 秒用力呼气容积占用力肺活量百分比(FEV1/forced vital capacity ratio,FEV1/FVC)、动脉氧分压(arterial partial pressure of oxygen,PaO2)、动脉二氧化碳分压(PaCO2)、呼吸指数(肺泡动脉氧分压差与PaO2比值)、氧合指数[PaO2/吸氧浓度×100%]。记录患者入院24h 内急性生理学与慢性健康状况评价Ⅱ(acute physiology and chronic health evaluationⅡ,APACHE Ⅱ)评分(分值范围0~71 分,分值越高,病情越重),序贯器官衰竭评分(sequential organ failure assessment,SOFA)(分值范围0~24分,分值越高,病情越重)。
1.3.2 血清CCL25,PARK7 水平检测:收集脓毒症组患者入院后第2日,对照组体检时清晨空腹静脉血5ml,室温3 000r/min 离心10min,留取上层血清。采用酶联免疫吸附实验测定患者血清CCL25,PARK7 水平,操作按照试剂盒说明书进行。根据标准品浓度值及450nm 处的吸光度值绘制标准曲线,计算样品浓度值。
1.4 统计学分析 应用SPSS 26.0 软件分析数据。呈正态分布的计量资料以均数±标准差(±s)表示,两组比较采用独立样本t检验。计数资料用率(%)表示,组间比较采用卡方检验。Pearson 法分析ALI 组患者血清CCL25,PARK7 水平与临床指标的相关性。多因素Logistic 回归分析脓毒症继发ALI 的影响因素。受试者工作特征曲线评估血清CCL25,PARK7 对脓毒症患者继发ALI 的预测价值。P<0.05 为差异有统计学意义。
2 结果
2.1 脓毒症组和对照组血清CCL25,PARK7 比较 脓毒症组血清CCL25,PARK7 水平分别为367.52±46.87ng/L,54.26±17.45μg/L,高于对照组(48.17±5.26 ng/L,12.31±4.12μg/L), 差异具有统计学意义(t=46.825,19.813,均P=0.000)。
2.2 影响脓毒症继发ALI 的单因素分析 见表1。ALI 组呼吸指数、PaCO2,APACHE Ⅱ评分、SOFA评分、CCL25,PARK7 均高于非ALI 组,而氧合指数、PaO2低于非ALI 组,差异具有统计学意义(均P<0.05)。
表1 单因素分析脓毒症继发ALI 的影响因素[n(%),±s]

表1 单因素分析脓毒症继发ALI 的影响因素[n(%),±s]
类 别非ALI 组(n=98)ALI 组(n=40)t/χ2P男性58(59.18)26(65.00)0.4030.525年龄(岁)67.59±6.9868.23±6.120.5060.614体质量指数(kg/m2)22.96±2.6523.19±2.740.4580.648感染部位 肺部40(40.82)18(45.00)腹腔30(30.61)13(32.50)0.5410.763泌尿系统28(28.57)9(22.50)高血压史46(46.94)21(52.50)0.3520.553糖尿病史23(23.47)12(30.00)0.6400.424冠心病史30(30.61)14(35.00)0.2520.616气管插管机械通气18(18.37)12(30.00)2.2590.133氧合指数341.14±21.37237.14±23.5625.1720.000呼吸指数0.88±0.071.58±0.4814.1450.000 PaO2(mmHg)63.11±7.1455.87±8.035.2100.000 PaCO2(mmHg)40.42±5.2050.11±6.279.3420.000 FEV1%(%)59.87±11.3463.15±9.221.6220.107 FEV1/FVC(%)65.27±9.1463.52±9.361.0130.313 C 反应蛋白(mg/L)80.14±8.2782.31±12.311.2040.231降钙素原(ng/ml)0.27±0.120.30±0.131.3000.196白细胞计数(×109/L)18.11±3.6419.24±3.791.6350.104 APACHE Ⅱ评分(分)17.15±3.4123.37±3.829.3850.000 SOFA 评分(分)10.18±2.8113.56±2.936.3320.000 CCL25(ng/L)340.12±42.64434.65±52.8710.9980.000 PARK7(μg/L)34.18±7.46103.47±22.5127.1510.000
2.3 血清CCL25,PARK7 水平与临床指标的相关性 见表2。ALI 组患者血清CCL25,PARK7与APACHE Ⅱ评分、SOFA 评分、呼吸指数、PaCO2呈正相关,与氧合指数、PaO2呈负相关(均P<0.05)。
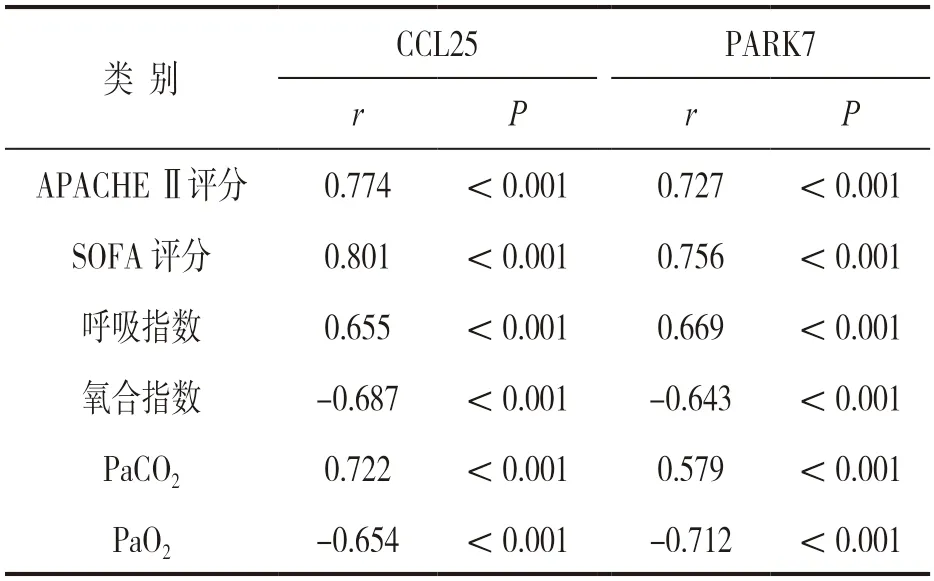
表2 血清CCL25,PARK7 水平与临床指标的相关性
2.4 影响脓毒症继发ALI 因素的多因素Logistic 回归分析 见表3。以脓毒症患者是否继发ALI 为因变量,以表1 中差异有统计学意义的因素(P<0.05,均为原值录入)为自变量进行回归分析,结果血清CCL25,PARK7,APACHE Ⅱ评分、SOFA 评分是影响脓毒症患者继发ALI 的独立危险因素。

表3 影响脓毒症继发ALI 的多因素logistic 回归分析
2.5 血清CCL25,PARK7 对脓毒症继发ALI 的预测价值 见表4,图1。血清CCL25,PARK7 联合检测对脓毒症继发ALI 预测的曲线下面积(95%CI)为0.833(0.784~0.872),大于单项指标检测0.770(0.725~0.835),0.741(0.691~0.790),差异具有统计学意义(Z=4.602,4.318,均P=0.000)。

图1 血清CCL25,PARK7 及联合检测对脓毒症继发ALI 的预测价值

表4 血清CCL25,PARK7 及联合检测对脓毒症继发ALI 的预测价值
3 讨论
急性肺损伤(ALI)是脓毒症最常见的脏器功能障碍,组织学主要表现为弥漫性肺泡损伤,死亡率约30%~50%[10]。目前脓毒症继发ALI 的疾病机制尚不清楚。深入研究脓毒症患者ALI 发生的病理生理学机制,寻找简单易行、稳定可靠的血清生物标志物,对于脓毒症继发ALI 的早期诊治,改善患者临床预后意义重大。
C-C 模体趋化因子配体25(CCL25)属于CC 趋化因子家族成员,表达于胸腺、小肠上皮等组织,参与白细胞趋化、免疫细胞发育分化及炎症反应等多种生物学过程[11]。研究发现,CCL25 能活化Toll样受体4(TLR4),激活核因子kB 通路,促进脓毒症小鼠肺组织损伤[11]。本研究中,脓毒症患者血清CCL25 水平升高,提示CCL25 与脓毒症的发生有关。研究表明,脓毒症时,细菌脂多糖能够磷酸化激活巨噬细胞中核因子κB,促进CCL25 转录及表达,CCL25 募集CC 族趋化因子受体9 阳性的淋巴细胞,加重组织免疫炎症性损伤[13]。本研究中,脓毒症继发ALI 患者血清CCL25 明显升高,表明CCL25 促进脓毒症继发ALI 的发生。研究表明,CCL25 能促进肺泡巨噬细胞中P38 的磷酸化激活,上调肿瘤坏死因子α,白介素-6 等促炎细胞因子表达,加重肺组织炎症反应,导致脓毒症患者ALI 的发生[14]。本研究观察到脓毒症继发ALI 患者血清CCL25 与PaCO2呈正相关,与氧合指数、PaO2呈负相关,提示血清CCL25 能够反映脓毒症继发ALI 患者肺泡通气和换气功能。分析其原因,CCL25 能结合中性粒细胞表面的CC 族趋化因子受体9,促进肺组织中性粒细胞的浸润,促炎炎症因子及中性粒细胞弹性蛋白酶能诱导肺泡上皮细胞的凋亡,增加肺微血管内皮屏障的通透性,导致肺泡中大量液体渗出,肺泡正常气体交换功能障碍[15]。本研究中,血清CCL25 是影响脓毒症患者ALI 发生的独立危险因素,表明血清CCL25 有助于评估脓毒症患者ALI 发生风险。研究表明,CCL25 能够通过促进中性粒细胞及巨噬细胞的浸润,促进肺泡毛细血管内皮屏障中紧密连接蛋白ZO-1 的降解,增加肺泡毛细血管内皮细胞屏障的通透性,促进ALI 的发生[16]。脓毒症小鼠动物模型中发现,CCL25 能够结合肺上皮细胞Toll 样受体4,促进辅助性T 淋巴细胞17 肺组织浸润,降低调节性T 细胞的水平,加重肺组织损伤[4]。有学者利用CCL25的特异性抗体对脓毒症小鼠进行治疗,结果肺血管内皮细胞屏障中的紧密连接蛋白的表达上调,肺粘膜屏障完整性增加,肺组织中炎性细胞因子水平降低,小鼠的存活率明显增加[14]。因此,CCL25 可能是新的评估脓毒症患者ALI 发生的血清标志物,值得临床关注。
帕金森蛋白7(PARK7)又称为DJ-1,广泛表达于神经元、肝脏及肺脏等组织中,与帕金森病、恶性肿瘤等疾病关系密切[17]。近年来发现,PARK7具有调控还原型辅酶I 磷酸酯(NADPH)氧化酶蛋白复合体稳定性,抑制免疫细胞的细菌杀伤效应,增加脓毒症患者器官衰竭和死亡的发生率[5]。本研究中,脓毒症继发ALI 的患者血清PARK7 升高,提示PARK7 参与促进脓毒症继发ALI 的发生。有学者报道,脓毒症时细菌内毒素能够刺激骨髓源性巨噬细胞,促进PARK7 mRNA 和蛋白表达升高[18]。研究证实,脓毒症中PARK7 的表达能够与p47phox 结合,破坏NADPH 氧化酶复合物的组装,促进NADPH 氧化酶2 的降解,抑制巨噬细胞等先天免疫细胞的功能,促进ALI 的发生,在PARK7-/-基因敲除鼠中进一步证实单核巨噬细胞的吞噬细菌清除能力更强,降低动物的死亡率[18]。本研究中,脓毒症继发ALI 患者血清PARK7 水平与病情程度有关,提示PARK7 促进脓毒症继发ALI 患者的病情进展。分析其原因,可能是PARK7 的表达抑制机体的抗氧化及细菌清除能力,造成肺血管内皮细胞及肺泡壁的损伤,加重ALI 的病情程度。研究表明,PARK7 能与自噬相关基因Rubicon 结合,促进Rubicon 降解,导致骨髓来源巨噬细胞吞噬作用降低,体外和体内细菌清除率降低,加重脓毒症患者肺组织损伤[19]。本研究中,血清PARK7 是影响脓毒症患者ALI 发生的独立危险因素,表明血清PARK7 有助于评估脓毒症继发ALI 的风险。分析其机制,脓毒症中PARK7 能够促进活性氧产生,激活巨噬细胞Toll 样受体信号通路,大量肿瘤坏死因子α,白细胞介素-1 分泌,导致肺血管内皮细胞及肺泡壁的凋亡,同时巨噬细胞极化为M2 表型,机体处于免疫抑制状态,增加脓毒症患者ALI 的发生风险[6,20]。本研究中,血清CCL25,PARK7 联合对脓毒症继发ALI 诊断的曲线下面积为0.833,敏感度、特异度分别为0.785,0.790。联合检测的诊断效能明显大于单项指标,提示CCL25 和PARK7 联合诊断对脓毒症继发ALI 具有较高诊断价值。因此,PARK7 可能是脓毒症免疫抑制的潜在生物标志物,检测血清PARK7 水平可能有助于评估脓毒症患者继发ALI 的风险,为指导临床诊治提供新思路。
综上所述,脓毒症继发ALI 患者血清CCL25,PARK7 水平升高,两者表达水平与病情严重程度有关,促进脓毒症继发ALI 的病情进展。血清CCL25,PARK7 水平升高是脓毒症患者继发ALI的独立危险因素,联合检测血清CCL25,PARK7对脓毒症继发ALI 有较高诊断价值,为医生临床早期诊治提供参考。但本研究存在一定的不足,本研究样本量有限,并且未能对脓毒症继发ALI 患者血清中的动态变化进行持续监测,有待今后扩大样本量,进行深入的临床研究,进一步探讨两者的临床意义。

