2020~2022年度上海及其他省市临床实验室HPV6与HPV11型核酸检测室间质量评价结果分析
徐 幸,王国飞,杨依绡,肖艳群,周 靖(上海市临床检验中心分子生物学室,上海 200126)
人乳头瘤病毒(human papillomavirus,HPV)是一种小而无包膜的双链DNA 病毒[1]。DNA 序列分析发现HPV 至少有200 多个基因型,不同型别的HPV 引起不同类型的细胞病理变化[2]。HPV 分为高危型(high risk,HR)、可能高危型和低危型(low risk,LR)[3]。女性外阴感染以LR-HPV 为主,如HPV6,HPV11 等[4]。HPV6,HPV11 感染多表现为尖锐湿疣(condyloma acuminata,CA)和复发性呼吸道乳头瘤状病(recurrent respiratory papillomatosis,RRP)等[5-6]。CA 潜伏期一般在3 周~8 个月,常以亚临床感染形式存在,传染性强、复发率高,临床治疗较为棘手[7-9]。RRP 是良性肿瘤,发病率约为4/100 000 万例儿童,具有复发性、多侵犯声门、远处转移、恶变可能等特点[10-11]。HPV6,HPV11 型核酸检测在临床已广泛开展,检测方法包括质谱、基因分型和PCR 定量等,临床更多采用基因分型和PCR 定量检测[12]。目前,国内外缺乏关于实验室HPV6,HPV11 检测能力的研究,本研究自2020年起通过自行制备、验证及评价HPV6,HPV11 室间质量评价(external quality assessment,EQA)样本,开展EQA 活动,评估参评实验室的检测能力,帮助实验室分析问题,提高检测质量。
1 材料与方法
1.1 研究对象
1.1.1 参评实验室:2020~2022年间参加EQA 活动的实验室163 家,包括全国二、三级医疗机构和第三方独立实验室。
1.1.2 EQA 阳性样本:收集具有典型CA 临床表现,HPV6,11 型核酸结果阳性患者的宫颈分泌物(上海市第一妇婴保健院提供),混合后用生理盐水稀释成Ct值在22 和30 左右的两个浓度,0.5ml/支分装。EQA 阴性样本:将C-33A 细胞株(中科院)培养在DMEM(含10ml/dl 胎牛血清)培养液中,置37℃,5ml/dl CO2培养箱内,2 次/周传代,第10 代时2 000r/min 离心,收集细胞,生理盐水重悬后调整至104个/ml,0.5ml/支分装。
1.2 仪器与试剂 CO2培养箱(德国Memmert 公司);ABI 7500 荧光定量PCR 仪(美国Thermo Fisher Scientific 公司);Centrifuge 5424R 高速离心机(德国Eppendorf 公司);DMEM 培养液,胎牛血清(Gibco 公司);0.01mol/L 磷酸盐缓冲液(上海生工);HPV6/11 型检测试剂盒(上海之江)。
1.3 方法
1.3.1 EQA 方案设计:EQA 活动一年两次,样本盘含5 份样本,HPV6,11 高低浓度各1 支,阴性样本1 支,随机编号后冷链至实验室。实验室在样本接收起1 周内,用常规检测系统(仪器+试剂+方法)检测并通过网络系统上报。
1.3.2 EQA 样本验证与评价
1.3.2.1 PCR+膜杂交法:抽取样本盘一份,用HPV 分型检测试剂盒(凯普生物,PCR+膜杂交法)检测。阳性:Biotion 对照和HPV 杂交点同时显色,阳性点为清晰可见蓝色原点。阴性:只有Biotion对照及内对照(IC)显色。结果判读见图1。
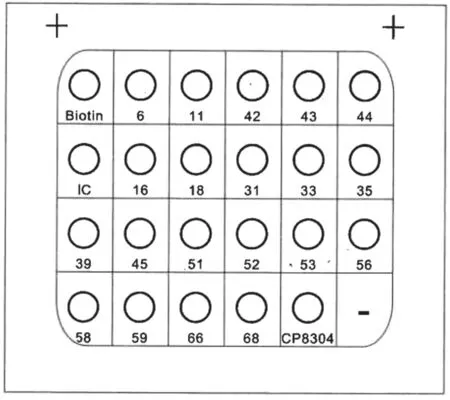
图1 PCR+膜杂交法结果判读图
1.3.2.2 实时荧光PCR 法(qPCR 法):抽取样本盘一份,用HPV6/11 型核酸测定试剂盒(上海之江)检测。阴性质控Ct值:UNDET 或40,阳性质控:Ct值≤35。阳性:待测样本Ct值≤38,扩增曲线呈典型S 型。阴性:非典型S 型。
1.3.2.3 PCR 毛细电泳片段分析法:抽取样本盘一份,用HPV 核酸检测及基因分型试剂盒[PCR 毛细电泳片段分析法(海尔施基因)]检测。有效样本的结果中应出现pcDNA(峰高≥500RFU)和β-globin特异峰。因细胞量太少导致未出现β-globin 特异峰,但出现特异HPV 型别的峰时,仍为有效样本。阳性对照峰高:750RFU~15600RFU。阳性:特异HPV型别的峰高≥300RFU。
1.3.2.4 均匀性评价:参照CNAS-GL003:2018《能力验证样品均匀性和稳定性评价指南》要求,从能力验证样品中随机抽取HPV6,HPV11 高低浓度样本各10 支,用试剂盒(上海之江)检测,每支样本重复检测2 次。
1.3.2.5 稳定性评价:参照CNAS-GL003:2018《能力验证样品均匀性和稳定性评价指南》要求,选取同一批号HPV6,HPV11高低浓度、阴性样本各6支,2~8℃保存7 天,在结果上报截止日前后3日内,用试剂盒(上海之江)检测,每支样本重复检测1 次。
1.4 统计学分析 依据回报结果统计参评实验室的得分,回报结果与预期相符计20 分,与预期不符计0 分,得分≥80 分EQA 成绩合格,<80 分不合格。采用Microsoft Excel 2016 软件作为数据统计分析工具,计算实验室的合格率、样本总体符合率、假阳性率和假阴性率。
2 结果
2.1 EQA 样本验证与评价结果
2.1.1 PCR+ 膜杂交法:见图2。结果依次为HPV6,HPV6,HPV11,HPV11,阴性,均符合预期靶值。

图2 PCR+膜杂交法结果图
2.1.2 qPCR 法:见图3。结果均符合预期靶值。

图3 qPCR 法扩增曲线图
2.1.3 PCR 毛细电泳片段分析法:见图4。结果依次为HPV6,HPV6,HPV11,HPV11,阴性,均符合预期靶值。

图4 PCR 毛细电泳片段分析结果图
2.1.4 EQA 样本均匀性和稳定性评价:采用qPCR
法进行检测,结果均符合预期靶值,见图5,图6。表明样本具有良好的均匀性和稳定性,可满足样本发放和传递的要求。

图5 均匀性评价qPCR 法扩增曲线图
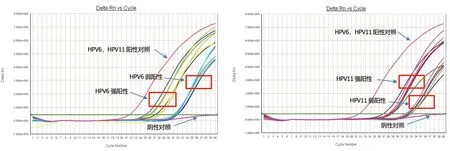
图6 稳定性评价qPCR 法扩增曲线图
2.2 参评实验室结果回报 2020~2022年共计发出样本盘163 份,收回有效报告140 份,有效回报率依次为90.91%(40/44),80.95%(51/63)和87.50%(49/56)。参评实验室使用最多的试剂品牌为湖南圣湘,其次为上海之江。实验室最常用的方法为qPCR 法,占84.29%(118/140),其次是杂交法10.71%(15/140)和电泳法5.00%(7/140)。
2.3 EQA 结果 实验室总体合格率为96.43%(135/140),三年间合格率依次为92.5%(37/40),98.04%(50/51)和97.96%(48/49)。样本总体符合率97.86%(685/700),共15 个检测错误,假阴性率1.86%(13/700),假阳性率0.29%(2/700)。弱阳性10 个,占假阴性结果的76.92%(10/13)。预期靶值、符合率、假阳性率及假阴性率见表1。

表1 样本靶值、符合率、假阳性率及假阴性率[%(n)]
3 讨论
准确检出HPV6,11 感染对诊断尖锐湿疣(CA)和复发性呼吸道乳头瘤状病(RRP)具有重要意义,随着基因检测的检出限越来越低,检测结果的准确度和可靠性也越来越受到挑战。稀释低浓度水平核酸样品,扩增定量和传感过程中引入的偏差都给最终结果带来很大的不确定度[13]。
本研究通过组织EQA 活动,对实验室检测质量进行有效评估。报告显示,错误集中在假阴性,造成的原因较为复杂,可总结以下几点:①试剂储存或运输条件不当导致Tag DNA 聚合酶活性不足或丧失;②实验人员操作不当:未充分混匀样本和抽提液致核酸获得率低;③离心机离心效果差导致未分离出目标DNA;④PCR 扩增仪温控、灯源损坏或未正确设置扩增程序等导致扩增失败;⑤一次性耗材存在PCR 抑制剂。建议实验室从以下几个方面改进:①使用弱阳性样本进行试剂质检,增加弱阳性质控;②规范实验操作,强化人员培训,完善实验室质量管理体系、保证合理分区[14];③定期校准设备如离心机、金属浴、移液器等;④使用蒸馏水浸泡冲洗、高压灭菌后的一次性耗材,消除或部分消除外源性抑制剂的影响[15]。
值得关注的是,第3 轮EQA 活动中一家实验室出现了2 个弱阳性样本假阴性。实验室使用试剂A(无内标,qPCR 法),阴阳性质控在控,仪器与试剂均在效期内。错误原因为实验人员在抽提核酸时未离心EQA 样本,直接向样本管内加入核酸抽提剂,核酸产物未达试剂A 检测下限(1×103copies/ml)。第5轮EQA 活动中,一家实验室同样出现了2 个弱阳性样本假阴性,该实验室使用试剂B(外源性内标,qPCR 法),阴阳性质控、内标结果均在控,该内标可监测因核酸提取及扩增过程中PCR抑制物、仪器及耗材的不良影响而造成的假阴性。需要注意的是,因外源性内标在反应中会与目的基因产生竞争性关系,对反应过程产生影响[16],若靶标检测结果为阴性,即使外源性内标结果正常也应警惕因提取或扩增效率不足所致的假阴性。第5 轮EQA 中,一家实验室出现了1 个弱阳性样本假阴性,该实验室使用试剂C(内源性内标,PCR+膜杂交法),阴阳性质控在控,假阴性结果的内标信号未起线。在排除样本保存不当、核酸降解等因素后,推测原因为不良的提取或扩增过程导致该孔扩增失败。建议实验室关注内标情况,若内标信号未起线,无论靶基因有无曲线,均提示实验环节出现问题,实验室应寻找原因,复检样本,防止发生检测错误。
假阳性的原因可能是:①人员操作(如交叉污染)或实验室污染(如气溶胶)[17];②PCR 仪的性能差异等质量问题造成非特异扩增。建议实验室:①若存在核酸污染,第一时间查找污染源和污染原因,明确原因后采取有效的去污染措施[18];②加强人员培训,增加阴性质控数量并随机摆放,对仪器进行清洁和去核酸,不同分区使用各自的清洁用具以防交叉污染,对使用后的实验室清洁消毒[19];③试剂配制、核酸提取、PCR 扩增等环节按要求分区操作;④检测系统使用前进行方法学性能验证;⑤因参评实验室收到的样本编号不同,不排除实验室之间比对数据,上传错误的实验结果。
本研究使用的EQA 样本为稀释的临床样本与培养的细胞株制成,可最大程度模拟临床样本监督实验室检测质量。不足的是低浓度样本Ct值在30左右,无法评估实验室检测更低浓度临床样本的能力。中心拟在2023年EQA 计划中改进此不足,制备发放更低浓度的EQA 样本,进一步帮助实验室提高此方面的检测质量。
综上所述,大部分实验室检测HPV6,11 能力良好,个别实验室弱阳性样本的检出能力有待提高。分析EQA 长期数据后发现,参加时间越久,实验室检测能力提高越明显[20]。EQA 活动中出现错误的实验室在下一次活动中均未再发生相同的错误,说明实验室通过参加EQA 活动能够发现检测过程中的不足,在分析原因并做好纠正措施后,可有效提高检测质量,为临床治疗及用药提供有力的帮助。

