不同营养条件对凤眼蓝生长及根际微生物群落的影响
刘芳宇, 孙林鹤, 常雅军, 刘吉祥, 刘晓静, 徐迎春, 姚东瑞,①
〔1. 南京农业大学园艺学院, 江苏 南京 210095; 2. 江苏省中国科学院植物研究所(南京中山植物园):a. 江苏省水生植物资源与水环境修复工程研究中心, b. 江苏省植物资源研究与利用重点实验室, 江苏 南京 210014〕
凤眼蓝〔Eichhorniacrassipes(Mart.) Solms〕,又名凤眼莲、水葫芦、水浮莲,是雨久花科(Pontederiaceae)凤眼蓝属(EichhorniaKunth)多年生浮水植物,为全球著名的入侵植物之一[1],[2]9,自引种以来入侵中国南方各地水域,对水体水质、航道及生物多样性造成了严重危害。过度繁殖的凤眼蓝往往会形成极为密集的群落覆盖水面,消耗水体中溶解氧,隔绝水体与外界的气体交换,使水质恶化;同时会淤塞航道,阻碍船只通行;凤眼蓝漂浮在水面与原生种竞争光源、O2和养分,压缩原生种自然生长空间,降低水体生物多样性[1]。
凤眼蓝能够在世界各地淡水水体中成功定殖、建立种群并扩散[3-4],主要是由于该物种具有强大的繁殖能力、宽生态幅以及高表型可塑性等入侵特性[2]104-105,[5]。凤眼蓝既可以进行有性繁殖,又可以进行无性繁殖[1]。在入侵过程中,凤眼蓝原有的三型花柱繁育系统由于奠基者效应而解体[2]99,旺盛的营养繁殖成为凤眼蓝快速增殖并爆发的生物学特性基础。水体富营养化是中国水环境面临的严峻问题之一[6],而凤眼蓝能够利用富营养化水体中的营养元素[7-11]。诸多研究结果表明:水体中氮、磷含量是限制凤眼蓝生长和繁殖的重要因子,甚至超过掠食者对其影响[10];水体中充足的氮、磷元素能够使凤眼蓝存活越冬[11]、快速生长及分株[12],[13]12,在一定浓度范围下,凤眼蓝的净生长量与水体中氮、磷含量呈正比[14-15]。
水生植物与根际微生物间的互作对植物生长有重要的影响。水生植物根系能够为微生物提供栖息地,并能够通过分泌代谢物、改变微环境进而改变根际微生物的群落结构[16],而富集于植物根际的微生物也能够从多个方面促进植物生长[17]。例如:相较于粳稻(Oryzasativasubsp.japonicaKato),籼稻(Oryzasativasubsp.indicaKato)根系富集氮代谢相关细菌的能力更强,这些氮代谢相关细菌能够增加籼稻对土壤中氮的利用效率[18]。植物根系为丛枝菌根真菌提供栖息地和必要的营养物质,而丛枝菌根真菌能促进难溶磷酸盐溶解,进而增强植物对磷的利用[17]。水生植物也能够通过影响根际微生物群落结构进而影响水体中氮、磷等营养元素的去除效率[16]。此外,根际微生物还有分泌促进植物生长的代谢物以及抑制植物病原菌生长和繁殖等功能[19-20]。一些研究证实凤眼蓝能够影响水体中微生物的群落构成,促进凤眼蓝对水体中氮、磷元素的利用[21-22]。目前,水体缺乏氮、磷对抑制凤眼蓝生长的影响尚未有系统报道,其机制还有待深入研究。
本文通过设计不同的缺素实验组,与全营养对照组进行比较,分析凤眼蓝形态、光合作用、抗氧化系统、氮含量、磷含量及根际微生物群落对不同营养条件的响应,并探讨水体中氮、磷含量对凤眼蓝生长和繁殖的影响,以期阐释影响凤眼蓝快速生长的关键因子,为治理凤眼蓝爆发提供理论依据。
1 材料和方法
1.1 材料
供试凤眼蓝于2022年12月5日采自成都新津地区(东经103°57′05.57″、北纬30°51′06.99″),2022年12月8日种植于江苏省中国科学院植物研究所温室(东经118°50′14.72″、北纬32°03′22.15″),选取无病害、具6或7枚叶片、无匍匐茎、生物量接近的凤眼蓝进行实验。
1.2 方法
1.2.1 实验设计 使用长46 cm、宽36 cm、高14 cm的塑料盆,分别加入纯水配置全营养(NP)、缺氮(QN)和缺磷(QP)3种改良Hoagland营养液(北京酷来搏科技有限公司)各10 L,以NP为对照,各处理组营养液的组成见表1。每个处理组设置3个生物学重复,共9盆,每盆3株凤眼蓝。于室温(25±1) ℃、光照度5 000 lx、光照时间14 h·d-1的培养室中进行实验;实验自2023年3月15日开始,至4月26日结束,共42 d,培养期间及时去除枯叶、腐根,于实验中期(处理21 d)更换1次营养液。
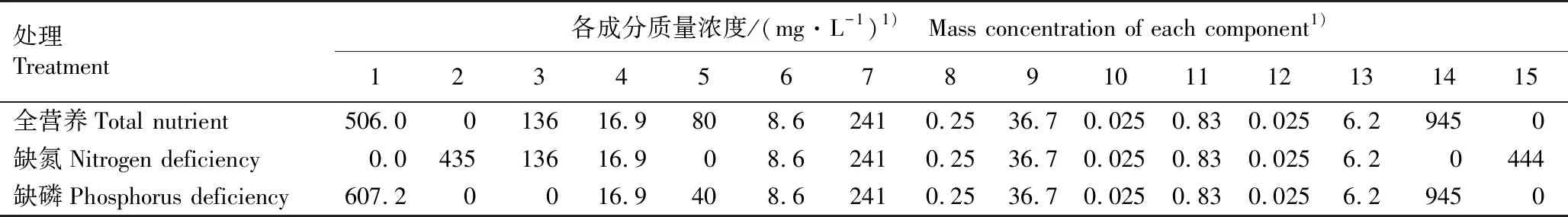
表1 不同处理组改良Hoagland’s营养液的组成
1.2.2 指标测定
1.2.2.1 生长指标测量 实验开始后每6 d进行1次生长指标测量。统计每株凤眼蓝的叶数和分株数。
将凤眼蓝悬空沥干水分,使用百分之一电子天平称量每株凤眼蓝的鲜质量;使用直尺(精度1 mm)测量每株凤眼蓝的主根长(短缩茎至主根根尖的距离)、株高(短缩茎至叶片最高处的距离)、匍匐茎总长(匍匐茎发生处到新分株结合处的基段长度之和);各处理随机从3株的茎尖外围第3至第5枚叶片中选取3枚成熟新叶片,使用直尺测量叶宽(叶片最宽处的宽度)和叶长(叶柄与叶片结合处至叶片顶端的距离)。于实验结束后,使用百分之一电子天平称量每株凤眼蓝的根部和冠部鲜质量,并计算根冠比(根部鲜质量与冠部鲜质量的比值);使用佳能EOS M6相机(日本Cannon公司)对凤眼蓝植株进行拍照。
1.2.2.2 叶绿素相对含量测定 实验开始后使用SPAD-502Plus叶绿素检测仪(日本Konica Minolta公司)每6 d测定1次叶绿素相对含量,各处理随机从3株上选取10枚无病斑的成熟新叶片进行测定,结果以均值计。
1.2.2.3 部分光合参数测定 实验开始后使用LI-6800型便携式光合测定仪(美国LI-COR公司)每6 d的9:00至11:00测定1次光合参数,包括净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)。使用叶室面积为2 cm2,环境CO2浓度400 μmol·mol-1,温度25 ℃,空气相对湿度75%,光源为90%红光,光合有效辐射1 500 μmol·m-2·s-1。各处理随机从3株上选取10枚无病斑的成熟新叶片进行测定,结果以均值计。
1.2.2.4 抗氧化酶活性和丙二醛含量测定 实验开始后每10 d的9:00取样1次,各处理随机从3株上选取2 g左右无病斑的成熟新叶片及成熟根,置于离心管,液氮速冻后于-80 ℃冰箱保存。使用过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)和丙二醛(MDA)4种ELISA试剂盒(江苏晶美生物科技有限公司)测定抗氧化酶活性和MDA含量。
1.2.2.5 氮、磷含量测定 实验结束后,各处理随机从3株上选取1~2 g无病斑的成熟新叶片及成熟根,采用NY/T 2419—2013中的自动定氮仪法测定叶片和根中氮含量,采用NY/T 2421—2013中的钼锑抗比色法测定叶片和根中磷含量。
1.2.2.6 根际微生物群落分析 实验结束后,采用李淑英等[23]的方法收集凤眼蓝根际水样1 L以上。使用定量滤纸过滤,收集的过滤液依次使用孔径0.45和0.22 μm滤膜抽滤。收集孔径0.22 μm滤膜,置于离心管,液氮速冻后交由北京诺禾致源科技股份有限公司进行16S扩增子测序。
1.3 数据统计和分析
除微生物数据外,使用SPSS 26.0软件对各项指标进行单因素方差分析(one-way ANOVA)和多重比较(LSD法和Duncan’s法),使用WPS Office 11及Origin 2022软件进行数据处理和图表制作。使用QIIME 1.9.1软件对16S扩增子测序获得的序列进行注释,获得各样本的OTU(operational taxonomic unit)。对OTU进行物种注释,选取相对丰度前20的属绘制热图,并进行Kruskal-Wallis秩和检验。采用邓娇娇等[24]的方法计算OTU的Shannon-Wiener指数,进行α多样性分析,并进行t-test检验;对β多样性进行主成分分析。使用FAPROTAX 1.2.6软件对OTU进行功能预测,选取相对丰度前20的功能类群绘制热图,并进行Kruskal-Wallis秩和检验;对固氮微生物类群的相对丰度进行Wilcoxon秩和检验。使用R 4.0.3软件绘图和分析。
2 结果和分析
2.1 不同营养条件对凤眼蓝生长的影响
全营养(NP)、缺氮(QN)和缺磷(QP)处理对凤眼蓝生长指标的影响见表2。结果显示:与NP组相比,QN和QP组鲜质量在处理0~18 d无显著差异,在处理24~42 d均显著降低;但QN组与QP组间鲜质量在处理0~42 d均无显著差异。QN和QP组处理42 d的鲜质量均低于处理0 d,而NP组处理42 d的鲜质量较处理0 d增加1倍以上。表明凤眼蓝在全营养的Hoagland营养液中生长旺盛,Hoagland营养液适于作为凤眼蓝正常生长对照组,缺氮和缺磷处理均能限制凤眼蓝生长。

表2 不同营养条件对凤眼蓝生长指标的影响
与NP组相比,QN组叶数在处理0~30 d无显著差异,在处理36~42 d显著减少;QP组叶数在处理0~18 d无显著差异,在处理24~42 d显著减少;QP组叶数在处理42 d显著少于QN组。与NP组相比,QN和QP组分株数和匍匐茎总长在处理0~12 d均无显著差异;在处理18~42 d均显著降低,且随处理时间延长,差异越大;而QN组与QP组间分株数和匍匐茎总长在处理0~42 d均无显著差异。表明缺氮和缺磷处理18 d后能够显著抑制凤眼蓝匍匐茎发生,但缺氮处理与缺磷处理的效果差异不显著;相较于缺氮处理,缺磷处理对凤眼蓝叶片发育的抑制作用更明显。
除处理12 d的QP组株高显著低于其余2组外,3组间主根长和株高在各时段均无显著差异;在处理42 d,QP组主根长最长,NP组次之,QN组最短。表明相较于缺氮处理,缺磷处理更能促进凤眼蓝根部发育。
与NP组相比,QN和QP组叶长在处理0~42 d均无显著差异,QP组叶长在处理42 d显著低于QN组。与NP组相比,QN和QP组叶宽在处理0~12 d无显著差异,在处理18~42 d显著降低;QP组叶宽在处理36~42 d显著低于QN组。表明缺氮和缺磷处理对凤眼蓝叶长的抑制效果不明显,对叶宽的抑制效果明显,且缺磷处理对叶宽的抑制效果强于缺氮处理。
从根部和冠部的质量分布(表3)看,处理42 d,QP组根部鲜质量显著高于QN和NP组,QN组略高于NP组;NP组冠部鲜质量显著高于QN和QP组,QN组略高于QP组;QP组根冠比(2.09)最高,QN组(1.37)次之,NP组(0.65)最低,且3组间差异显著。表明凤眼蓝在缺氮和缺磷处理下根发育显著强于叶发育,且缺磷处理的效果显著强于缺氮处理。

表3 不同营养条件处理42 d的凤眼蓝根部和冠部的质量分布
从外观形态(图1)看,与NP组相比,处理42 d的QN和QP组凤眼蓝植株明显矮小、分株数少、叶数少,匍匐茎短,且叶片出现明显枯黄现象,其中QP组受抑制现象更为明显。

NP: 全营养Total nutrient; QN: 缺氮Nitrogen deficiency; QP: 缺磷Phosphorus deficiency.
总体上看,缺氮和缺磷处理对凤眼蓝主根长、株高和叶宽的抑制效果不明显,但在处理后期能显著抑制凤眼蓝鲜质量、叶数、叶宽、分株数和匍匐总生长,其中,缺氮处理与缺磷处理对凤眼蓝鲜质量、分株数和匍匐茎总长的抑制效果差异不显著,但缺磷处理对凤眼蓝叶发育的抑制效果以及对根发育的促进效果显著强于缺氮处理。
2.2 不同营养条件对凤眼蓝光合作用的影响
全营养(NP)、缺氮(QN)和缺磷(QP)处理对凤眼蓝叶片光合作用指标的影响见表4。

表4 不同营养条件对凤眼蓝叶片光合作用指标的影响
2.2.1 对叶片叶绿素相对含量的影响 结果(表4)显示:与NP组相比,QN组叶片叶绿素相对含量在处理0~6 d 无显著差异,在处理12~42 d均显著降低;QP组叶片叶绿素相对含量在处理0 d及18~36 d无显著差异,在处理6~12 d显著升高,在处理42 d显著降低。表明相较于缺磷处理,缺氮处理对凤眼蓝叶片叶绿素合成的抑制作用更明显。
2.2.2 对叶片光合参数的影响 结果(表4)显示:除处理42 d外,其余时段NP组叶片蒸腾速率均高于QN和QP组;处理12~24 d的QN组叶片蒸腾速率与NP组差异显著,其余时段差异均不显著;处理0~42 d的QP组叶片蒸腾速率与NP组差异总体不显著。表明缺氮和缺磷处理对凤眼蓝叶片蒸腾速率的影响不明显,各营养条件下凤眼蓝均能维持较正常的蒸腾速率。
与NP组相比,QN和QP组叶片净光合速率在处理0~12 d均无显著差异,在处理18~42 d均显著降低;除处理6和42 d外,其余时段NP组叶片净光合速率最高,QP组次之,QN组最低。表明缺氮和缺磷处理12 d后能够显著抑制凤眼蓝叶片净光合速率,且缺氮处理的抑制效果明显强于缺磷处理。
与NP组相比,处理12~42 d的QN和QP组叶片气孔导度均降低,其中,处理12~30 d的QN和QP组叶片气孔导度显著降低,但QN组与QP组间差异不显著。表明缺氮和缺磷处理会降低凤眼蓝叶片的气孔导度,但缺磷处理与缺氮处理的效果差异不显著。
总体上看,缺氮和缺磷处理对凤眼蓝叶片蒸腾速率的影响不明显,但在处理中后期能显著抑制凤眼蓝叶片的净光合速率和气孔导度,且缺氮的抑制效果更强;缺氮处理中后期可显著抑制叶片叶绿素的积累。因此,缺氮处理对凤眼蓝叶片光合作用的抑制效果强于缺磷处理。
2.3 不同营养条件对凤眼蓝抗氧化酶活性和丙二醛含量的影响
全营养(NP)、缺氮(QN)和缺磷(QP)处理对凤眼蓝叶片和根中过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量的影响见表5。结果显示:QP组叶片中3种酶活性及MDA含量随处理时间延长呈波动升高的趋势,在处理10~40 d均高于NP和QN组,在处理40 d与NP和QN组总体差异显著。总体上看,各处理组根中POD和SOD活性及MDA含量总体无显著差异,CAT活性仅在处理20~30 d存在显著差异。表明缺磷处理会使凤眼蓝叶片中抗氧化酶活性和丙二醛含量明显上升,且促进效果随处理时间延长而增强,而根中抗氧化酶活性和丙二醛含量无明显变化;缺氮处理对叶片和根中3种酶活性和丙二醛含量均无明显影响。

表5 不同营养条件对凤眼蓝叶片和根中抗氧化酶活性和丙二醛含量的影响
2.4 不同营养条件对凤眼蓝氮、磷含量影响
全营养(NP)、缺氮(QN)和缺磷(QP)处理42 d的凤眼蓝叶片和根中氮、磷含量的变化见表6。结果显示:处理42 d,QN和QP组叶片中氮含量均低于NP组,仅QN组与NP组间差异显著,降幅为54.14%;NP组根中氮含量显著低于QP组,但显著高于QN组,QN组相较于NP组的降幅为36.89%。处理42 d,QN和QP组叶片中磷含量均显著低于NP组,其中QP组还显著低于QN组,QP组相较于NP组的降幅为85.84%;NP和QN组根中磷含量均显著高于QP组,QN组与NP组间无显著差异,QP组相较于NP组的降幅为93.77%。总体上看,缺氮和缺磷处理会导致凤眼蓝叶片中氮、磷含量降低;在根中,缺磷处理会导致氮含量升高,缺氮处理会导致磷含量升高。
表6 不同营养条件处理42 d的凤眼蓝叶片和根中氮、磷含量的变化
上述结果表明:缺氮处理下凤眼蓝体内难以维持较高水平的氮含量,缺磷处理下植物体内难以维持较高水平的磷含量,但缺氮处理下植物体内氮含量的降幅明显低于缺磷处理下磷含量的降幅。
2.5 不同营养条件对凤眼蓝根际微生物群落的影响
2.5.1 不同营养条件对根际微生物群落组成的影响 全营养(NP)、缺氮(QN)和缺磷(QP)处理下凤眼蓝根际微生物相对丰度前20属的热图见图2;主成分分析见图3。

NP: 全营养Total nutrient; QN: 缺氮Nitrogen deficiency; QP: 缺磷Phosphorus deficiency. All-Neo-Par-Rhi: 异样根瘤菌属Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium. *: P<0.05.

: 全营养Total nutrient; : 缺氮Nitrogen deficiency; : 缺磷Phosphorus deficiency. 图中相同图标代表同一处理组的重复样本,括号内百分数为该主成分的贡献率 The same icons represent replicate samples of the same treatment group, and the percentages in brackets represent contribution rate of the principal component.
结果(图2)显示:属水平下,NP组相对丰度较高的属为不黏柄菌属(AsticcacaulisPoindexter)、草螺菌属(HerbaspirillumBaldani)和嗜甲基菌属(MethylophilusJenkins),QN组相对丰度较高的属为不黏柄菌属和弯杆菌属(FlectobacillusLarkin),QP组相对丰度较高的属为黄杆菌属(FlavobacteriumBergey)、固氮螺菌属(AzospirillumTarrand)和不动杆菌属(AcinetobacterBrisou et Prevot)。
从Shannon-Wiener指数看,NP组凤眼蓝根际微生物群落的Shannon-Wiener指数(3.31)最高,QN组(3.06)次之,QP组(2.72)最低,3组间无显著差异,说明与全营养处理相比,缺氮和缺磷处理下凤眼蓝根际微生物群落多样性较低,物种分布不均匀。
主成分分析结果(图3)显示:NP组的样本在图中分布较为集中,而QN和QP组的样本在图中分布较为分散,说明全营养处理下各样本的根际微生物群落组成较为相似,而缺氮和缺磷处理下各样本的根际微生物群落组成相似性不高。
总体上看,全营养处理下凤眼蓝根际微生物群落组成多样性较高,同一处理不同样本间相似性较高,群落中较多的属是不黏柄菌属和草螺菌属;缺氮和缺磷处理下根际微生物群落组成多样性均降低,同一处理不同样本间相似性较低;在缺氮条件下群落中较多的属是不黏柄菌属;缺磷条件下群落中较多的属是黄杆菌属。
2.5.2 不同营养条件对凤眼蓝根际微生物群落功能的影响 不同营养条件下凤眼蓝根际相对丰度前20的功能类群见图4。结果显示:尿素分解、硝酸盐还原、植物病原、固氮、甲基营养、甲醇氧化、碳氢化合物降解、芳香烃降解、氮呼吸和硝酸盐呼吸相关微生物的相对丰度在3组间有显著差异。与NP组相比,QN和QP组上述10个功能类群的相对丰度均显著降低。
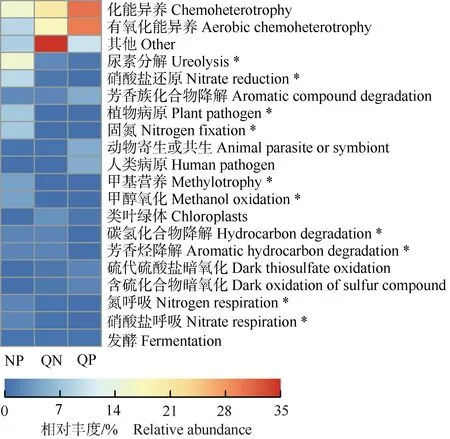
NP: 全营养Total nutrient; QN: 缺氮Nitrogen deficiency; QP: 缺磷Phosphorus deficiency. *: P<0.05.
从固氮微生物类群的相对丰度看,NP组固氮微生物类群的相对丰度(8.49%)最高,显著高于QN(0.14%)和QP(0.20%)组,但QN组与QP组间无显著差异。
总体上看,全营养处理下凤眼蓝根际能够富集更多氮代谢相关(硝酸盐还原、固氮、氮呼吸和硝酸盐呼吸)的微生物,能促进凤眼蓝的氮吸收;在缺氮处理下,由于水体中缺乏氮元素,因此氮代谢相关微生物的相对丰度显著降低;缺磷处理下,水体中氮含量与全营养处理一致,但是根际微生物中仍缺乏氮代谢相关微生物,说明缺磷处理会显著降低凤眼蓝根际对氮代谢相关微生物的富集作用。
3 讨论和结论
已有大量研究证实水体中氮、磷含量是影响凤眼蓝生长的主要因子,其中多数研究都反映凤眼蓝生物量与水体中氮、磷含量呈正比[14-15,25-28],除生物量外,叶数和匍匐茎数也与水体中氮、磷含量呈正比[26],但是氮和磷中哪一种元素对凤眼蓝生长的影响更显著尚无定论。本研究中,缺氮和缺磷处理均在处理后期能显著抑制凤眼蓝鲜质量、叶数、叶宽、分株数和匍匐茎总长,缺氮处理与缺磷处理对凤眼蓝鲜质量、分株数和匍匐茎总长的抑制效果总体差异并不显著,但缺磷处理下凤眼蓝叶数和分株数更少、匍匐茎较短。上述研究结果证实凤眼蓝具有受水体中氮、磷含量高度调控的表型可塑性,水体中氮、磷含量是凤眼蓝鲜质量增加的限制因子,缺磷处理下凤眼蓝繁殖能力较弱,表现为基本无分株。
本研究中,在缺氮和缺磷处理下凤眼蓝均出现根发育显著强于叶发育的现象,表现为根部鲜质量增加。根系作为植物吸收水和养分的重要器官,发育受多种环境因子影响,具有高度可塑性[29],氮、磷元素供给作为影响植物形态建成的重要因子,一定程度的营养缺乏会促进植物根系发育,通过增加根系表面积,植物能获得更多营养,以此抵消营养缺乏造成的胁迫[30-31]。有研究发现,轻度缺氮处理能显著增加拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕根系长度,重度缺氮处理下拟南芥根系长度增加受到显著抑制,低磷处理下拟南芥主根生长受到抑制,侧根和根毛显著发生[29,31]。冯优等[32]研究了5种水生植物对不同氮和磷水平养殖尾水的净化效果,发现凤眼蓝根长会随水体中氮、磷浓度降低而升高。王峻等[33]发现,缺氮和缺磷处理下小麦(TriticumaestivumLinn.)幼苗根系干质量、总根长、总根数均显著下降,且缺磷组的下降程度较缺氮组更高。本研究中,全营养、缺氮和缺磷处理下凤眼蓝主根长差异均不显著,但缺磷处理42 d的根部鲜质量显著高于全营养和缺氮处理,表明凤眼蓝在缺氮和缺磷处理下根系生长能正常进行,且缺磷处理对根系生长有明显促进作用。
光合作用作为植物体最重要的化学反应,能够反映植物对环境资源的获取效率,入侵植物往往具有更高的环境资源利用效率[28]。叶绿素是植物捕获光能的必要物质,其组成中含有氮元素,缺氮会导致植物体中叶绿素含量降低,进一步使光合作用相关酶活性下降,使光合作用速率下降[34];缺氮的植物中,光合活性在叶片发育过程中的下降速度比叶绿素含量更快,导致能量捕获和散失间不平衡,促使O2还原为超氧阴离子自由基,从而引发氧化应激[35]。光合作用同时依赖于ATP和NADPH等含磷化合物进行反应,缺磷导致ATP等合成量减少,阻碍光合作用的进行[36]。严重缺磷可导致CO2同化速率降低、光合作用相关基因下调以及光系统Ⅱ水平的光抑制,从而引起潜在的光氧化胁迫,使叶绿体中活性氧的产生增加[37]。因此,光合速率可以反映植物的生长状况、健康程度和适应能力;用于清除植物体内活性氧的抗氧化酶〔以过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)为主〕能够反映植物受胁迫的程度[38-39]。张迎颖等[40]发现,凤眼蓝叶片叶绿素相对含量与氮浓度呈显著正相关。本研究中,凤眼蓝叶片叶绿素相对含量在缺氮处理下明显降低,在缺磷处理后期也有所降低;缺氮和缺磷处理中后期能显著抑制凤眼蓝叶片净光合速率,总体上看缺氮处理对凤眼蓝叶片光合作用的抑制效果更强,但考虑到缺磷处理对凤眼蓝叶片发育的抑制效果显著强于缺氮处理,因此缺氮和缺磷2种处理对凤眼蓝叶片光合作用均具有较强影响。同时,缺磷处理使凤眼蓝叶片中CAT、POD和SOD活性及丙二醛(MDA)含量明显上升,而缺氮和全营养处理间差异较小,而根中3种酶活性和MDA含量无明显变化。综合考虑认为,缺磷处理使光氧化胁迫加剧,引起凤眼蓝叶片活性氧大量积累,对凤眼蓝产生的胁迫更强。
有研究结果表明:植物吸收氮、磷元素后会进行重分配,在缺素条件下,更多的营养物质会分配向根系[36]。本研究中,缺氮和缺磷处理会导致凤眼蓝叶片中氮、磷含量降低;在根中,缺磷处理会导致氮含量升高,缺氮处理会导致磷含量升高。缺磷处理对氮元素重分配向根部及缺氮处理对磷元素重分配向根部的促进效应在本实验中均有体现,但缺氮处理引起的氮含量的降幅远低于缺磷处理引起的磷含量的降幅,这可能是由于植物获取磷元素方式较氮元素单一,仅能吸收正磷酸盐以及将少量有机磷分解为无机磷吸收[41],而氮元素的吸收则为吸收游离的硝态氮和铵态氮[42],同时存在固氮微生物共生等途径[17,20]。因此,凤眼蓝在水体缺磷条件下获取磷会比缺氮条件下获取氮更困难。
本研究中,缺氮和缺磷处理下凤眼蓝根际微生物群落的Shannon-Wiener指数均降低,说明缺氮和缺磷处理均会引起微生物多样性降低。全营养处理下草螺菌属的相对丰度较高,该属为常见的植物联合固氮菌[43];缺磷处理下黄杆菌属的相对丰度最高,黄杆菌属可能有植物根际促生潜能[44]。缺氮和缺磷处理下凤眼蓝根际氮代谢相关微生物的相对丰度显著降低。Yi等[21]发现,凤眼蓝能够增加水体中反硝化细菌丰度,降解水体中更多的硝酸盐,促进植物对环境中氮元素的吸收。本研究中,全营养处理下凤眼蓝根际微生物群落相对丰度较高,其中固氮等氮代谢相关微生物的相对丰度也较高,在缺氮和缺磷处理下,固氮等氮代谢相关微生物的相对丰度均显著下降,表明缺氮和缺磷处理均会抑制凤眼蓝根际固氮等氮代谢相关微生物的富集,从而抑制根际微生物对凤眼蓝氮吸收的促进效应。而在农田土壤缺乏氮元素时,可能会增强土壤中固氮菌活性[45],这可能是由于土壤成分较为复杂,而本研究中水体成分相对单一,这还需要在野外进行现场实验进一步验证。
凤眼蓝能够在中国南方水系快速定殖爆发的主要原因是其具有快速生长和繁殖能力,旺盛的营养繁殖成为凤眼蓝快速增殖并爆发的生物学特性基础,有研究表明1株凤眼蓝在适宜条件下每5天就可以产生1个单株[13]2。凤眼蓝快速生长和繁殖均需要大量的营养元素。本研究中,缺氮和缺磷处理18 d后均可显著降低分株数,抑制凤眼蓝繁殖新的植株,可见通过控制凤眼蓝对氮、磷元素的吸收来防控其爆发具有较高的可行性;且缺磷处理对凤眼蓝生长的抑制作用更强,利用磷元素吸收抑制剂防控凤眼蓝可能具有较大的应用潜力。不同浓度磷元素对凤眼蓝生长的影响及其分子机制还需要进一步研究。
综上所述,氮、磷元素缺乏能抑制凤眼蓝鲜质量、叶数、叶宽、分株数和匍匐茎总长,降低根际微生物多样性及丰度,引起体内氮、磷元素优先分配向根部,叶发育减弱,光合作用效率降低,从而有效抑制其生长和繁殖;其中,缺磷处理对凤眼蓝生长和繁殖的抑制作用更强,可能是由于缺磷处理显著降低了凤眼蓝根际对氮代谢相关微生物的富集,导致植株对氮元素的同化能力下降,光合速率下降引起光氧化胁迫加剧。因此,通过控制凤眼蓝对磷元素的吸收防控凤眼蓝爆发具有较大的应用潜力。

