白蛋白-胆红素评分联合肝功能指标及CEA对结直肠癌肝转移的预测价值
樊万里,何 栋,张树泽,陈 刚,赵 斌,程志斌
兰州大学第二医院普通外科,兰州 730030
结直肠癌(colorectal cancer,CRC)是世界第三大常见癌症,也是癌症相关死亡的第二大原因[1]。根据2022年中国国家癌症中心统计数据,我国每年新增确诊CRC患者约为408万例,死亡人数约为19.6万例,分别位列恶性肿瘤的第二位和第四位[2]。CRC患者预后差的主要原因是肝转移,约50%的CRC患者在初次就诊时或术后即发生肝转移[3]。其中肝转移灶获得根治性切除患者的中位生存期可达35个月,5年生存率为30%~57%[4];而肝转移灶未获得根治性切除患者的中位生存期不足7个月,5年生存率仅为5%[5]。因此临床早期发现肝转移可显著提高CRC患者的远期预后,降低患者病死率[6]。
目前,判断CRC患者是否存在肝转移的主要方法是影像学检查,但其对设备要求较高、受影像科医生业务水平影响大,且存在检查费用较高等不足[7],因此亟需一种简单、经济且客观的检测方法。临床研究表明,在恶性肿瘤出现肝转移时,患者的肝功能指标会发生异常改变,因此常规行肝功能指标检测有望早期发现肝转移[8]。Johnson等[9]于2015年提出了一种新的肝功能评估模型即白蛋白-胆红素(albumin-bilirubin,ALBI)评分,其由胆红素和血清白蛋白水平组成,分为3级,等级越高,表明患者的肝功能越差。新近研究表明,ALBI评分与多种癌症的预后具有相关性,包括具有肝转移的结直肠癌、可切除胃癌和可切除胰腺癌[10]。癌胚抗原(carcinoembryonic antigen,CEA)是目前被广泛认可的广谱肿瘤标志物,手术前后检测血清CEA水平可预判CRC的肝转移及隐匿性转移[11]。有研究表明,当CRC术后血清CEA≥15 μg/L时,患者发生远处转移的风险增高[12]。目前尚无相关研究将ALBI评分与常规肝功能指标及CEA联合对CRC肝转移进行预测,本研究将探讨其对CRC发生肝转移的预测价值,为临床识别和预测CRC肝转移提供新思路。
1 资料与方法
1.1 研究对象与分组
本研究为回顾性队列研究。连续纳入2016年1月至2021年7月于兰州大学第二医院接受手术治疗的CRC患者。纳入标准:(1)术后病理证实为结直肠腺癌;(2)实验室血常规检查及肿瘤标志物检测记录齐全;(3)入院前未接受任何放化疗及激素治疗。排除标准:(1)随访不足24个月;(2)肝转移患者的肝脏病变经病理或经病史结合影像学检查证实为非结直肠转移癌;(3)既往有其他恶性肿瘤病史及血液系统疾病;(4)合并其他部位原发性恶性肿瘤。
根据患者出院后24个月内肝转移发生情况,将入组的CRC患者分为肝转移组与非肝转移组,并按2∶1比例随机分为建模组与验证组。本研究已通过兰州大学第二医院伦理委员会审批(审批号:2023A-400),并豁免患者知情同意。
1.2 研究方法
1.2.1 资料收集
通过电子病历系统获取患者的基本信息,包括年龄、性别、体质量指数(body mass index,BMI)、原发肿瘤位置、既往史、院前治疗方式、术前实验室检查、影像学结果及术后病理学诊断等。实验室检查包括总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)、间接胆红素(indirect bilirubin,IBIL)、丙氨酸氨基转移酶(alanine transa-minase,ALT)、天冬氨酸氨基转移酶(aspartate transaminase,AST)、天冬氨酸氨基转移酶/丙氨酸氨基转移酶(aspartate transaminase/alanine transa-minase,AST/ALT)、总蛋白(total protein,TP)、白蛋白(albumin,ALB)、球蛋白(globulin,GLO)、白球比(albumin/globulin,A/G)、γ-谷氨酰转移酶(γ-glutamyle transpeptidase,GGT)、碱性磷酸酶(alkaline phosphatase,ALP)、甲胎蛋白(alpha fetoprotein,AFP)、CEA、糖类抗原125 (carbohydrate antigen 125,CA125)、糖类抗原19-9(carbohydrate antigen19-9,CA19-9)。ALBI评分根据实验室检查结果进行计算。随访信息通过电子病历或电话咨询获得。
1.2.2 样本量估算
依据公式n=Z2*P(1-P)/d2估算样本量[13],既往文献报道CRC术后肝转移发生率为15%~25%,即P=15%,Z=1.96,d=0.05,经计算CRC患者样本量最小应为196例。
1.2.3 偏倚控制
(1)本研究严格按照纳入、排除标准选择研究对象;(2)数据由双人录入、核对,尽量减少主观偏倚。
1.3 统计学处理
采用SPSS 26.0及R4.2.2软件进行统计学分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;不符合正态分布的计量资料以中位数(四分位数)表示,组间比较采用Wilcoxon秩和检验。计数资料以例数(百分数)表示,组间比较采用卡方检验。在建模组中,以患者是否发生肝转移作为因变量,采用“glmnet”包进行Lasso回归变量筛选,通过交叉验证选择最佳λ值,折叠次数为10次,并应用Forward LR法构建Lasso-Logistic回归模型。绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算ROC曲线下面积(area under the curve,AUC),评估其区分度,应用校准曲线和临床决策曲线分析其校准度和临床获益,同时采用Bootstrap法对建模组进行内部验证。最后,采用“rms”包绘制列线图。对于缺失比例≤5%的检验数据,用各变量的中位值进行填补。双侧检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 患者一般资料
本研究最终入选符合纳入与排除标准的CRC患者195例,入组流程见图1。其中男性113例,女性82例;年龄26~90岁,平均年龄(60.5±12.3)岁。依据随访结果分为肝转移组(70例)和非肝转移组(125例)。两组患者在原发肿瘤位置、TBIL、DBIL、ALT、AST、ALT/AST、TP、ALB、A/G、GGT、ALP、CEA、CA125、CA19-9、ALBI评分的差异具有统计学意义(P均<0.05),见表1。按2∶1随机分为建模组(130例)和验证组(65例),其中建模组中肝转移患者50例,非肝转移患者80例;验证组中肝转移患者20例,非肝转移患者45例。两组患者基本资料差异无统计学意义(P均>0.05),见表2。

表1 肝转移组与非肝转移组的基线资料比较(n=195)Tab.1 Baseline data between liver metastasis group and non-liver metastasis group(n=195)

表2 建模组与验证组的基线资料比较(n=195)Tab.2 Baseline data between modeling group and validation group(n=195)

图1 研究对象入组流程图Fig.1 Flowchart for enrollment of subjects
2.2 Lasso-Logistic回归预测模型的构建
在建模组中,以患者是否发生肝转移作为因变量,使用Lasso回归进行变量筛选,通过交叉验证选择最佳λ值,折叠次数为10次(图2)。本研究选取lambda.min作为最佳λ值,Lasso回归并应用Forward LR法进行Logistic分析,结果显示ALBI(OR=8.062,95% CI:2.545~25.540)、ALT(OR=1.037,95% CI:1.004~1.071)与CEA(OR=1.025,95% CI:1.008~1.043)可作为CRC发生肝转移的独立预测因素(表3)。根据Lasso-Logistic回归分析结果,纳入ALBI评分、ALT、CEA 3个变量,构建Lasso-Logistic回归预测模型。

表3 结直肠癌肝转移影响因素的多因素Logistic回归分析结果Tab.3 Multivariate Logistic regression analysis results of factors influencing liver metastasis of colorectal cancer

图2 基于 Lasso 回归的特征变量筛选A.十倍交叉验证图;B.收缩系数图Fig.2 Feature variable selection based on Lasso regressionA.Ten fold cross validation chart;B.Shrinkage coefficient chart
2.3 预测模型的内部评价与内部验证
建模组ALBI评分、ALT、CEA三者联合预测结直肠癌发生肝转移的AUC为0.921(图3),灵敏度为78.0%,特异度为95.0%(表4),C-index为0.921,H-L拟合度曲线χ2=0.851,P=0.654,校准曲线斜率接近1(图4),提示该模型准确度较高,临床决策曲线显示该模型具有良好的临床应用价值(图5)。对建模组数据,采用Bootstrap法进行1000次重抽样的内部验证,准确度为0.869,Kappa一致性为0.709,AUC为0.913。应用ALT、CEA与ALBI评分单独诊断CRC肝转移时,CEA的曲线下面积最大(AUC=0.897),三者联合诊断CRC肝转移的效能最高(表4)。验证组三者联合预测的AUC为0.918(图3),灵敏度为85.0%,特异度为95.6%(表5),C-index为0.918,H-L拟合度曲线χ2=0.586,P=0.746。

表4 建模组患者ALT、CEA和ALBI评分单独检测与联合检测的诊断效能比较Tab.4 Diagnostic efficacy between individual and combined detection of ALT,CEA,and ALBI score in modeling group
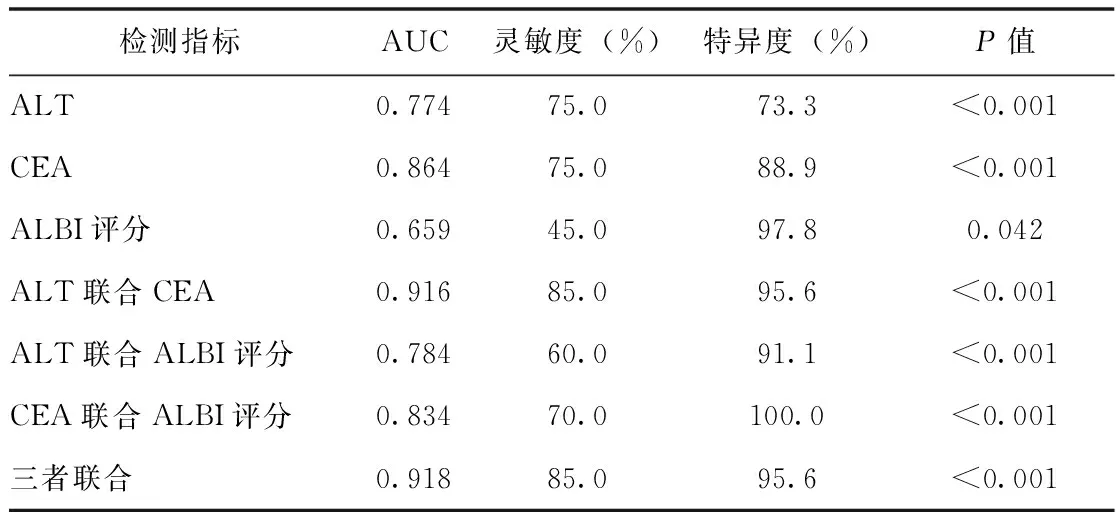
表5 验证组患者ALT、CEA和ALBI评分单独检测与联合检测的诊断效能比较Tab.5 Diagnostic efficacy between individual and combined detection of ALT,CEA,and ALBI score in verification group

图3 模型预测结直肠癌肝转移的受试者工作特征曲线A.建模组;B.验证组Fig.3 Receiver operating characteristic curve of the model predicting liver metastasis of colorectal cancerA.Modeling group;B.Verification groupALT、CEA、ALBI:同表1

图4 Lasso-Logistic回归模型校准曲线A.建模组;B.验证组Fig.4 Calibration curves of the Lasso-Logistic regression modelA.Modeling group;B.Verification group

图5 Lasso-Logistic回归模型临床决策曲线A.建模组;B.验证组Fig.5 Decision curve analysis of the Lasso-Logistic regression model B.Modeling group;B.Verification group
2.4 风险预测模型可视化
根据Lasso-Logistic回归分析结果,绘制CRC发生肝转移的列线图,见图6。例如,若某研究对象ALBI评分为-3.0分,CEA为100 μg/L,ALT为50 U/L时,分别向评分轴垂直投射,将得到的分值相加:7+10+4=21,在总评分轴上找到21分的相应位置,垂直向下投射到CRC肝转移发生风险轴上的风险预测值约为0.70。

图6 结直肠癌肝转移的列线图预测模型Fig.6 Nomogram prediction model for liver metastasis of colorectal cancer ALT、CEA、ALBI:同表1
3 讨论
本研究通过对患者ALBI评分、常规肝功能指标、肿瘤标志物等进行分析,得出ALBI评分、ALT与CEA是CRC发生肝转移的独立预测因素,随后采用Lasso-Logistic回归构建预测模型,采用Bootstrap法进行内部验证,发现ALBI评分、ALT和CEA三者联合预测CRC肝转移的AUC为0.918,灵敏度为85.0%,特异度为95.6%,C-index为0.918,H-L拟合度曲线χ2=0.586,P=0.746。提示三者联合预测CRC肝转移的效能较高,通过其构建的风险预测模型具有良好的临床应用前景。
由于CRC肝转移的肿瘤细胞数量少、浓度低,常规影像学检查(如CT、MRI等)无法对其进行早期诊断,因此寻找更好的方法以早期准确判断CRC肝转移迫在眉睫。
CEA存在于胃肠道和胰腺内胚层衍生上皮的恶性肿瘤中,在CRC患者体内过表达且分布于整个细胞膜[14]。既往有研究发现CEA高表达与CRC转移显著相关[15]。血清CEA在影像学发现肝转移灶前6个月即可增高,CRC肝转移患者的血清CEA、CA19-9和AFP明显高于无肝转移患者[16]。CEA高表达与CRC肝转移存在相关性的机制如下:CEA通过抑制失巢凋亡,降低了血液中癌细胞的死亡;CEA与Kupffer细胞受体蛋白结合,改变了肝脏微环境,有利于癌细胞的存活;CEA可上调与转移相关的细胞黏附分子[17]。Duffy等[18]建议CRC术后每隔2~3个月复查一次CEA有助于早期发现肝转移[19]。而邓玉雪等[20]研究发现,依据血清CEA诊断CRC肝转移的灵敏度仅为36.5%,难以达到早期发现肝转移的要求。晚期CRC患者及其他消化道恶性肿瘤中CEA表达水平明显升高,但早期单独检测CEA对于CRC肝转移的诊断可能存在假阳性及假阴性等情况,诊断准确度较低。
有文献报道,正常细胞的恶化可导致酶合成异常,酶学改变常出现在形态学改变之前[21]。AST和ALT与肝脏疾病及肿瘤疾病密切相关。当机体肝细胞受损时,ALT、AST可进入血液循环,导致血清AST、ALT水平增加[22]。有文献报道CRC肝转移患者的ALT水平会升高[23]。白傲雪等[24]研究表明,术后ALB、ALT、CEA、CA19-9增高的CRC患者发生肝转移的风险更高。Wu等[25]研究表明,CRC肝转移组的ALT、GGT、乳酸脱氢酶和CEA水平明显高于无肝转移组,差异具有统计学意义。敬蕾等[26]研究表明,术前肝功能分级B级相比A级的CRC患者更易发生肝转移(P<0.05),可能B级患者个体免疫功能更差,在抵抗癌细胞侵袭中能力较弱,增加了术后转移风险。然而,肝功能指标异常可能是由于继发性肝肿瘤占位效应所导致,发现时多数患者已处于疾病晚期。此外,引起肝功能异常的原因很多,如肿瘤细胞引起的促炎细胞因子增加可损害肝功能,导致胆汁淤积[27];肝脏中Kupffer细胞产生的细胞因子增加促进了肝细胞和胆管细胞中胆汁酸转运蛋白的功能,胆汁酸的积累亦会导致肝功能受损[28]。
随着ALBI评分的提出,多项研究将其应用于CRC肝转移、可切除胃癌和可切除胰腺癌的预测中。相较于临床上最常用的肝功能评价指标Child-Pugh评分,ALBI去除了肝性脑病及腹水两个主观性指标,且数据获取更为便捷。但ALBI评分仅包含两项指标,且不存在上限效应,若患者存在低蛋白血症或高胆红素血症 (如梗阻性黄疸),ALBI评分则有失偏颇。此外,该评分起初是基于肝癌患者提出的,未考虑到其他病因的影响,对其他病因所导致的肝功能异常,有待进一步研究以证实其实用性和准确性。
以上研究[14-28]提示:仅依据肿瘤标志物或肝功能等单一指标预测CRC肝转移存在一定局限性,易导致误诊、漏诊。故本研究将ALBI评分与常规肝功能指标、CEA联合检测,以期做到早期发现CRC肝转移。本研究构建的基于ALBI评分、ALT和CEA的CRC肝转移风险预测模型,在建模组和验证组的C-index分别为0.921和0.918,校准图中两曲线重合度较好,具有良好的一致性,临床决策曲线也表现出良好的临床应用价值。通过分析可知,ALBI评分、ALT、CEA以及三者联合预测CRC肝转移的AUC分别为0.825、0.704、0.897、0.921,三者联合检测的灵敏度为85.0%,特异度高达95.6%,可有效减少误诊率,提高诊断准确率以及整体预测效能,预测价值较高。此外,三者联合检测的机制不同,能更全面地反映CRC肝转移对机体产生的影响,有利于早期发现肝转移。
本研究存在如下不足:(1)为单中心回顾性研究,可能存在病例选择偏倚;(2)缺乏多中心数据对模型进行外部验证,仍需大样本、多中心临床数据以提高模型的效度和可靠性。
综上所述,ALBI评分联合ALT及CEA预测CRC肝转移的特异度和准确率较高,将对提升CRC肝转移患者的诊治水平具有重要价值。
作者贡献:樊万里负责资料收集和论文撰写;何栋、张树泽、陈刚、赵斌提供论文撰写意见;程志斌负责论文设计及审校。
利益冲突:所有作者均声明不存在利益冲突

