苦瓜果实不同发育时期细胞壁组分及相关酶活性的差异分析
裘波音, 林珲, 张前荣, 李永平, 温庆放, 朱海生, 李大忠
苦瓜果实不同发育时期细胞壁组分及相关酶活性的差异分析
裘波音, 林珲, 张前荣, 李永平, 温庆放, 朱海生*, 李大忠*
(福建省农业科学院作物研究所,福建省蔬菜遗传育种重点实验室,福建省蔬菜工程技术研究中心, 福州 350013)
为了解苦瓜()果实品质差异的原因,以厚肉型种质‘LX1-3’和薄肉型种质‘ZK54’为材料,对果实发育过程中细胞壁组分含量及相关酶活性进行了分析。结果表明,花后17 d,‘LX1-3’果实的横径(FD)、腔径(FLD)、果肉厚度(PT)、单瓜鲜质量(FFW)和干质量(FDW)均超过‘ZK54’。细胞壁组分和酶活性表现品种间差异,水溶性果胶含量整体水平表现为厚肉型高于薄肉型,且与PT、FFW和FDW呈显著正相关;花后17~23 d ‘LX1-3’的半纤维素(HCE)和纤维素(CE)含量均高于‘ZK54’;花后3 d,两种质的-半乳糖苷酶(-Gal)和-木糖苷酶(-Xyl)活性显著高于其他3个时期,多聚半乳糖醛酸酶(PG)、-Gal和果胶酶变化趋势与离子型果胶和共价型果胶含量的变化一致。-Gal、-Xyl和纤维素酶活性与5个生长性状间呈极显著/显著负相关,PG与FD、FLD和PT呈极显著/显著负相关。因此,细胞壁组分和酶活性与果实发育密切相关,-Xyl和-Gal在苦瓜早期发育中发挥主要效应,而HCE和CE对果实中后期发育影响较大。
苦瓜;果实;发育;细胞壁组分;酶活性
苦瓜()为葫芦科(Cucurbitaceae)苦瓜属植物,营养价值高,降血糖效果突出,是亚洲和非洲部分地区重要的蔬菜和药用植物[1–2]。关于苦瓜品质的研究目前主要集中在营养成分和风味物质解析等方面[3–6],对于其它品质因子及形成原因的关注相对较少。作为重要的质地品质,果肉厚、瓤腔厚等性状对苦瓜的经济价值起关键作用, 其形成和变化受细胞大小、形态等微观因素的影响甚大[7]。植物细胞的外层结构为细胞壁,在维持细胞形态、控制细胞繁殖、抵御外力损伤等方面有较大作用[8]。细胞壁主要包括果胶、纤维素(cellulose, CE)、半纤维素(hemicellulose, HCE)及少量蛋白质和矿物质等成分,其合成、转移、水解等过程需要多种细胞壁相关酶的参与和协同调控。因此研究苦瓜果实发育过程中细胞壁物质及相关酶活性变化规律,对探讨苦瓜果实品质差异具有重要的指导意义。
细胞壁的结构与成分因物种、组织、细胞类型的不同而表现差异。研究表明,共价型果胶(covalent pectin,CSP)、HCE和CE含量降低可能是梨()[9]和蓝莓()[10]、山楂()[11]、木瓜()[12]、杏()[13]和树莓()[14]等果实后期成熟软化的重要因素。但也有研究表明,红肉枇杷()水溶性果胶(water soluble pectin, WSP)含量随生长过程逐渐增加,而白肉枇杷的WSP含量呈先下降后快速上升趋势,2个品种的CSP含量在发育过程中均表现早期增加后期减少的动态规律,但离子型果胶(ionic pectin, ISP)含量变化呈无规则状态[15];随着果实生长发育,加工型橄榄() ‘长营’的HCE含量逐渐增大,而鲜食型橄榄“清榄1号”则逐渐减少[16];梨的CE含量的变化趋势没有什么规律,甚至发育后期含量较前期更高[17],这些说明细胞壁组分与果实成熟的关系不能一概而论。
细胞壁组分的变化大多需要果胶酶(pectinase, PE)、多聚半乳糖醛酸酶(polygalacturonase, PG)、-半乳糖苷酶(-galactosidase,-Gal)、-木糖苷酶(- xylosidase,-Xyl)、纤维素酶(cellulase, Cx)等代谢酶的催化,从而引起胞间层逐渐降解,导致相邻细胞失去连接而彼此分离[18]。早期研究表明,PE参与低温贮藏期间猕猴桃()的快速软化[19],是果实品控的关键因子;PG在果实成熟的后期起作用,可能与苹果的多汁性有关[20];-Gal能降解植物组织初生细胞壁中的果胶和半纤维素,降低细胞壁组分稳定性[21],但乙烯利处理可以显著抑制-Gal活性,延缓番茄()软化[22];-Xyl可水解半纤维素核心成分木聚糖, 在香蕉()的成熟软化[23]、鸳鸯茉莉()和拟南芥()花色素苷的降解[24]等过程中发挥重要作用,其活性随番茄和蓝莓的成熟逐渐降低[25–26];Cx活性随桃()的成熟而显著增加,并促进果胶酶催化果胶质的分解,导致细胞壁结构松散,最终导致桃细胞壁多糖的降解[27]。目前,关于细胞壁组分及相关酶活性在苦瓜果实生长发育过程中的作用研究尚未见报道。本研究以不同果肉厚度苦瓜(厚肉型‘LX1- 3’和薄肉型‘ZK54’)为材料,探讨不同发育时期的果实性状、细胞壁物质含量及相关酶活性的变化,分析种质间的差异性和相关性,以期找出形成果实生长及品质差异的关键因素,为进一步研究苦瓜生长发育调控机理和品质改良提供依据。
1 材料和方法
1.1 材料
以福建省蔬菜遗传育种重点实验室选育的厚肉型苦瓜(‘LX1-3’)和薄肉型苦瓜(‘ZK54’)为材料,于2021年3月17日穴盘育苗,3月28日定植于福建省农业科学院作物研究所福州基地大棚,5月上旬进入盛花期,开花当日授粉,分别于花后3、10、17和23 d (days after flower, DAF)进行果实性状观测, 并采样检测细胞壁组分及酶活性。
1.2 方法
利用游标卡尺测量果实横径(fruit diameter, FD)和果实腔径(fruit lumen diameter, FLD),计算果肉厚度(pulp thickness, PT)=(FD-FLD)/2,利用电子天平先称取苦瓜鲜质量(fruit fresh weight, FFW),然后置于恒温烘箱中100 ℃杀青2 h,65 ℃烘干,称取干质量(fruit dry weight, FDW),每个性状5个重复。细胞壁组分和酶活性的检测设3次重复,每3个苦瓜混样为1个重复。
果实细胞壁物质的提取和分离参考Huber[28]和Siddiqui等[29]的方法并作了改进。称取约0.3 g果肉,加液氮快速研磨后,加入80%乙醇提取15 min, 90 ℃水浴20 min, 冷却至室温, 6 000×, 25 ℃离心10 min,弃上清,沉淀用1.5 mL 80%乙醇和丙酮各洗2次, 再用1 mL 90%二甲基亚砜浸泡15 h, 6 000×, 25 ℃离心10 min,弃上清,将沉淀用蒸馏水清洗2次后置于60 ℃~100 ℃下烘干得到细胞壁物质。将上述细胞壁物质依次用1 mL 50 mmol/L乙酸钠(pH 6.5)、1 mL 50 mmol/L乙酸钠(含50 mmol/L EDTA)、1 mL 50 mmol/L碳酸钠(含2 mmol/L EDTA)各振荡提取3 h,每次8 000×4 ℃离心10 min收集上清液,3种上清液分别含有WSP、ISP和CSP。再向沉淀中加入1 mL 4 mmol/L NaOH (含100 mmol/L NaBH4)提取12 h后,10 000×离心10 min,得到含HCE的上清液,最后沉淀则为CE。各果胶采用咔唑-硫酸比色法测定,以半乳糖醛酸溶液作标准曲线;半纤维素采用间苯三酚-冰醋酸法测定,以d-木糖溶液作标准曲线;纤维素含量采用蒽酮比色法测定, 以葡萄糖溶液作标准曲线。PG、-Gal、-Xyl、PE、Cx的提取和活性检测参照微量法试剂盒(北京索莱宝科技有限公司)进行。
1.3 数据分析
所有数据以均值±标准误差表示,采用Excel 2010进行数据整理,通过SPSS 21.0软件进行相关性分析和多重比较(Duncan法),以<0.05表示显著差异,<0.01表示极显著差异。
2 结果和分析
2.1 果实性状差异
2份种质的FD、FLD、PT、FFW和FDW均随发育过程而增加,相同发育时期不同性状表现不一。其中,‘ZK54’在3和10 DAF的5个性状均高于‘LX1-3’,且10 DAF的FFW差异显著;但17和23 DAF ‘LX1-3’的5个性状均大于‘ZK54’,且FD、FT、FFW和FDW的差异均达显著水平(图1)。
2.2 细胞壁组分含量差异
如图2所示,2份材料的5个细胞壁组分含量在不同发育时期的变化不同。‘LX1-3’的WSP含量为23>3>17>10 DAF (下同),‘ZK54’为23>10>3>17; ‘LX1-3’的ISP含量为10>23>3>17,‘ZK54’为10>17>23>3;‘LX1-3’的CSP含量为23>10>3>17, ‘ZK54’的CSP含量变化与ISP相似;‘LX1-3’的HCE和CE含量为3>10>23>17,‘ZK54’为10>3>17>23。‘LX1-3’在3和23 DAF的5种成分含量均高于‘ZK54’;‘LX1-3’在10 DAF的WSP和CSP含量高于‘ZK54’,而ISP、HCE和CE含量则低于‘ZK54’; ‘LX1-3’在17 DAF的WSP、HCE和CE含量高于‘ZK54’, 其余2种成分则低于‘ZK54’。
2.3 细胞壁相关酶活性
2个品种苦瓜的5种细胞壁相关酶活性在不同时期不同。‘LX1-3’的PG和-Gal活性为3>17>23> 10,‘ZK54’为3>23>17>10;2个品种的-Xyl活性变化趋势相似,均为3>10>17>23;‘LX1-3’的PE活性为17>23>3>10,‘ZK54’为3>23>17>10;‘LX1-3’的Cx活性变化与-Xyl相似,‘ZK54’为3>17>10> 23。‘LX1-3’在3 DAF的PG和Cx活性均高于‘ZK54’,-Gal、-Xyl和PE活性则低于‘ZK54’;‘LX1-3’在10 DAF的PG、PE和Cx活性高于‘ZK54’, 其余2种酶活性则低于‘ZK54’;‘LX1-3’在17 DAF的PG、-Gal、PE和Cx活性高于‘ZK54’,-Xyl则低于‘ZK54’;‘LX1-3’在23 DAF的-Xyl和PE活性高于‘ZK54’, 其余3种酶活性则低于‘ZK54’ (图3)。
2.4 相关性分析
对果实性状、细胞壁组分和相关酶活性共计15个指标进行相关分析(表1),结果表明,5个果实性状(FD、PT、FLD、FFW和FDW)间均存在极显著正相关关系;在细胞壁组分中,WSP与CSP间呈显著正相关,ISP与CSP呈极显著正相关,与纤维素含量呈显著正相关;在细胞壁相关酶活性中,PG与-Gal和-Xyl间存在极显著正相关关系,与PE呈显著正相关性,-Gal与-Xyl间呈极显著正相关。细胞壁组分WSP含量与PT、FFW和FDW间呈显著正相关;细胞壁相关酶活性与生长性状和细胞壁组分间多数存在负相关关系,PG活性分别与FD和CSP含量呈极显著负相关,与PT、FLD、ISP含量呈显著负相关;-Gal活性与FD、PT、FLD呈极显著负相关,与FFW、FDW、CSP含量呈显著负相关;-Xyl活性与5个果实性状间呈极显著负相关,与CSP含量呈显著负相关;PE与ISP和CSP含量间呈极显著负相关;Cx活性与5个果实性状间呈显著负相关。

图1 苦瓜不同发育时期的FD、FLD、PT、FFW和FDW。不同字母表示差异显著(P<0.05)。FD: 果实横径; FLD: 果实腔径; PT: 果肉厚度; FFW: 果实鲜质量; FDW: 果实干质量。下同
3 结论和讨论
瓜果类蔬菜产品的经济价值与质量、果径、瓤腔径、果肉厚等数量性状,以及熟性、颜色等质量性状密切相关,但不同性状、同一性状在不同种质间或不同发育阶段均存在差异。研究表明,华南型黄瓜()不同品种的FLD差别最大, 且与FD呈极显著正相关[30],FT与FFW及产量呈极显著及显著正相关[31]。长果型黄瓜FD在6 DAF最大,9 DAF的增长速度变慢。短果型黄瓜FD则在12 DAF最大[32]。苦瓜的遗传基础丰富,张燕等[33]报道51份苦瓜种质资源中有16份的品质性状的平均变异系数达到29.24%,其中FD与FT、FFW与FD等8对性状间呈现极显著正相关;张玉灿等[34]对9个杂交组合苦瓜果实膨大过程进行观察,FFW和FD在8 DAF内增长缓慢,8~20 DAF快速膨大,从20 DAF到转色、成熟继续缓慢增长并最终趋于稳定。本研究表明,2份苦瓜种质的FD、FLD、FT、FFW和FDW在3~10和10~17 DAF这2个时期增长迅速,其中薄肉型这5个性状在3~10 DAF略高于厚肉型,而在10~17 DAF时期厚肉型逐渐超过薄肉型,并在17 DAF达到显著差异,在17~23 DAF这5个性状逐渐趋于平稳,表明苦瓜生长规律基本相似,但也存在品种间差异,须进行具体分析。相关性分析表明,这5个性状间呈极显著正相关关系,由此推断苦瓜这些生长性状随果实的发育变化明显,相互之间关系紧密,且有较大的品种效应,在遗传改良上具有较大潜力。

图2 苦瓜不同发育时期的WSP、ISP、CSP、HCE和CE含量。WSP: 水溶性果胶; ISP: 离子型果胶; CSP: 共价型果胶; HCE: 半纤维素; CE: 纤维素。下同
细胞壁组分会随着果实发育阶段的不同而出现变化。研究表明,不同质地甜瓜()果实细胞壁各组分含量差异较大,随着甜瓜的发育和成熟,WSP和ISP含量不断增加,但CSP、CE和HCE含量不断减少[35];不同枣()类果胶和CE降解起始时间不同,木枣发生在完熟期, 冬枣在脆熟期[36];随着果实的成熟,不同橄榄的WSP和CSP含量变化规律相似,但ISP含量表现不同,加工型橄榄‘长营’呈先上升后下降的趋势;而鲜食型橄榄‘清榄1号’总体呈上升趋势[16]。本研究表明,3种果胶在2种苦瓜种质发育过程中的变化趋势各不相同,其中,WSP含量整体水平表现为厚肉型高于薄肉型,ISP和CSP表现为厚肉型“升-降-升”和薄肉型“先升后降”趋势,CSP含量与WSP、ISP含量分别存在显著和极显著正相关关系,WSP含量与FT、FFW和FDW呈显著正相关,HCE和CE含量变化趋势相似,17 DAF厚肉型的均高于薄肉型, 再次证明细胞壁组分因种质、发育过程不同而呈现变化,对果实生长产生不同的影响,而发育中后期HCE和CE可能与苦瓜果肉增厚有较大联系。

图3 苦瓜不同发育时期的PG、β-Gal、β-Xyl、PE和Cx活性。PG: 多聚半乳糖醛酸酶; β-Gal: β-半乳糖苷酶; β-Xyl: β-木糖苷酶; PE: 果胶酶; Cx: 纤维素酶。下同
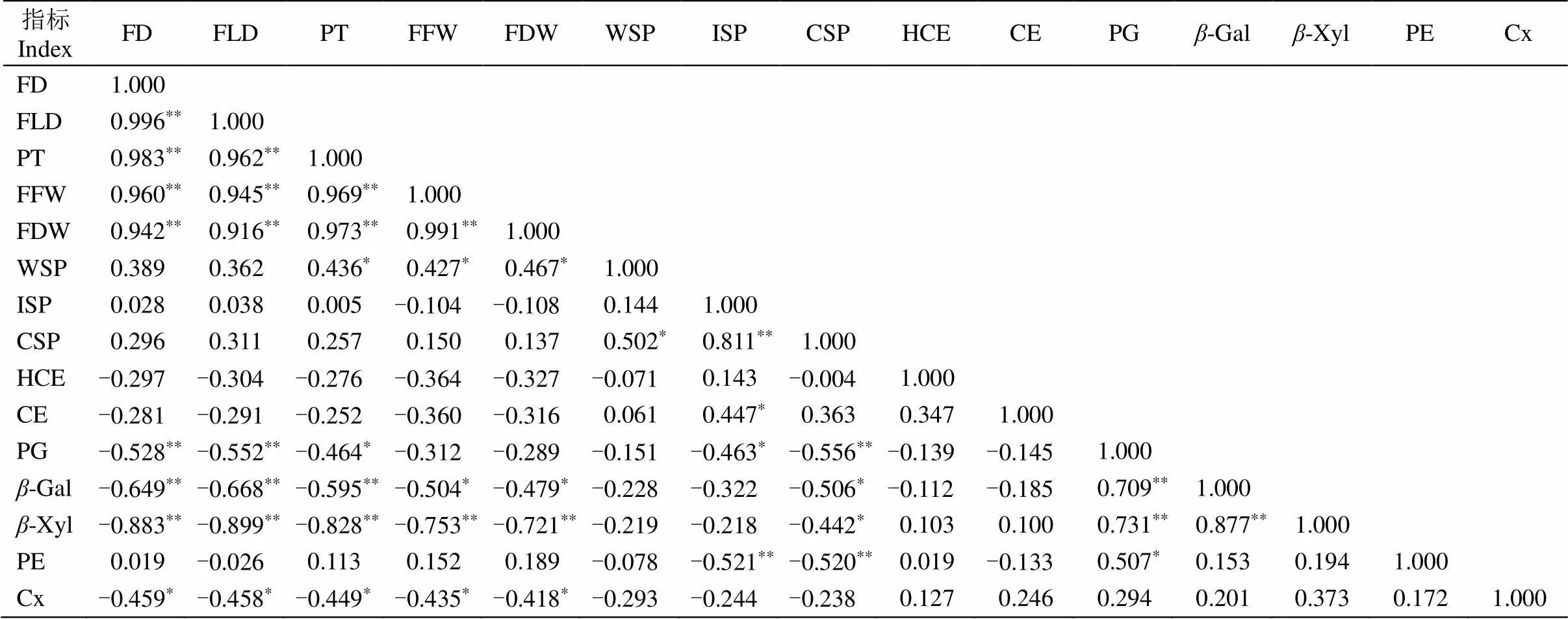
表1 苦瓜不同发育时期15个指标之间的相关性
*:<0.05;**:<0.01
在果实生长发育过程中,多种细胞壁酶参与调控果胶和纤维素-半纤维素的水解,造成细胞间连接减少、细胞离散,影响果实品质,这些酶在不同果实中或者同一果实的不同发育阶段发挥不同的主导作用。研究表明,PG和-Gal活性随灵武长枣的成熟而逐渐上升[37],且两者差异很可能是造成不同葡萄()品种质地差异的主要原因[38];PE活性对库尔勒香梨()、子用西瓜(var.)和哈密瓜(var.)的耐贮性均有影响[39–41];-Gal和Cx的活性与甘薯()的腐烂率和失重率呈极显著正相关[42],但与哈密瓜果实硬度呈极显著负相关[41]。Cx可能促进橄榄果实中CE降解[16],但番茄果实Cx活性随生长发育基本保持不变,与CE含量的升高并无关联[21]; 表明细胞壁代谢相关酶在不同种类果实中的作用机制可能存在差异。本研究表明,不同的苦瓜种质之间以及不同酶之间其活性差异较大,其中PG和PE在厚肉型种质中呈“降-升-降”的趋势,而在薄肉型种质中呈“先降后升”趋势,两者与ISP和CSP含量“升-降-升”和“先升后降”的变化趋势呼应,-Gal和-Xyl活性在3 DAF显著高于其他时期,但随着果实发育,Xyl活性在2份种质中均依次下降,-Gal活性在厚肉型中17 DAF小幅上升,呈“降-升-降”趋势,薄肉型呈“先降后升”趋势,相关分析显示,部分酶活性之间呈(极)显著正相关,酶活性与成分之间以及与果实性状之间呈(极)显著负相关,表明酶与酶之间存在一定的协同作用,其活性影响细胞壁组分的合成和降解,-Xyl和-Gal活性在3 DAF显著高于其它时期,表明两者在苦瓜早期生长的调控效应较其他阶段较高,此结果符合大多数植物果实早期发育的细胞变化规律,即在果实生长发育早期主要以细胞分裂为主,细胞壁裂解频繁,需要许多细胞壁酶进行高效作业,以达到快速获得大量细胞的目的。相关性分析结果也印证了在果实发育后期即细胞分裂结束后,酶活性趋于平稳,细胞转入膨大生长期,随着细胞体积的膨大,果实也随之不断增大,最终影响苦瓜果实的产量及品质。
综上,苦瓜的FD、FLD、FT、FFW和FDW随果实发育不断增大,细胞壁组分HCE和CE含量可能对中后期果实发育,尤其是果肉增厚有较大影响,细胞壁代谢相关酶活性与果实发育也关系紧密,-Xyl和-Gal活性在花后3 d高于其他时期,推测这2种酶可能与苦瓜早期发育有较大关联,具体机制需进一步深入研究。
[1] KHANNA P, JAIN S C, PANAGARIYA A, et al. Hypoglycemic activity of polypeptide-p from a plant source [J]. J Nat Prod, 1981, 44 (6): 648–655. doi: 10.1021/np50018a002.
[2] TAN S P, KHA T C, PARKS S E, et al. Bitter melon (L.) bioactive composition and health benefits: A review [J]. Food Rev Int, 2016, 32(2): 181–202. doi: 10.1080/87559129.2015.105 7843.
[3] HUANG Y Q, WAN X J, ZHANG J Y, et al. Evaluation and genetic diversity analysis of bitter gourd based on major phenotypic traits [J]. J Shanghai Jiaotong Univ (Agric Sci), 2016, 34(2): 47–52. [黄月琴, 万新建, 张景云, 等. 苦瓜主要表型性状的评价及其遗传多样性分析 [J]. 上海交通大学学报(农业科学版), 2016, 34(2): 47–52. doi: 10. 3969/J.ISSN.1671-9964.2016.02.007.]
[4] ZHANG H M, CUI J W, YU J Z, et al. Effects of fruit development stage on nutrient contents and antioxidant capacity ofvarieties with different fruit colors [J]. Acta Agric Jiangxi, 2022, 34(3): 179–184. [张红梅, 崔佳维, 余纪柱, 等. 果实发育期对不同果色苦瓜营养成分含量及抗氧化能力的影响 [J]. 江西农业学报, 2022, 34(3): 179–184. doi: 10.19386/j.cnki.jxnyxb.2022.03.028.]
[5] SHAH S S A, HUSSAIN M I, ASLAM M K, et al. Natural products; pharmacological importance of family cucurbitaceae: A brief review [J]. Mini Rev Med Chem, 2014, 14(8): 694–705. doi: 10. 2174/1389557514666140820113055.
[6] KARATAŞ A, ŞAVŞATLI Y. Characterization of volatile compounds nongrafted and pumpkin-grafted bitter gourd (L.) [J]. Turk J Agric For, 2022, 46(3): 327–339. doi: 10.55730/1300-011X. 3006.
[7] LU L. Fine mapping of QTL for pulp thickness in cucumber and functional validation of candidate genes [D]. Yangzhou: Yangzhou University, 2016: 8–17. [陆璐. 黄瓜果肉厚度QTL的精细定位及候选基因功能验证 [D]. 扬州: 扬州大学, 2016: 8–17.]
[8] ZHANG B C, ZHOU Y H. Plant cell wall formation and regulation [J]. Sci Sin (Vitae), 2015, 45(6): 544–556. [张保才, 周奕华. 植物细胞壁形成机制的新进展 [J]. 中国科学(生命科学), 2015, 45(6): 544–556. doi: 10.1360/N052015-00076.]
[9] LIU J F, ZHANG H Y, PENG S A. Changes of calcium in flesh, seeds and pectin content during pear fruit development [J]. Acta Hort Sin, 2003, 30(6): 709–711. [刘剑锋, 张红艳, 彭抒昂. 梨果实发育中果肉及种子钙和果胶含量的变化 [J]. 园艺学报, 2003, 30(6): 709–711. doi: 10.3321/j.issn:0513-353X.2003.06.017.]
[10] PROCTOR A, PENG L C. Pectin transitions during blueberry fruit development and ripening [J]. J Food Sci, 1989, 54(2): 385–387. doi: 10.1111/j.1365-2621.1989.tb03088.x.
[11] XU J Y, ZHAO Y H, ZHANG X, et al. Transcriptome analysis and ultrastructure observation reveal that hawthorn fruit softening is due to cellulose/hemicellulose degradation [J]. Front Plant Sci, 2016, 7: 1524. doi: 10.3389/fpls.2016.01524.
[12] PAULL R E, GROSS K, QIU Y X. Changes in papaya cell walls during fruit ripening [J]. Postharv Biol Technol, 1999, 16(1): 79–89. doi: 10. 1016/S0925-5214(98)00100-8.
[13] LI P, LIAO K, ZHAO S R, et al. Variation of cell wall and hydrolases in apricot fruit during development and maturing process [J]. J Xinjiang Agric Univ, 2013, 36(4): 298–303. [李萍, 廖康, 赵世荣, 等. 杏果实发育成熟过程中细胞壁组分和水解酶活性的变化 [J]. 新疆农业大学学报, 2013, 36(4): 298–303. doi: 10.3969/j.issn.1007-8614. 2013.04.008.]
[14] YANG G H, LYU B Y, HAN D G, et al. Change of cell wall compo- nents and related enzyme activities during the development process of raspberry fruit [J]. North Hortic, 2016(11): 27–30. [杨国慧, 吕冰玉, 韩德果, 等. 树莓果实发育过程中细胞壁成分及相关酶活性变化 [J]. 北方园艺, 2016(11): 27–30. doi: 10.11937/bfyy.201611007.]
[15] GAO H H. Physiological and molecular mechanism of cell wall differential metabolism in loquat with red-fleshed and white-fleshed [D]. Fuzhou: Fujian Agriculture and Forestry University, 2020: 14–23. [高欢欢. 红白果肉枇杷细胞壁代谢差异的生理分子机理 [D]. 福州: 福建农林大学, 2020: 14–23.]
[16] QIU Z H, CHEN J Y, PENG Y Q, et al. Changes in cell wall components and related enzyme activities ofduring fruit development stage [J]. J Trop Subtrop Bot, 2019, 27(6): 677–683. [邱志浩, 陈晶英, 彭远琴, 等. 橄榄果实发育过程中细胞壁物质和相关酶活性变化 [J]. 热带亚热带植物学报, 2019, 27(6): 677–683. doi: 10.11926/jtsb.4028.]
[17] ZHAO S L, JIANG M F, WEI Y Y, et al. Variation of cell wall component during pear growing process [J]. J S Agric, 2013, 44(11): 1861–1865. [赵树亮, 蒋明凤, 魏媛媛, 等. 梨果实生长过程中细胞壁成分的变化分析 [J]. 南方农业学报, 2013, 44(11): 1861–1865. doi: 10.3969/j:issn.2095-1191.2013.11.1861.]
[18] BURTON R A, GIDLEY M J, FINCHER G B. Heterogeneity in the chemistry, structure and function of plant cell walls [J]. Nat Chem Biol, 2010, 6(10): 724–732. doi: 10.1038/nchembio.439.
[19] JIA D C, BU F W, JIANG J Q, et al. Analysis of glycometabolism of ‘Hongyang’ kiwifruit during storage [J]. Hunan Agric Sci, 2021(10): 69–73. [贾德翠, 卜范文, 蒋娟琼, 等. ‘红阳’猕猴桃果实低温贮藏期糖代谢分析 [J]. 湖南农业科学, 2021(10): 69–73. doi: 10.16498/j. cnki.hnnykx.2021.010.017.]
[20] SEGONNE S M, BRUNEAU M, CELTON J M, et al. Multiscale investigation of mealiness in apple: An atypical role for a pectin methy- lesterase during fruit maturation [J]. BMC Plant Biol, 2014, 14(1): 375. doi: 10.1186/s12870-014-0375-3.
[21] GROSS K C, WALLNER S J. Degradation of cell wall polysaccha- rides during tomato fruit ripening [J]. Plant Physiol, 1979, 63(1): 117– 120. doi: 10.1104/pp.63.1.117.
[22] LI Y J, ZHU X, JING Y Y, et al. Effects of the combination treatment of nitric oxide and ethephon on softening related enzyme activity of harvested tomato fruits [J]. Food Sci Technol, 2016, 41(7): 32–37. [李艳娇, 朱璇, 敬媛媛, 等. NO与乙烯利处理对番茄果实采后软化相关酶活的影响 [J]. 食品科技, 2016, 41(7): 32–37. doi: 10.13684/j. cnki.spkj.2016.07.006.]
[23] SU J, ZHUANG J P, CHEN W X.-d-xylosidase activity in banana (spp.) fruits during ripening and softening [J]. Acta Bot Boreali- Occid Sin, 2007, 27(7): 1394–1398. [苏菁, 庄军平, 陈维信. 香蕉果实成熟软化过程中-d-木聚糖苷酶活性变化 [J]. 西北植物学报, 2007, 27(7): 1394–1398. doi: 10.3321/j.issn:1000-4025.2007.07.018.]
[24] DONG B Y. Mechanism analysis of β-glycosidase in the degradation of anthocyanins fromand[D]. Guangzhou: South China Agricultural University, 2019: 36–48. [董柏余.-糖苷酶在鸳鸯茉莉和拟南芥花色素苷降解中的机制分析 [D]. 广州: 华南农业大学, 2019: 36–48.]
[25] TAKIZAWA A, HYODO H, WADA K, et al. Regulatory specialization of xyloglucan (XG) and glucuronoarabinoxylan (GAX) in pericarp cell walls during fruit ripening in tomato () [J]. PLoS One, 2014, 9(2): e89871. doi: 10.1371/journal.pone.0089871.
[26] CHEA S, YU D J, PARK J, et al. Fruit softening correlates with enzymatic and compositional changes in fruit cell wall during ripening in ‘Bluecrop’ highbush blueberries [J]. Sci Hort, 2019, 245: 163–170. doi: 10.1016/j.scienta.2018.10.019.
[27] MAO L C, ZHANG S L. Role of pectolytic enzymes and cellulase during ripening and woolly breakdown in peaches [J]. Acta Hort Sin, 2001, 28(2): 107–111. [茅林春, 张上隆. 果胶酶和纤维素酶在桃果实成熟和絮败中的作用 [J]. 园艺学报, 2001, 28(2): 107–111. doi: 10.3321/j.issn:0513-353X.2001.02.003.]
[28] HUBER D J. The role of cell wall hydrolases in fruit softening [M]// JANICK J. Horticultural Reviews, Volume 5. Westport: The AVI Publishing Company, Inc, 1983: 169–219. doi: 10.1002/9781118060728. ch4.
[29] SIDDIQUI S, BANGERTH F. Studies on cell wall mediated changes during storage of calcium-infiltrated apples [J]. Acta Hort, 1993(326): 105–113. doi: 10.17660/ActaHortic.1993.326.10.
[30] ZHANG X R, ZHANG B C, LIU L X, et al. Correlation analysis between main fruit characters and quality characters of South China type cucumber [J]. Hubei Agric Sci, 2020, 59(S1): 389–391. [张秀荣, 张保才, 刘亮希, 等. 华南型黄瓜主要果实性状与品质性状间的相关分析 [J]. 湖北农业科学, 2020, 59(S1): 389–391. doi: 10.14088/j. cnki.issn0439-8114.2020.S1.106.]
[31] HE X M, CHEN Q H, LIN Y E. Correlation and path analysis between yield and fruit traits of south China cucumber [J]. Guangdong Agric Sci, 2001(1): 17–18. [何晓明, 陈清华, 林毓娥. 华南型黄瓜产量与果实性状的相关和通径分析 [J]. 广东农业科学, 2001(1): 17–18. doi: 10.16768/j.issn.1004-874x.2001.01.008.]
[32] YANG Y. Study on the length and width change rule of developing cucumber fruit and their correlation to the shape of other organs [D]. Yangling: Northwest A&F University, 2018: 12–24. [杨悦. 黄瓜果实发育过程纵横径变化规律及其器官形状相关性研究 [D]. 杨凌: 西北农林科技大学, 2018: 12–24.]
[33] ZHANG Y, YANG Y, TIAN L B, et al. Multiple statistics analysis of the quality traits of bitter gourd (L.) [J]. Mol Plant Breed, 2015, 13(9): 2001–2010. [张燕, 杨衍, 田丽波, 等. 苦瓜品质性状的多元统计分析 [J]. 分子植物育种, 2015, 13(9): 2001– 2010. doi: 10.13271/j.mpb.013.002001.]
[34] ZHANG Y C, ZHANG W G, HUANG X G, et al. The regulars of expanding and dry materials distribution of balsam pears [J]. Fujian J Agric Sci, 2005, 20(S1): 109–112. [张玉灿, 张伟光, 黄贤贵, 等. 苦瓜果实膨大与干物质的分配规律 [J]. 福建农业学报, 2005, 20(S1): 109–112. doi: 10.3969/j.issn.1008-0384.2005.z1.029.]
[35] LI S P. Transcriptome analysis of melon (L.) fruit with different texture during ripening and study ongenes [D]. Tianjin: Tianjin University, 2017: 23–39. [李三培. 不同质构甜瓜果实成熟软化的转录组分析及基因研究 [D]. 天津: 天津大学, 2017: 23– 39.]
[36] LI H. The metabolism of cell wall materials and gene expression during fruit ripening and softening in ZMill. [D]. Yangling: Northwest A&F University, 2017: 14–25. [李欢. 枣果实成熟软化的细胞壁物质代谢及其基因表达研究 [D]. 杨凌: 西北农林科技大学, 2017: 14–25.]
[37] WU B T, WANG J, QIU X, et al. Biomechanical study on hardness changes during maturation of Lingwu long jujube [J]. J Henan Agric Univ, 2020, 54(5): 770–777. [吴宝婷, 王娟, 邱雪, 等. 灵武长枣成熟过程中硬度变化的生物力学研究 [J]. 河南农业大学学报, 2020, 54(5): 770–777. doi: 10.16445/j.cnki.1000-2340.2020.05.006.]
[38] MA L, QIAO J, LÜ C J, et al. Differential analysis of pectin content and gene expression in grapes with different texture [J]. Jiangsu Agric Sci, 2022, 50(13): 64–69. [马丽, 乔军, 吕春晶, 等. 不同质地葡萄果实果胶含量及基因表达差异分析 [J]. 江苏农业科学, 2022, 50 (13): 64–69. doi: 10.15889/j.issn.1002-1302.2022.13.011.]
[39] XU J, LI J, ZHANG X L, et al. Variations of cell wall components and hydrolase activity of ‘Korla fragrant pear’ during the fruit develop- mental stage [J]. J Fruit Sci, 2015, 32(6): 1114-1117. [许娟, 李疆, 张校立, 等. ‘库尔勒香梨’果实发育中细胞壁组分和水解酶活性的变化 [J]. 果树学报2015,32(6): 1114-1117. doi: 10.13925/j.cnki.gsxb. 20150030.]
[40] ZHANG J N, LI J H, ZHAO J H, et al. Changes in cell wall ultra- structure and components of seed-used watermelon fruit in storage [J]. J Fruit Sci, 2006, 23(2): 256–259. [张建农, 李计红, 赵建华, 等. 子瓜果实贮存期细胞壁超显微结构及相关成分的变化 [J]. 果树学报, 2006, 23(2): 256–259. doi: 10.3969/j.issn.1009-9980.2006.02.023.]
[41] XU B, ATAWULA T, ZHANG T, et al. Effects of different tempera- tures on the fruit softening of Xizhoumi No. 25 Hami Melon during storage [J]. Xinjiang Agric Sci, 2022, 59(5): 1135–1143. [徐斌, 阿塔吾拉·铁木尔, 张婷, 等. 不同贮藏温度对西州密25号哈密瓜果实软化的影响 [J]. 新疆农业科学, 2022, 59(5): 1135–1143. doi: 10. 6048/j.issn.1001-4330.2022.05.012.]
[42] CAO R X, XU S, LI L, et al. Changes of cell wall components and degradation enzyme activity in sweetpotato storage roots during storage [J]. J China Agric Univ, 2020, 25(5): 59–69. [曹如霞, 徐舒, 李玲, 等. 甘薯块根贮藏期间细胞壁成分及降解酶活性变化 [J]. 中国农业大学学报, 2020, 25(5): 59–69. doi: 10.11841/j.issn.1007- 4333.2020.05.06.]
Differences of Cell Wall Components and Related Enzyme Activities inFruits at Different Development Stages
QIU Boyin, LIN Hui, ZHANG Qianrong, LI Yongping, WEN Qinfang, ZHU Haisheng*, LI Dazhong*
(Fujian Key Laboratory of Vegetable Genetics and Breeding, Fujian Engineering Research Center for Vegetables, Crops Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350013, China)
In order to understand the causes of fruit quality differences in, the contents of cell wall components and related enzyme activities in thick flesh-type ‘LX1-3’ and thin flesh-type ‘ZK54’ were studied during fruit development. The results showed that diameter (FD), lumen diameter (FLD),pulp thickness (PT), fresh weight (FFW) and fresh weight (FDW) of fruit in ‘LX1-3’ were all higher than those in ‘ZK54’ at 17 days after flowering (DAF). The contents of cell wall components and related enzyme activities were different among cultivars. the content of water-soluble pectin in ‘LX1-3’ was higher than that of ‘ZK54’, and it was significantly positively correlated with PT, FFW, FDW. The contents of hemicellulose (HCE) and cellulose (CE) in ‘LX1-3’ were higher than those in ‘ZK54’ at 17-23 DAF. The activities of-Gal and-Xyl of both cultivars at 3 DAF were higher than those at the other three stages. The variation trend of PG,-Gal and pectinase activities was consistent with that of ionic pectin and covalent pectin. The activities of-Gal,-Xyl and cellulase had (extremely) significantly negatively correlated with 5 growth traits, as well as PG with FD, FLD and PT. Therefore, cell wall components and enzyme activities were closely related to fruit development.-Xyl and-Gal played major roles in early fruit development, while HCE and CE had great influence on middle and later fruit developments.
; Fruit; Development; Cell wall component; Enzyme activity
10.11926/jtsb.4699
2022-07-08
2022-08-04
福建省公益类科研院所专项(2020R10310010);福建省农业科学院自由探索科技创新项目(ZYTS2021001);福建省农科院蔬菜遗传育种科技创新团队项目(CXTD2021038);福建省农科院科技创新平台专项(CXPT202001)资助
This work was supported by the Special Project for Basic Research of Public Research Institute in Fujian (Grant No. 2020R10310010), the Project for Freely Explore Scientific and Technological Innovation in Fujian Academy of Agricultural Sciences (Grant No. ZYTS2021001), the Project for Vegetable Genetics and Breeding Technology Innovation Team of Fujian Academy of Agricultural Sciences (Grant No. CXTD2021038), and the Special Project for Science and Technology Innovation Platform of Fujian Academy of Agricultural Sciences (Grant No. CXPT202001).
裘波音(1984年生),女,博士,助理研究员,主要从事蔬菜生物技术与育种研究。E-mail: qby747_1030@163.com
* 通讯作者 Corresponding author. E-mail: zhs0246@163.com; 772857984@qq.com

