在口腔表皮样癌细胞中c-myc对GS和GLS表达的调控以及对癌瘤生长的裸鼠体内实验研究
张倩倩 刘思浩 郭亚丽 王涛
谷氨酰胺(Gln)是肿瘤代谢的标志物[1],能够弥补葡萄糖不足以满足肿瘤细胞生长的氮源和碳源等能量需求[2],对于肿瘤细胞来说,Gln为其“必需氨基酸”,在缺乏Gln的条件下,肿瘤细胞会发生凋亡,因此阻断Gln的代谢成为治疗癌症的选择[3]。而Gln代谢由谷氨酰胺合成酶(GS)与谷氨酰胺酶(GLS)共同调控[4],二者分别掌控Gln的来源及去向,且二者已被认为是癌症治疗的基本靶点[5-6]。 c-myc是原癌基因myc家族中的一个重要成员,通过激活或抑制靶基因的转录来调控细胞的代谢、生长、分化、凋亡,进而介导肿瘤的生命活动[7-9],且前期细胞实验证实GLS及GS高表达与c-myc相关,因此本研究追加动物实验,并对大体标本进行观察检测以更直观探索c-myc在代谢方面对GLS及GS的调控作用,本次研究由体外实验深化到体内实验,为通过调控口腔癌细胞代谢来抑制肿瘤进展的肿瘤治疗方式提供更有力的理论基础。
1 材料及方法
1.1 主要试剂及材料
抗GS抗体、抗GLS抗体、抗c-myc抗体(Abcam, 英国); 二抗(山羊抗兔鼠通用)、PBS 缓冲液、EDTA 抗原修复液、组化试剂盒DAB显色剂(福州迈新生物科技有限公司); 苏木素染色液(南京建成生物工程研究所); KB细胞(上海SHBIO); FBS(HyClone, 美国); RPMI1640、 胰酶(Gibco, 美国); TRIZOL试剂盒、 PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(TaKaRa, 日本)。
1.2 实验方法
1.2.1 免疫组化检测c-myc、GLS和GS表达 口腔癌标本石蜡包埋切片,脱蜡水化,修复抗原,滴加封闭液,分别滴入一抗抗c-myc抗体(1∶100)、抗GLS抗体(1∶200)、抗GS抗体(1∶100), 4 ℃孵育过夜,PBS冲洗,滴加二抗,室温孵育10 min,PBS冲洗,DAB显色,苏木精轻度复染、脱水、透明封片,光学显微镜观察。
1.2.2 细胞培养 KB细胞采用RPMI1640(含10%FBS)培养液,在37 ℃、 5% CO2恒温培养箱中培养。
1.2.3 人源性c-myc真核过表达载体构建并验证 将KB细胞株接种到6 孔板中,每孔5×105个,细胞长至皿底80%~90%,更换培养基为Opti-MEM,继续培养,分为三组:实验组转染 pEGFP-C1-myc质粒,空载体组转染 pEGFP-C1c 质粒,设立平行对照组,转染72 h,分别收集三组细胞,TRIzol试剂盒提取各组细胞的RNA,逆转录试剂盒合成cDNA,实时荧光定量PCR实验检测目的基因的表达,以 GAPDH为内参基因。
1.2.4 裸鼠移植瘤模型制备并检测 培养KB细胞至细胞密度达1×108个/mL,重悬细胞,消毒裸鼠背部,正常组、空载体组及c-myc组分别皮下注射0.1 mL的 KB细胞、c-myc过表达对照细胞及c-myc过表达细胞悬液,各6 只,每5 d测量体重,并用公式V=(长度×宽度2)/2计算肿瘤体积。饲养30 d,计算生存率,分离肿瘤并称重,免疫组化检测肿瘤中c-myc、 GLS、 GS表达。
1.2.5 统计分析 本研究所有实验均重复3 次,实验数据通过GraphPad7.0软件进行处理。样本均数间的比较采用单因素方差分析(One-Way ANOVA),P<0.05被认为具有统计学差异。
2 结 果
2.1 口腔及边缘组织中c-myc、 GLS和GS的表达
采用免疫组化(IHC)的UltraSensitiveTMS-P法检测,使用IMAG J 软件进行强度分析,Graphpad prism 7.0软件进行数据处理,结果提示,与边缘组织相比,三者在口腔鳞状细胞癌标本中均高表达(图1A),GLS和GS在 T2期表达量最高(P<0.05)(图1B)。
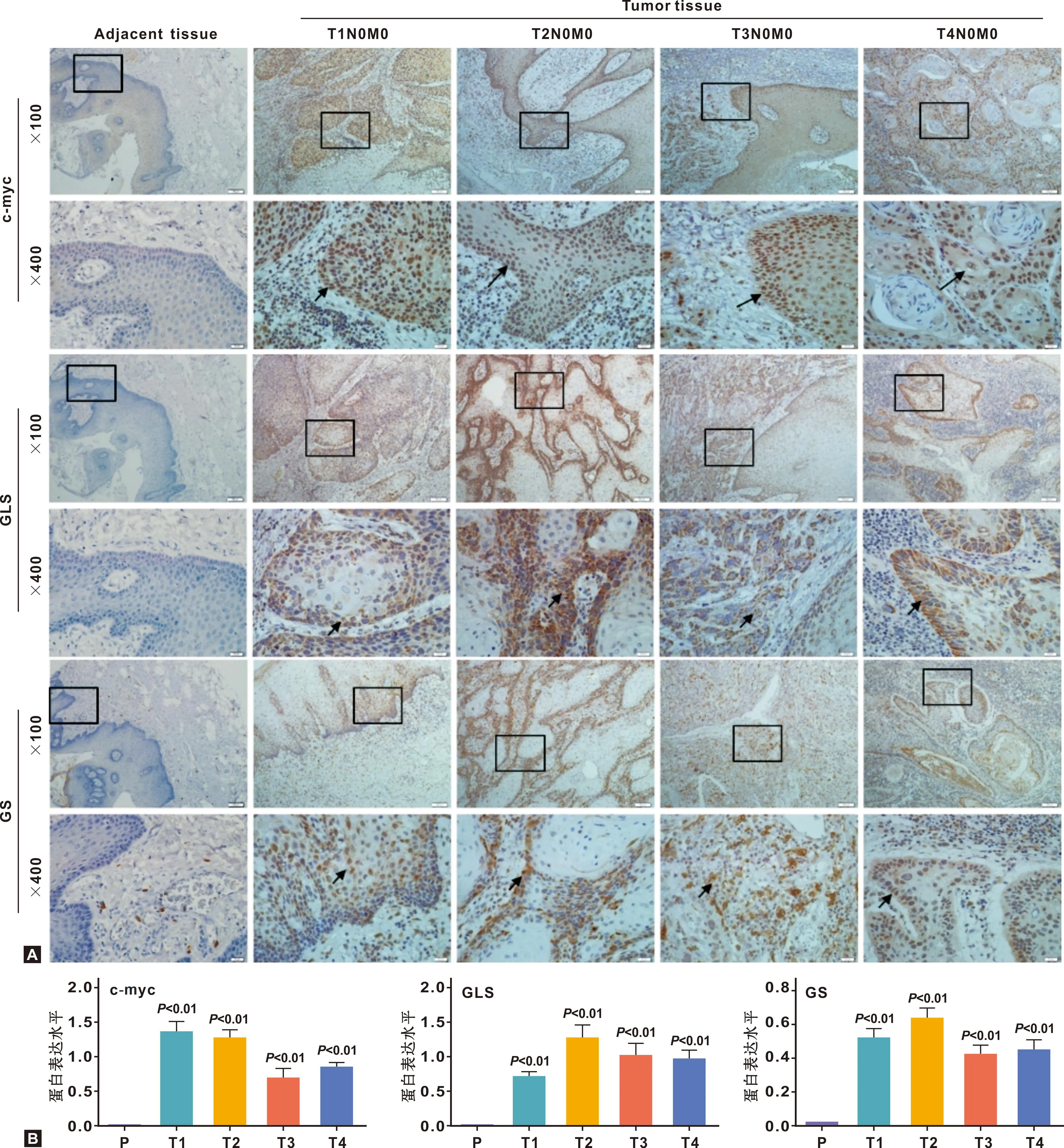
图1 标本组织中c-myc、 GLS和GS的表达
2.2 转染后验证细胞c-myc表达
转染后荧光结果示含有c-myc基因的KB细胞荧光强度高于空载组(图2A),且c-myc mRNA表达水平高(P<0.01)(图2B)。
2.3 成瘤情况及裸鼠存活情况
注射后第5 天,正常组和空载体组未见肿瘤形成,c-myc组见小米粒大小肿瘤形成,第10 天, 3 组均出现肉眼可见肿瘤,随时间延长肿瘤体积逐渐增大, 30 d内, 3 组裸鼠均未死亡。
2.4 裸鼠体重变化
注射后第5 天, 3 组实验动物体重基本保持一致(图3A),随着时间延长, 3 组动物体重均有增加,但无差异(图3B)。

图3 实验动物的生长情况及生长分析
2.5 肿瘤体积变化
注射后每隔5 d对肿瘤的生长情况进行观察、测量,随着时间延长, c-myc组肿瘤体积大于空载体组,空载体组大于正常组(图4A)。正常组、空载体组及c-myc组肿瘤体积差距不断变大, 30 d后, c-myc组显著增加(P<0.01)(图4B)。
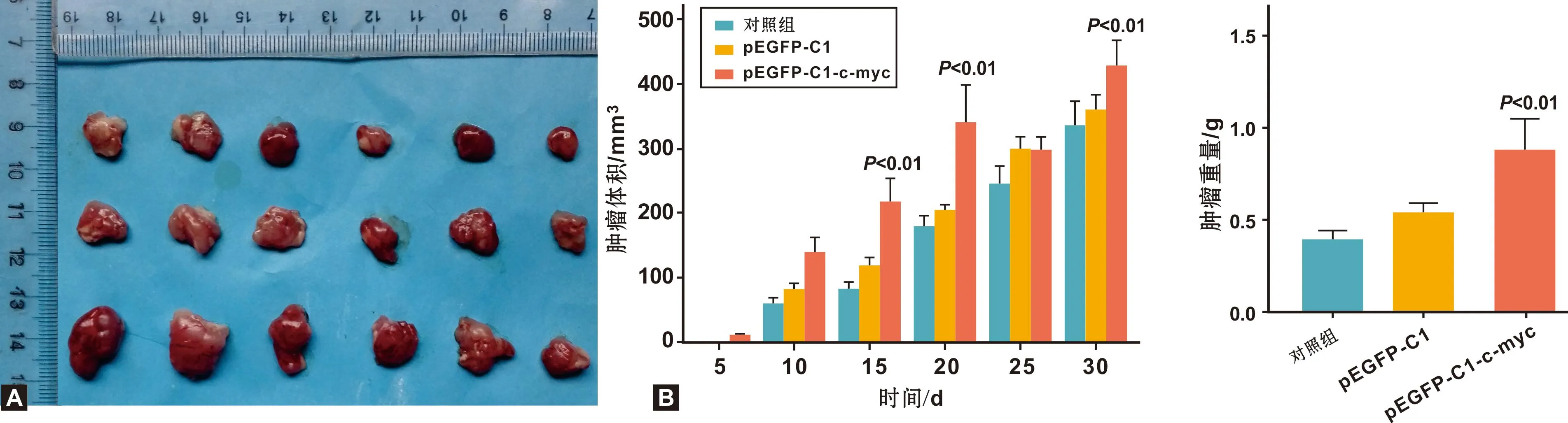
图4 裸鼠成瘤30 d后肿瘤的体积变化及分析
2.6 肿瘤重量
饲养30 d后,测量肿瘤重量, c-myc组肿瘤质量较高,空载体组肿瘤质量次之,正常组肿瘤质量最小, c-myc组肿瘤重量显著增加(P<0.01)(图5),肿瘤质量约是正常组肿瘤质量的2 倍。
2.7 免疫组化结果
饲养30 d后,分离肿瘤,用UltraSensitiveTMS-P免疫组化的方法检测肿瘤中c-myc、GLS、GS的表达情况,使用IMAG J软件进行荧光强度分析,Graphpad prism 7.0软件进行数据处理,结果提示c-myc组GLS和GS表达均显著高于其他两组(P<0.01),空载体组与正常组表达相差不大(图6)。
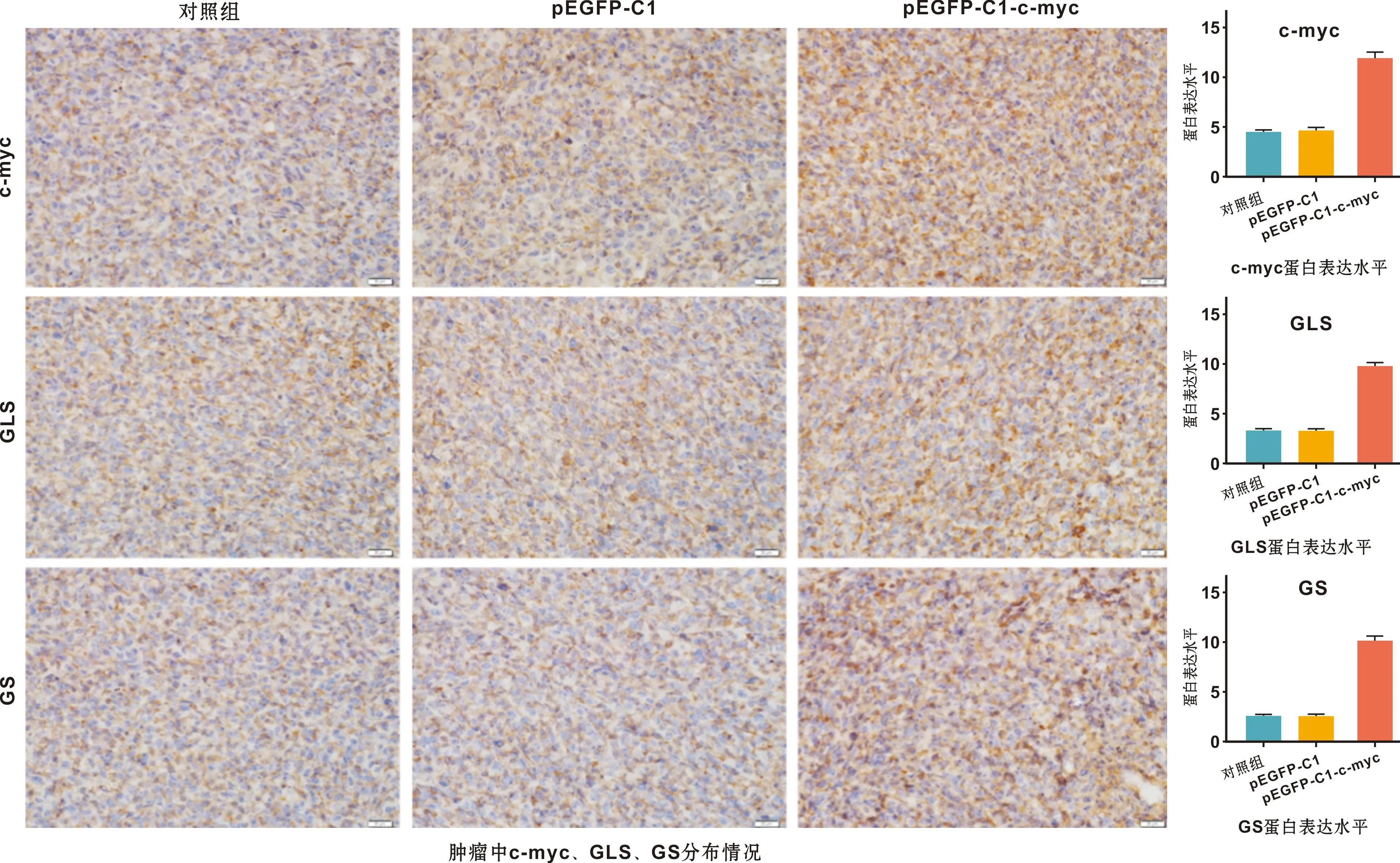
图6 实验动物肿瘤标本中c-myc、GLS和GS表达分析
3 讨 论
本研究发现口腔癌标本中c-myc、 GLS、 GS均存在高表达,这与Pai等[10]的研究结果相一致。细胞实验证实,GLS及GS高表达与c-myc相关,c-myc可上调GLS和GS的表达,从而增强癌细胞的增殖和迁移等生物学行为,进而促进口腔肿瘤的发生发展,本次研究在细胞实验的基础上追加动物实验, 并对大体标本进行观察检测,以更直观探索c-myc与GS及GLS之间的关联性。
本研究建立了c-myc稳定高表达细胞模型,显示c-myc过表达组的荧光强度及c-myc mRNA表达水平均显著高于空载体对照组,细胞模型构建成功。
利用裸鼠皮下成瘤成功率高、周期短的特性[11],结合细胞移植方法构建裸鼠成瘤模型[12],将c-myc稳定高表达癌细胞注射至裸鼠皮下,发现相同条件下,c-myc组的肿瘤体积及重量显著大于正常组及空载体组,证明c-myc可促进肿瘤细胞增殖、加速成瘤。饲养30 d后,处死小鼠,分离肿瘤, 免疫组化检测发现c-myc过表达组的GLS及GS表达均显著高于正常组和空载体组,而c-myc低表达的正常组及空载体组其GLS及GS的表达量也明显降低,证明c-myc可诱导GLS及GS表达,从而调控癌细胞的Gln代谢,以加速成瘤,而当c-myc表达受到抑制后GLS及GS的表达也明显下调,从而限制Gln代谢,以抑制肿瘤的形成,因此本实验可为从代谢角度抑制肿瘤生长提供一定的依据。
4 小 结
利用c-myc稳定高表达的口腔癌裸鼠皮下成瘤模型验证了c-myc可诱导GLS及GS表达,从而调控癌细胞的Gln代谢,加速瘤形成。

