芥子酸对含壳聚糖的模型饮料中花色苷的保护作用
艾 欣, 潘 飞, 朱泽辉, 张铭昕, 刘雅琪,赵 磊,*, 赵 亮,*
(1.北京工商大学 北京食品营养与人类健康高精尖创新中心/北京市食品添加剂工程技术研究中心,北京 100048; 2.中国农业科学院 蜂蜜研究所,北京 100093)
颜色作为评价食物的重要感官指标之一,影响着消费者对于食品的选择和接受度。长期以来,为保证食物的色泽,着色剂被广泛应用于食品加工行业中。然而,合成食品着色剂(三芳基甲烷类、氧杂蒽类和偶氮类等)不仅不能提供人体所必需的营养,安全性也备受质疑[1]。研究表明,部分合成着色剂经人体代谢后可引起过敏反应,产生致癌物质,与靶细胞相互作用[1-2]。天然着色剂花色苷来源广泛、无毒,与生物系统相容性高,且具有较好的生物活性,如抗炎、抗氧化、调节血脂等[3],被认为是食品工业中最佳的天然着色剂之一。
天然花色苷具有强大的着色能力,在酸性pH值下,只需要很小的浓度就可以使食品获得所需的红色、粉红色和紫色[4],并且能快速溶于食品水相中[5],常用于软饮料和葡萄酒等产品的生产。然而花色苷非常容易降解,其稳定性受到各种因素的影响,如pH值、温度、光、氧和抗坏血酸等[6]。抗坏血酸在食品工业中常被作为抗氧化剂和营养增补剂使用,饮料等一些食品中的抗坏血酸往往与花色苷同时存在。由于抗坏血酸的自氧化会破坏花色苷的结构导致花色苷被降解[7],因此,寻找能应用于食品中且能提高花色苷稳定性的辅色剂尤为关键。
壳聚糖(chitosan,CS)是一种聚阳离子多糖,是由几丁质经过脱乙酰作用得到的产物,无毒且生物相容性和生物降解性好[8],同时具有抑菌、降脂和增强免疫等多种生理功能[9]。近年来,研究人员普遍将CS用于花色苷智能活性食品保鲜膜和递送载体的研究。Pinheiro等[10]将葡萄皮花色苷吸附在CS上,成功提高了花色苷的热稳定性。Ge等[11]用CS衍生物制备花色苷纳米复合物,显著提高了在抗坏血酸影响下花色苷的稳定性。目前已有研究将CS作为饮料的稳定剂或增稠剂[12-13],在改善饮料体系质地和稳定性的同时也赋予饮料一定的生理活性。然而,饮料中CS的性质如溶解性、稳定性等[14]易受体系pH值影响[15],且抗坏血酸也是饮料中常见的成分和添加剂。因此,研究CS和抗坏血酸同时存在时对花色苷稳定性的影响至关重要,Ai等[16]前期研究发现,溶液中的CS反而会对抗坏血酸存在时的花色苷稳定性造成不利影响。酚酸是花色苷的一种重要辅色剂,花色苷与酚酸如咖啡酸、芥子酸(sinapic acid,SA)、迷迭香酸[17]等相互作用能够形成一种“三明治”结构的复合物,进而达到增强色泽、提高颜色稳定性的效果[18]。量子化学计算结果表明,SA在12种有机酸中与花色苷(矢车菊素-3-O-葡萄糖苷)之间的二元配合物结合能最高[16],因此选择芥子酸作为典型酚酸辅色剂用于后续研究。此前,Watrelot等[19]和Guo等[20]证实了多酚能够非共价结合凝胶或分散形式的多糖,并且形成的凝胶极易吸附和结合花色苷等酚类化合物[21],因此我们推测多酚具有改善多糖对花色苷保护作用的潜力。Fernandes等[22]在果胶-花色苷混合物中加入儿茶素出现了增色效应,起到了辅色作用。Zhao等[23]证实了迷迭香酸与黄原胶联用能提高L-抗坏血酸存在下花色苷的稳定性。然而,此前鲜有关于利用酚酸来改善高浓度多糖对花色苷不利影响的报道,且其作用机制还有待研究。
花色苷模型饮料是可以模拟食品饮料体系中花色苷的存在状态,并排除多余物质干扰,借以研究花色苷稳定性的一种研究模型。壳聚糖目前未被国标列入饮料类食品添加剂中,本研究仅是将酚酸与多糖联用来提高花色苷模型饮料稳定性的一种探讨。本研究拟采用降解动力学、分子动力学模拟等手段,研究SA对含CS和抗坏血酸的模型饮料体系中黑米花色苷稳定性的保护效果和作用机制,希望为酚酸提高多糖对花色苷的保护作用提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
黑米花色苷提取物[矢车菊素-3-O-葡萄糖苷(纯度>15%)],湖北紫鑫生物科技有限公司;芥子酸(纯度≥97%),上海源叶生物科技有限公司;壳聚糖(分子质量为50~190 kDa,脱乙酰度≥75%),美国Sigma-Aldrich公司;抗坏血酸,天津福晨化学试剂有限公司;所有试剂均为国产分析纯。
1.2 仪器与设备
SpectraMax i3型连续波长多功能酶标仪,美国Molecular Devices公司;VC1010D型照亮计,西安胜利仪器有限责任公司;CM-3601A型色差仪,日本柯尼卡美能达控股株式会社;HHSY21-Ni4型恒温水浴锅,北京精华科瑞仪器有限公司。
1.3 实验方法
1.3.1CS和SA混合溶液的制备
称取不同质量的CS溶于pH值为3.0的柠檬酸缓冲溶液,搅拌过夜至充分水合,制备得到不同质量浓度的CS溶液(2.5、5.0、10.0、20.0、40.0 mg/mL)。将SA加入CS溶液中,得到SA(质量浓度为5 mg/mL)和CS混合溶液。CS的添加浓度根据文献报道的饮料中使用范围确定[24]。
1.3.2花色苷溶液的制备
花色苷溶液的制备按照Zhao等[25]的方法,略加修改。将一定量的黑米花色苷提取物粉末溶于20 mmol/L柠檬酸缓冲液(pH值3.0)中,使花色苷的质量浓度为0.25 mg/mL,搅拌10 min后,加入CaCl2,使Ca2+的终质量浓度为0.2 mg/mL,然后加入L-抗坏血酸(1 mg/mL)充分混合。加入等体积的不同浓度的CS或CS+SA溶液,充分混合后将各溶液的pH值调整为3.0。本实验中花色苷的终质量浓度为0.125 mg/mL,该浓度可减少花色苷的自缔合效应对颜色的干扰。该浓度下,仅添加花色苷溶液记作空白组;添加花色苷和抗坏血酸溶液记作对照组;在对照组基础上添加20、10、5、2.5、1.25 mg/mL的CS分别记作CS20组、CS10组、CS5组、CS2.5组、CS1.25组;在对照组基础上添加SA和20、10、5、2.5、1.25 mg/mL的CS分别记作CS20+SA组、CS10+SA组、CS5+SA组、CS2.5+SA组、CS1.25+SA组。
1.3.3加速储藏实验
加速储藏实验,主要是利用升高温度、加催化剂等方法以加速食品的氧化和腐败,通过加速物质的物理或化学变化,以探讨产品的稳定性,具有减少产品开发时间的优势[26]。根据Zhao等[25]报道的方法,将所有花色苷模型饮料溶液置于试管中,随后,将试管放置于40 ℃水浴,正常光照7 d。采用pH示差法测定溶液中花色苷的含量[17],用色差仪测量溶液颜色的变化,采用紫外分光光度计测定溶液的吸光值[23]。为了可视化颜色变化,使用Adobe Photoshop CC软件从每个样本的L*、a*、b*值中创建色块。
1.3.4降解动力学分析
参考Zhao等[25]报道的方法,根据不同处理时间的吸光值变化可以计算出热降解速率常数K和半衰期t1/2,此外,采用D值可以进一步衡量颜色稳定性的指标。热降解速率常数K、半衰期t1/2和D值的计算方法见式(1)至式(3)。
(1)
(2)
(3)
式(1)至式(3)中,At为加热tmin时的花色苷最大吸光值,A0为花色苷的初始最大吸光值;K为降解速率常数,d-1;t1/2为半衰期,表示花色苷降解至50%所需要的时间,d;D值表示90%的花色苷颜色降解所需的时间,d。
1.3.5分子动力学模拟优化
为了阐明SA对CS存在时花色苷保护作用的机制,对不同花色苷体系进行50 ns分子动力学模拟。使用PACKMOL(Version 20.2)程序包[27]分别对所有组的CS周围随机分配5个花色苷分子,其中CS位于中央,其他分子随机分配在CS周围,且确保CS与其他分子之间存在足够大的距离,两者之间不存在相互作用。花色苷和SA的拓扑使用PRODRG2服务器建立[28],并根据Lemkul等[29]报道的方法,对其几何结构和电荷性质进行修改。模拟体系在矩形的盒子中进行,加入外显溶剂(SPC水模型),所有原子之间保持10 Å的距离,并加入水分子,添加相反电荷的离子用于中和体系电荷。所有体系均采用最陡下降法优化分子体系的几何结构并进行能量最小化(最大设置为1 000.0 kJ·mol-1·nm-1)。能量最小化后,体系经过正则系综NVT(0.2 ns)和等温等压系综NPT(1 ns)两步骤达到平衡。本研究中分子动力学模拟均使用GROMACS(Version.2019.5)软件包进行(http:∥www.gromacs.org)[30],力场采用GROMOS96 43a1[31]使体系恒温(40 ℃),所有含氢原子的键使用默认线性(LINCS)算法进行约束[32]。使用V-rescale方法使体系恒温(40 ℃),使用Parrinello-Rahman方法使体系恒压(1 bar)。采用粒子网格(PME)方法处理远距离静电力[33],以14 Å截断量计算范德华力,时间步长1 fs,每100 fs收集一次快照。模拟结束后,使用GROMACS(Version.2019.5)软件包分析轨迹。所有图片经过PyMOL软件处理。
1.4 数据处理
采用SPSS 17.0软件包进行显著性分析,实验结果以平均值±标准偏差(Mean±SD)表示。所有实验重复3次,设定3~5个平行。组间数据比较用单因素方差分析(one-way ANOVA),P<0.05表示有显著性差异,P<0.01表示差异极显著。使用Origin 2018和PyMoL软件绘图。
2 结果与分析
2.1 SA对含CS的模型饮料中花色苷稳定性的影响
2.1.1对花色苷颜色稳定性的影响
为增强含CS的模型饮料体系中花色苷的稳定性,本研究探究了在不同CS质量浓度下SA对花色苷颜色稳定性的影响。添加CS或CS+SA,对花色苷吸光值和颜色变化量(ΔE*)影响的实验结果见图1。空白组经过加速储藏实验之后,在7 d时,吸光值由0.76下降至0.57[图1(a)、图1(c)],ΔE*值从0增加至9.97[图1(b)、图1(d)]。不同实验组处理下花色苷颜色变化的色块图见图2。由图2可见,花色苷在7 d加速储藏实验条件下颜色仍保持红色,表明在贮藏7 d的过程中,花色苷降解程度较低,并且相对稳定。然而,图1结果表明,在对照组中花色苷的吸光值从0.81下降至0.17,ΔE*值从2.94增加到40.23,且颜色由红色变为淡粉色(图2)。与对照组相比,CS对花色苷的颜色无保护作用,吸光值和ΔE*值变化无显著性差异[图1(a)和图1(b)],添加不同质量浓度的CS(1.25~20.00 mg/mL)+SA(5.00 mg/mL)组中黑米花色苷的吸光值增加,ΔE*值明显降低[图1(c)和图1(d)]。CS5+SA组对花色苷的颜色保护效果最好,在7 d加速储藏实验中,与对照组相比吸光值增加了191.73%,而ΔE*降低了57.27%。这表明,SA显著提高了含CS的模型饮料体系中花色苷颜色的稳定性,具有较好的花色苷颜色保护作用。

图1 CS和CS+SA对花色苷吸光值和ΔE*的影响Fig.1 Effect of CS and CS+SA on absorbance value and ΔE* of anthocyanin
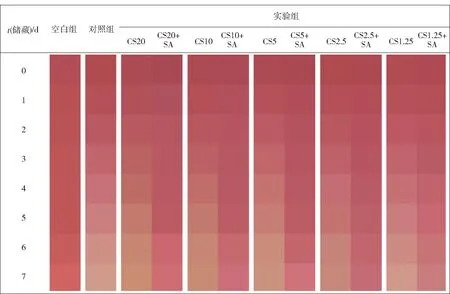
图2 CS和CS+SA存在时花色苷颜色变化分析Fig.2 Analysis of color changes of anthocyanin in presence of CS and CS+SA
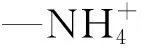
2.1.2对花色苷含量稳定性的影响
加速储藏实验中SA对含CS模型饮料中花色苷保留量的影响见表1。由表1可见,经过7 d加速储藏实验,仅添加花色苷的模型饮料中花色苷的质量浓度从16.62 mg/mL缓慢下降至8.42 mg/mL。CS和SA对花色苷含量的保留率计算结果见图3。在对照组基础上添加CS对花色苷无法达到保护作用。当CS添加的质量浓度为1.25~20.00 mg/mL时[图3(a)],花色苷的保留率仅为8.59%~13.38%,其中CS质量浓度为2.5 mg/mL的CS2.5组保留率最高,颜色稳定性的保护效果也最好。而SA能显著提高含CS模型饮料体系中花色苷的含量,延长花色苷的保留时间。图3(b)显示,CS5+SA组对花色苷的保护效果最好,花色苷的保留率为36.52%,综合CS组和CS+SA组的结果,选择了CS添加的质量浓度为2.5、5.0 mg/mL进行后续降解动力学实验。在CS添加量相同的条件下,CS+SA组对黑米花色苷的保护作用显著高于CS组,这与2.1.1中添加SA后对花色苷作用效果影响的分析结果是一致的。Fernandes等[22]在含有果胶的花色苷溶液中加入了儿茶酸,发现儿茶酸增强了果胶对花色苷的保护作用,因此,推测酚类化合物具有改善多糖对花色苷保护效果的潜力。添加SA能提高CS和抗坏血酸共同存在下花色苷的保留率,并且SA作为酚类化合物具有通过氢原子转移机制清除自由基的能力[38],从而保护花色苷免于抗坏血酸自氧化作用导致的降解。

表1 花色苷在含CS的模型饮料及添加SA体系中的保留量

图3 CS和CS+SA在加速储藏实验条件下对花色苷含量的影响Fig.3 Effect of CS and CS+SA on anthocyanin content under accelerated experimental conditions
2.2 SA对含CS的模型饮料中花色苷的降解动力学分析
图4为花色苷在7 d加速储藏实验中的降解动力学曲线。由图4可以看出,在有或无抗坏血酸存在时,黑米花色苷的降解均符合一级反应动力学(R2>0.99),符合此前研究花色苷降解动力学的报道[39]。降解动力学曲线反映了花色苷在7 d加速储藏实验条件下的降解规律,可以看出,相比仅添加抗坏血酸的对照组引起花色苷的ln(At/A0)大幅下降,

图4 CS和CS+SA对花色苷降解动力学参数的影响Fig.4 Effect of CS and CS+SA on degradation kinetics parameters of anthocyanin
CS+SA组比CS组能更有效地减缓花色苷的降解。表2为在7 d加速储藏实验条件下不同体系中花色苷的降解动力学参数计算结果。由表2的花色苷降解速率常数(K)和半衰期(t1/2)可知,添加CS组的K值均小于对照组,而在添加相同质量浓度的CS的情况下,CS+SA组比CS组的花色苷降解速率常数更小,半衰期更大。在CS质量浓度为5.00 mg/mL时,K减小了0.152 3d-1,t1/2提高了2.3倍,说明SA能够明显增强CS存在时对花色苷的保护效果。Zhao等[23]发现,迷迭香酸能够提高黄原胶对黑米花色苷的保护作用,且半衰期t1/2为8.20 d。与之相比,本研究中CS5+SA组有效提高了花色苷降解的半衰期(t1/2=10.468 d)。此外,通过计算花色苷颜色损失达90%时所需要的时间(D值)也能够评估CS或CS+SA组对黑米花色苷颜色稳定性的影响。表2中,空白组的D值为49.421 d,在添加抗坏血酸的情况下,CS5+SA组的D值最高(34.788 d),说明该质量浓度的CS+SA对花色苷颜色降解的延缓作用效果最好,与其他实验组相比能最大限度地减少花色苷的氧化降解。
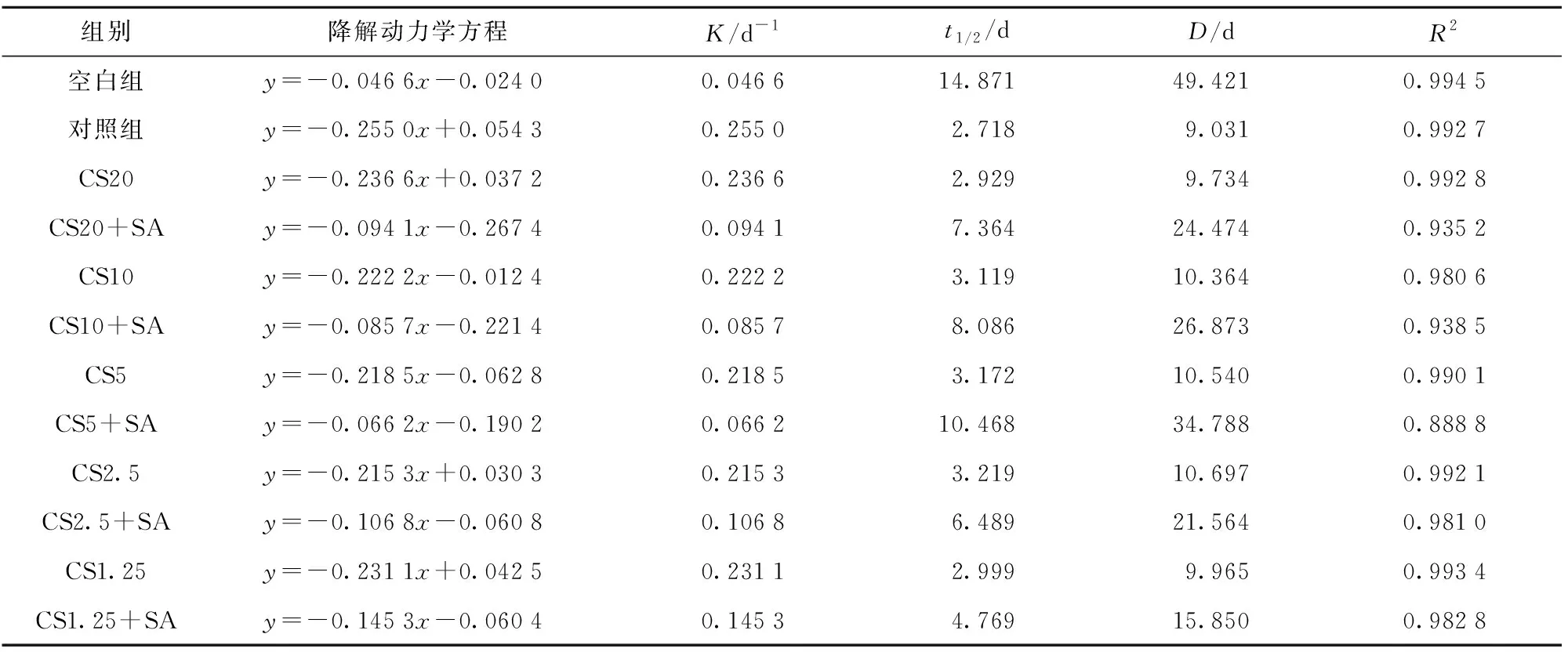
表2 花色苷在不同模型饮料体系中的降解动力学参数
2.3 SA对含CS的模型饮料中花色苷作用的分子动力学模拟分析
采用分子动力学模拟技术分析SA对CS存在时花色苷颜色的保护作用机制。以黑米花色苷的主要成分矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)为模型,计算机模拟CS、SA及花色苷的分子运动轨迹和产生的相互作用见图5。从图5(a)中花色苷的运动轨迹可知,当花色苷单独存在时,其自身会发生结合并聚集,氢键和芳香环上的π-π堆积是其分子间主要驱动力[图5(b)]。图5(c)显示,当CS存在时,会吸引花色苷分子靠近,并通过氢键与花色苷结合。与CS组相比,SA的存在促进更多数量的花色苷分子向CS靠近。图5(d)显示,游离的SA可与花色苷分子形成氢键和π-π堆积,而SA和花色苷均可与CS通过氢键结合。从花色苷的结合位点来看,游离SA促使了花色苷分子从两侧与CS结合,这也就解释了CS组与CS+SA组对花色苷颜色保护作用的差异。

图5 不同体系中分子运动轨迹及相互作用的分子动力学模拟Fig.5 Molecular dynamic simulation of molecular trajectories and interaction of different systems
不同体系的分子动力学相关参数分析结果见图6。图6(a)和图6(b)分别提取了CS和CS+SA存在时的两个花色苷体系的均方根差(root mean square deviation,RMSD)值和CS分子的RMSD值。RMSD值揭示了分子在模拟过程中构象与初始构象的位置变化。由图6(a)可见,随着模拟时间的延长,添加CS和CS+SA的两个花色苷体系RMSD值分别在5.8 nm和5.1 nm附近波动,说明所有体系中分子的位置不再发生剧烈变化,最终都达到了稳定的平衡状态[40]。对CS分子的RMSD值分析表明,CS和CS+SA体系中的CS分子均在0.35 nm附近小范围波动,表明两个体系的CS均具有比较稳定的分子结构[41]。溶剂可及性表面积(solvent accessible surface area,SASA)表示模拟过程中聚合物与溶剂相互作用的比值,以此预测结合过程中构象变化的程度,也常用于分析体系疏水作用的变化。由图6(c)可观察到,在整个模拟过程中,两个体系中CS的SASA值都能保持在 14 nm 附近的范围内,表明CS和CS+SA两个体系的结构都比较稳定。在模拟时间为35 ns处,当SA存在时CS的SASA值下降,说明该体系中疏水相互作用参与了CS与花色苷分子的结合[25]。

图6 分子动力学模拟下不同体系的RMSD、SASA及氢键相关参数分析Fig.6 Parameters of RMSD、SASA and hydrogen bonds analysis of different systems under molecular dynamic simulation
体系中氢键的数量也能够表明不同体系对花色苷的保护程度及差异。图6(d)和(e)分别表示CS与花色苷分子之间的平均氢键数量以及非溶剂的氢键数量。有研究认为,配体的结合亲和力会随着氢键数量的变化而变化[42],可以看出,CS+SA体系比CS体系与花色苷之间形成了更多氢键,尤其是非溶剂的平均氢键数量,即加入SA促进了CS与花色苷的结合,说明CS+SA体系的结构更为稳定[43]。
分析不同体系中能量的差异能够更好地解释花色苷的稳定性。范德华力和静电力是两种相互作用力,其数值可用来比较不同体系的相互作用强度,绝对值越大表示相互作用越强。各体系之间的相互作用的能量计算结果见表3。由表3可知,在对本研究中不同体系的能量表征中发现,花色苷与花色苷分子之间的能量并没有明显的差异,而CS+SA体系与花色苷分子之间的总能量(-2 442.67 kJ/mol)要低于单独的CS体系与花色苷分子之间的总能量(-2 157.74 kJ/mol),说明 CS+SA体系与花色苷的结合更加稳定。进一步对表3中CS+SA体系中不同分子间的相互作用力进行分析,结果显示,CS与花色苷之间主要产生的是范德华力,而SA与花色苷之间则是由库仑相互作用主导的。
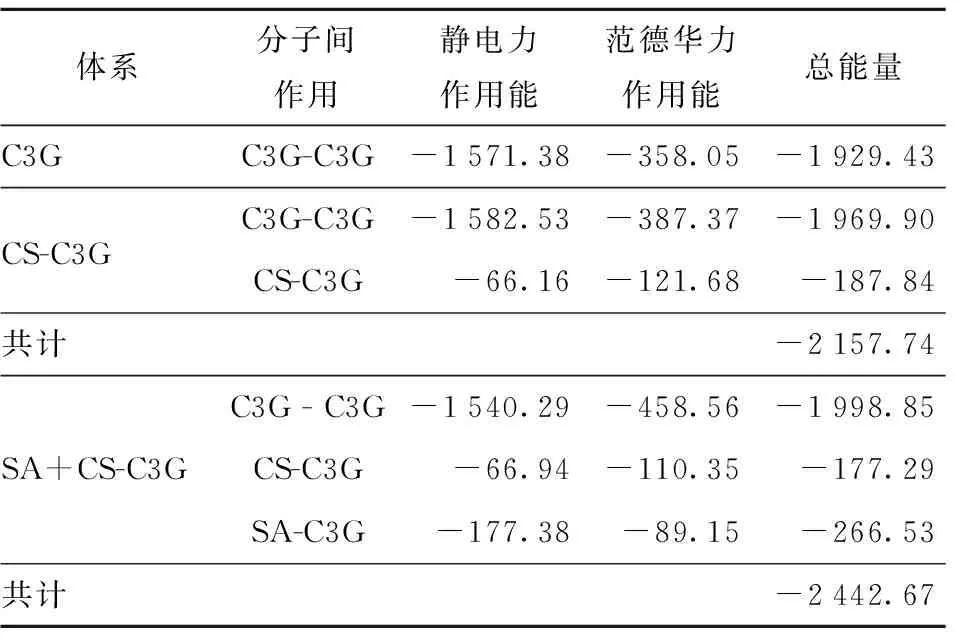
表3 不同体系在分子动力学中的相互作用能量分析
分子动力学模拟验证了加速储藏实验中的结果,即与单一的CS体系相比,CS+SA体系可以与花色苷有更强、更稳定的相互作用,SA能有效延缓CS存在时花色苷的降解速度。
3 结 论
本研究通过加速储藏实验研究了CS和CS+SA体系对花色苷颜色和含量的稳定性影响,并利用分子动力学模拟对其作用机制进行了分析。结果表明,与以往研究采用单一的CS体系相比,SA的加入对含CS的模型饮料中抗坏血酸造成的花色苷降解起到了改善作用,减少了储藏过程中花色苷颜色的变化和含量的下降,可使花色苷的保留率最高达36.52%,并使花色苷的降解速率常数显著降低,半衰期明显提高。分子动力学模拟显示,游离的SA可与花色苷分子形成氢键和π-π堆积,促使花色苷分子靠近CS+SA复合物,产生较为稳定的结构,复合物和花色苷分子之间相互作用产生的总能量可达-2 442.67 kJ/mol。SA与CS联用能有效地提高花色苷的稳定性,显著减轻花色苷因受到抗坏血酸自氧化作用而降解的程度。壳聚糖目前未被列入国标规定的饮料类食品添加剂中,本研究仅是对提高花色苷模型饮料稳定性的一种探讨。在本研究的基础上,结合实际,选择国标推荐的食品添加剂,将酚酸、多糖联用的辅色机理运用于花色苷模型饮料中还有待深入研究。

