羊源性基因组DNA标准物质研制
纪艺,王凯莉,余卉茹,赵新,丁霖,彭城,徐俊锋,陈笑芸
1.浙江省农业科学院,农产品质量安全危害因子与风险防控国家重点实验室,农业农村部农业转基因生物溯源重点实验室,杭州 310021;2.宁波大学食品与药学学院,浙江 宁波 215211;3.湘湖实验室,杭州 311231;4.天津市农业科学院,种质资源与生物技术研究所,天津 300384
肉制品是人类膳食结构的重要组成部分,是优质蛋白和优质脂肪的重要来源,也是人体微量营养素和矿物质主要摄取渠道之一[1]。然而,伴随着日益增长的生产量和消费量,肉制品成为食品生产、加工、流通及餐饮领域中造假掺假的主要目标。一些不法企业和商贩用低价肉或非肉成分冒充高价肉,掺杂在牛肉、羊肉等高价肉制品中,这些造假掺假的欺诈违法行为存在着巨大的公共卫生健康安全风险,严重侵犯了消费者权益[2-4],因此应该广泛关注肉制品安全问题[5]。对于肉类掺假,传统的检测主要依赖于解剖学、组织学、感官判断[6-7]、酶联免疫吸附法[8]、色谱法[9]等方法,但是这些方法的准确性和灵敏性存在局限性。而基于物种基因组DNA的聚合酶链式反应(polymerase chain reaction,PCR)在动物源性成分检测中有明显优势。目前主流的分子检测技术主要有凝胶PCR[10]、实时荧光定量PCR[11]、数字PCR[12]、等温核酸扩增[13-15]和其他PCR技术[16-17]。国内外羊源性物质的检测有标准化检测方法(国家标准、行业标准和地方标准)和快速检测方法,但是,要保障这些检测结果的准确性与一致性需要标准物质作为衡量标准。目前,我国羊源性有证标准物质还处于空白状态,因此,羊源性有证标准物质的研制刻不容缓。
根据JJF1001—2011《通用计量术语及定义》[18]的定义,标准物质是具有足够均匀和稳定的特定特性的物质,适用于测量或标称特性检查中的预期用途,使检测结果具有可靠性、可比性和可追溯性[19-20]。目前已经开发了几种基于DNA的标准物质,用于转基因生物[20-22]、癌症诊断[23-25]、食源性病原体[26]和法医学[27]检测。
但现阶段,国内外肉类标准物质的缺乏已经严重影响了肉类及肉制品检测技术的标准化和已有标准的采用。为确保肉类中羊源性成分监测质量控制的准确性和一致性,以及保障消费者的知情权,亟需建立羊源性成分的检测标准和研制羊源性国家有证标准物质[28],从而实现各实验室间数据可比和量值统一,为研制分子诊断即时检测(point of care testing,POCT)技术提供计量溯源[18],进而为我国肉类及肉制品的检测和安全评价提供技术、信息和标准物质服务,为构筑生物安全防线提供重要的质量基础。
1 材料与方法
1.1 实验材料
实验用羊肉来源于浙江省农业科学院畜牧兽医研究所十月龄湖羊(Ovis aries)羊腿肉,ddPCR Master Mix 购自伯乐公司(货号186-3010)。
1.2 实验方法
1.2.1 DNA 提取与检测 用手术刀切取羊腿肉(≤2.5 g),根据杭州新景生物提取试剂盒说明书进行基因组DNA 提取,用1%的琼脂糖凝胶电泳检测其质量。同时采用紫外吸收法(NanodropTM 2000,Thermo Fisher,DE,USA)和Qubit 2.0 检测基因组DNA的浓度和纯度。
1.2.2 数字PCR 方法 目的基因序列位于绵羊1号染色体(62334224-62334300)HELZ基因的1 个内含子上,用于特异性检测的引物和探针为:F:5′-AGGTTGCGCCATGCTGTAG-3′;R:5′-CAGGACTTCTAATTTCGCCAGTAAC-3′;P:5′-FAMAGGAGGAATCCCCATCATCACGGCC-BHQ1-3′。
优化后HELZ基因的微滴数字PCR 体系为(20 μL):2× ddPCR Master Mix 10 μL,1.0 μmol·L-1正反向引物各2 μL,1.0 μmol·L-1探针1 μL,DNA模板2 μL。微滴式数字PCR 反应程序如下:95 ℃预变性10 min;94 ℃变性30 s,60 ℃延伸1 min,40个循环;98 ℃酶灭活10 min,4 ℃保存,温度速率2 ℃·s-1。使用软件QuantaSoft Version 1.7.4分析实验数据,获得绝对定量结果。
1.2.3 标准物质制备和均匀性初检 将提取的羊源性基因组DNA 标准物质分别稀释10 倍和100倍,配置成高、低2个浓度,并在4 ℃环境下缓慢混匀24 h 后检测HELZ拷贝数是否均匀。选择标椎物质储存管的上、中、下不同的部位取样,每个部位各取2份样品(分别标记为1-1、2-1、3-1、4-1、5-1、6-1),采用数字PCR 进行均匀性结果检验,对均匀性初检结果进行单因素方差分析判断标准物质的均匀性。
1.2.4 均匀性评估 对分装完毕的200瓶样品随机选取12 管,每管取样3 次,每次取样2 μL,共36份样品。采用数字PCR 方法分别对两种羊源性HELZ基因DNA 标准物质进行均匀性评估。对检测数据及两种标准物质(高、低浓度)的拷贝数进行单因素方差分析,计算统计量F值,评估标准物质的均匀性。
1.2.5 稳定性评估 稳定性是标准物质的一个重要参数。稳定性评估包括短期稳定性(运输稳定性)、长期稳定性和冻融稳定性。短期稳定性检验设置4 ℃和25 ℃两个温度,每个温度分别放置0、3、7、14 d。每个温度和时间处理随机抽取3管,每管重复取样3 次(N=3,n=3)。长期稳定性检验在-20 ℃下分别放置0、1、2、4、6 个月。每个温度和时间处理随机抽取3 管,每管重复取样3 次(N=3,n=3)。冻融稳定性检验是随机抽取3 管-20 ℃储存的两种标准物质反复冻融10 次并取样标记在重复条件下对提取的基因组DNA 进行检验。短期稳定性、长期稳定性、冻融稳定性均采用数字PCR方法进行检测,并依据《标准物质的定值及均匀性、稳定性评估》(JJF 1343—2022)[18]进行评估。对短期稳定性和长期稳定性检验数据绘制特性值随时间变化曲线的线性模型(Y=β0+β1X),根据斜率是否显著,判断特性值在储存期内是否稳定。对冻融稳定性检验数据进行t检验。
1.2.6 标准物质联合定值 9家实验室采用数字PCR对标准物质特性量值进行合作定值,每个实验室分发每个浓度的标准物质2管,每管标准物质重复检测4次。检测完成后,将数据反馈给组织方汇总。依据《标准物质的定值及均匀性、稳定性评估》(JJF 1343—2022),对联合定值数据先后进行实验室内异常值检验数据正态分布和等精度检验。
1.2.7 数据处理及不确定度评估 依据《标准物质的定值及均匀性、稳定性评估》(JJF 1343—2022)[29],分别评定均匀性相对不确定度(urel,bb)、短期稳定性相对不确定度(urel,ss)、长期稳定性相对不确定度(urel,ls)和定值相对不确定度(urel,c)。4个不确定度分别按公式计算出相对不确定度urel,CRM。
在95%置信度下,取包含因子k=2,计算标准值的相对扩展不确定度UCRM,Y表示标准值。
2 结果与分析
2.1 基因组DNA的鉴定与评价
提取的DNA 用1%琼脂糖凝胶电泳检测,120 V 电泳20 min 后在凝胶成像分析系统拍照留存(图1)。结果显示,本批提取的基因组DNA 条带单一、明亮、无弥散现象,质量符合要求。采用NanoDrop 和Qubit 进行纯度和浓度的测定,其纯度OD260/OD280置值为1.82,A260/A230为2.04,浓度为135 ng·μL-1,证明DNA 标准物质纯度满足制备要求。

图1 羊源性DNA电泳检测图Fig.1 Electrophoretic detection of sheep DNA
2.2 均匀性初检与分装
采用数字PCR 进行均匀性结果检验,计算统计F值。检测分析结果如表1所示,由于F<F0.05(5,12),因此HELZ基因的拷贝数无统计学差异,表明溶液已混合均匀,最终作为羊源性基因组DNA 标准物质候选物,每种标准物质分装200管,每管100 μL。为保证DNA不被降解,分装完成后,将分装的DNA置于100格冷冻冰盒中,-20 ℃冰箱保存。

表1 均匀性初检统计分析结果Table 1 Results of statistical analysis of the uniformity
2.3 均匀性评估
对分装完毕的200 管样品随机选取12 管,每管取样3次,每次取样2 μL。采用数字PCR方法对提取样品中的拷贝数进行定量检测。对检测数据进行F检验,计算两种标准物质统计量F值。均匀性评估中两种羊源性HELZ基因DNA 标准物质分析结果见表2。由于F<F0.05(11,24),表明羊源性HELZ基因DNA 标准物质(高浓度)以及羊源性HELZ基因DNA标准物质(低浓度)均匀性良好。

表2 均匀性统计分析结果Table 2 Uniformity statistical analysis results
2.4 稳定性评估
短期稳定性测试旨在考察标准物质的运输稳定性,在运输过程中不能排除高温的情况,因此将样品分别存储在4、25 ℃,储存0、3、7、14 d。2 种羊源性HELZ基因DNA 标准物质拷贝数的短期稳定性结果见表3,趋势图见图2。检测其标准物质HELZ拷贝数在4 ℃和25 ℃随着储存时间变化曲线(Y=β0+β1X)的斜率β1以及β1的标准偏差S(β1),并对S(β1)进行t检验。结果显示,由于│β1│<t0.95,3×S(β1),回归曲线斜率不显著。结果表明两种标准物质在4 ℃和25 ℃至少能够稳定保存14 d。

表3 短期稳定性评估结果Table 3 Short-term stability assessment results

图2 标准物质在4、25 ℃短期稳定性趋势图Fig.2 Short-term stability trend of reference material at 4 and 25 ℃
长期稳定性考察是将样品置于-20 ℃,分别放置0、1、2、4、6 个月后,检测样品在较低储存温度、长时间保存的稳定情况。两种标准物质长期稳定性统计分析结果见表4,趋势图见图3。通过检测其HELZ基因拷贝数随储存时间的曲线变化,对S(β1)进行t检验,│β1│<t0.95,2×S(β1)说明斜率不显著。以上结果表明样品在-20 ℃储存6 个月后,基因拷贝数未发生显著变化,因此两种标准物质在-20 ℃至少可稳定保存6个月。

表4 -20 ℃长期稳定性评估结果Table 4 Evaluation results of long-term stability at -20 ℃

图3 标准物质-20 ℃长期稳定性趋势图Fig.3 Long-term stability trend of reference material at -20 ℃
反复冻融可能会对标准物质稳定性造成影响。本研究对该批标准物质进行10 次反复冻融,检验2~10 次冻融样品的拷贝数与第一次拷贝数的一致性,并进行t检验,两种标准物质反复冻融稳定性统计分析结果见表5。统计结果显示tβ1<t0.95,8,两种羊源性HELZ基因DNA 标准物质在反复冻融10 次后,使用过程中拷贝数无明显上升或下降趋势,且变化范围均在特性量值及其不确定度范围内。因此,两种羊源性HELZ基因DNA标准物质在反复冻融10次后仍然是稳定的。

表5 冻融稳定性评估结果Table 5 Evaluation results of freeze-thaw stability
2.5 联合定值结果
本研究组织9 家实验室按照统一的定值程序在规定时间进行标准物质联合定值。用狄克逊法和格拉布斯法分别检验9 家实验室两个浓度标准物质的定值数据,未发现实验室内异常数据;用达戈斯提诺法对联合定值数据进行正态性分布检验,当置信概率为95%时,统计值Y均落在达戈斯提诺法检验临界区间,接收9 家实验室对两个浓度标准物质的联合定值数据为正态分布;用狄克逊准则对两个标准物质的9 家实验室定值数据平均值进行统计检验,未发现异常平均值;采用科克伦法检验两个标准物质的9 家实验室间定值数据平均值是否等精度,统计量C 值均小于临界值C(0.05,9,8),表明9家实验室定值数据平均值间为等精度。联合定值的数据实验室内和实验室间均无异常值,实验室间数据等精度,且定值数据呈正态分布,定值数据符合标准JJF 1343—2022 的要求。计算定值数据的总平均值,作为标准物质特性量值拷贝数的标准值,联合定值结果见表6。RSD值<25%,表明9家实验室间重复性较好。
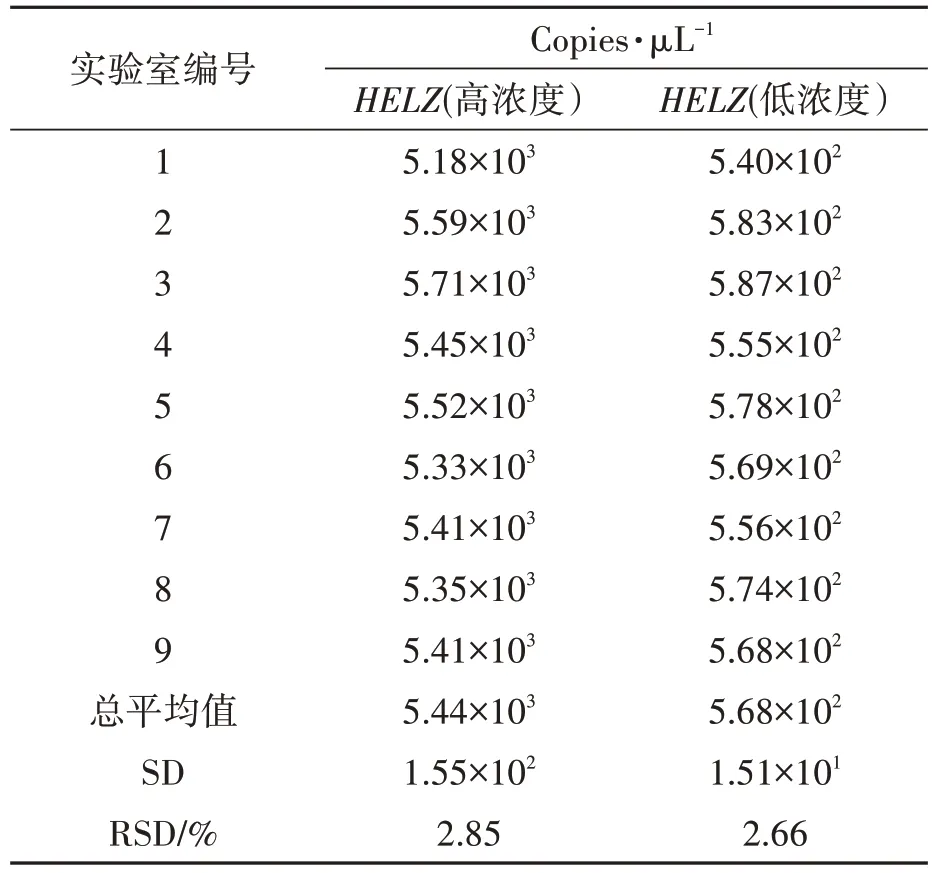
表6 9家实验室联合定值数据分析Table 6 Analysis of joint setting data from 9 laboratories
2.6 测量不确定度评定
标准物质的不确定度主要来源于均匀性引起的不确定度、稳定性引起的不确定度和定值过程带来的不确定度。根据标准物质的均匀性评估和稳定性评估数据,分别评定均匀性相对不确定度(urel,bb)、短期稳定性相对不确定度(urel,ss)、长期稳定性相对不确定度(urel,ls)。
标准物质定值过程带来的合成不确定度由两个部分组成,第一部分是通过测量数据的标准偏差、测量次数及所要求的置信水平按统计方法计算出A类不确定度。第二部分是通过对测量影响因素的分析,以非统计分析的方法评定出其大小的B类不确定度。
将均匀性相对不确定度(urel,bb)、短期稳定性相对不确定度(urel,ss)、长期稳定性相对不确定度(urel,ls)和定值相对不确定度(urel,c)4 个分量合成标准物质的相对不确定度(urel,CRM)。在95%置信度下,取包含因子k=2,计算两种标准物质标准值的扩展不确定度。两种标准物质的标准值及扩展不确定度见表7。

表7 不确定度评定结果Table 7 Uncertainty evaluation results
3 讨论
在本研究中,我们制备了羊源性DNA 标准物质,利用数字PCR 对其均匀性、稳定性及其不确定度进行评估。数字PCR 是一项较为成熟的PCR 扩增技术,不需要像荧光定量PCR 建立标准曲线即可实现绝对定量。数字PCR 广泛应用于转基因植物成分检测[30]、动物疫病检测[31]、病毒检测[32-33]等,并且通过多重通道进行扩增,得出最终绝对定量的结果,目前数字PCR 成本较高,实验时间较长,因此对于部分科研检测人员来说进行数字PCR 实验成为了难点[34]。但目前国产数字PCR 品牌数量及种类逐渐增多,降低了实验成本同时缩短了实验时间,使良好应用数字PCR 成为可能,为绝对定量检测提供了优质平台。
方差分析是用来统计检验均匀性、稳定性等最常用的方法,通过组间方差和组内方差的比较来判断各组测量值之间有无系统性差异。因此,本研究采用方差分析的方法进行定值。结果表明标准物质的均匀性和稳定性良好,标准物质在冷链运输条件下可稳定14 d,在-20 ℃条件下可以稳定保存6 个月以上。通过9 家实验室采用数字PCR 合作确定了HELZ基因拷贝数浓度。具体特性量值为:羊源性DNA标准物质(高浓度)HELZ基因标准值及扩展不 确定度为(5.44±0.45)×103copies·μL-1;羊源性DNA 标准物质(低浓度)HELZ基因标准值及扩展不确定度为(5.68±0.54)×102copies·μL-1。
基因组DNA 标准物质可直接用于实验研究,由于肉类基因组DNA 标准物质的缺失,市场监管部门缺少对于诸多检测方法的准确性和一致性的把控。因此,研制羊源性标准物质刻不容缓,本标准物质的研制可用于动物源性产品中羊源性成分的定性和定量检测、试剂盒质控、评价和实验室能力验证和质量控制等领域。

