NHP2调控肝癌细胞衰老机制的生物信息学分析
黄师,莫茵茵,罗绿景,刘会婷,陈峥宇,李根亮*
1.右江民族医学院,广西 百色 533000;2.右江民族医学院附属医院麻醉科,广西 百色 533000
原发性肝癌是我国常见的恶性肿瘤,发病率及致死率均位居前五位[1]。肝细胞癌(hepatocellular carcinoma,HCC)是其中占比最多的分型。肝细胞癌的发病机制复杂,危险因素多,起病隐匿,发展迅速且预后差,严重威胁着人类的健康。近年来,研究发现细胞衰老对癌细胞的生长代谢有一定影响,是致癌因素刺激后细胞作出的一种反应,与癌症的发生发展有紧密的关系。目前已发现细胞衰老与肝癌的发生发展具有相关性,通过抑制肝癌细胞衰老可以促进肝癌细胞的增殖[2],但其具体作用方式仍然不够明确。
核糖核蛋白NHP2 是端粒酶和小核仁核糖核蛋白(snoRNP)复合物的关键成分,属于端粒酶复合物的一部分,能维持染色体末端的稳定[3]。已有研究发现,NHP2 的下调后一定程度上可以抑制端粒酶逆转录酶的表达,从而破坏端粒酶复合物的稳定性[4]。NHP2 突变引起的端粒生物学障碍(telomere biology disorders,TBDs)被发现与细胞衰老、癌症具有关联[5],这在胃癌、肺癌中也有相关报道[5-6],但是在肝癌中的研究比较少见。本研究通过生物信息学分析NHP2 的靶向miRNAs 和lncRNAs,以期探究细胞衰老相关基因NHP2在HCC中的表达及可能的调控机制。
1 材料与方法
1.1 细胞衰老相关基因和肝癌差异表达基因的获取
在Quick Go 数据库(https://www.ebi.ac.uk/QuickGO/)中进行基因检索,检索结果“taxon”选项卡内选择“Homo sapiens”,点击“apply”。共得99 个与细胞衰老生物学过程相关的基因。打开GEPIA2 在线数据库(http://gepia2.cancer-pku.cn/#index)左侧“Expression Analysis”,在下拉菜单中选择“Differential genes”,“Dataset”中选择“LIHC”,设定“Chromosomal Distribution”为both。下载获取肝细胞癌的差异表达基因。将两者进行韦恩图分析(https://bioinformatics.psb.ugent.be/webtools/Venn/),找出共表达基因。
1.2 目的基因的获取和泛癌分析
将共表达基因放入STRING 在线数据库(https://cn.string-db.org/)进行蛋白互作,找出共表达基因相关的互作蛋白,使用TIMER 2.0(http://timer.cistrome.org/)、UALCAN 数据库(https://ualcan.path.uab.edu/index.html)分析共表达基因在泛癌中的差异表达及肝癌和其他泛癌病理进展过程中的表达,预测其在肝癌中的预后生存关系。
1.3 共表达基因的互作蛋白及功能分析
将共表达基因放入互作蛋白在线分析数据库STRING,检索共表达基因及其编码蛋白的互作蛋白。将共表达基因及相关基因放入DAVID 数据库(https://david.ncifcrf.gov/)进行功能分析。
1.4 共表达基因的ceRNA调控网络分析
将共表达基因放入miRNet 数据库(https://www.mirnet.ca/miRNet/home.xhtml)的“Genes”板块,物种选择为“H.sapiens(human)”,ID 类型选择“official gene symbol”,目标类型为“miRNA”,在列表中输入共表达基因后发送,得到其靶向miRNAs。将其靶向的miRNAs 在该数据库中继续查找其靶向lncRNA。将得到的基因放入Cytescape v3.8.0 软件(https://cytoscape.org/download.html)中制作ceRNA靶向图。
2 结果与分析
2.1 19 个差异表达基因参与了肝癌细胞衰老的生物学过程
在Quick Go数据库中下载的与细胞衰老相关的生物学过程相关基因113 个。在GEPIA 2 在线数据库下载的肝癌差异表达基因2 206 个。将两者进行共表达分析发现,共有包括NHP2在内的19 个差异表达基因参与了肝癌细胞衰老的生物学过程(图1),表明这19 个细胞衰老相关基因参与了肝癌的发生发展。

图1 Quick Go细胞衰老基因与GEPIA 2 HCC差异表达基因的韦恩图Fig.1 Venn diagram of cell senescence gene in Quick Go base and DEGs in GEPIIA 2 of HCC
2.2 NHP2在泛癌中的表达
经在线数据库TIMER 2.0 分析发现,NHP2基因在多种癌症中显著高表达。总结TCGA 临床病例数据,与UALCAN 共同分析发现,NHP2 在肝癌人群及其他多个肿瘤中高表达,一定程度上表明NHP2 参与了肿瘤的发生与发展,可能是肿瘤潜在的治疗靶点(图2~3)。
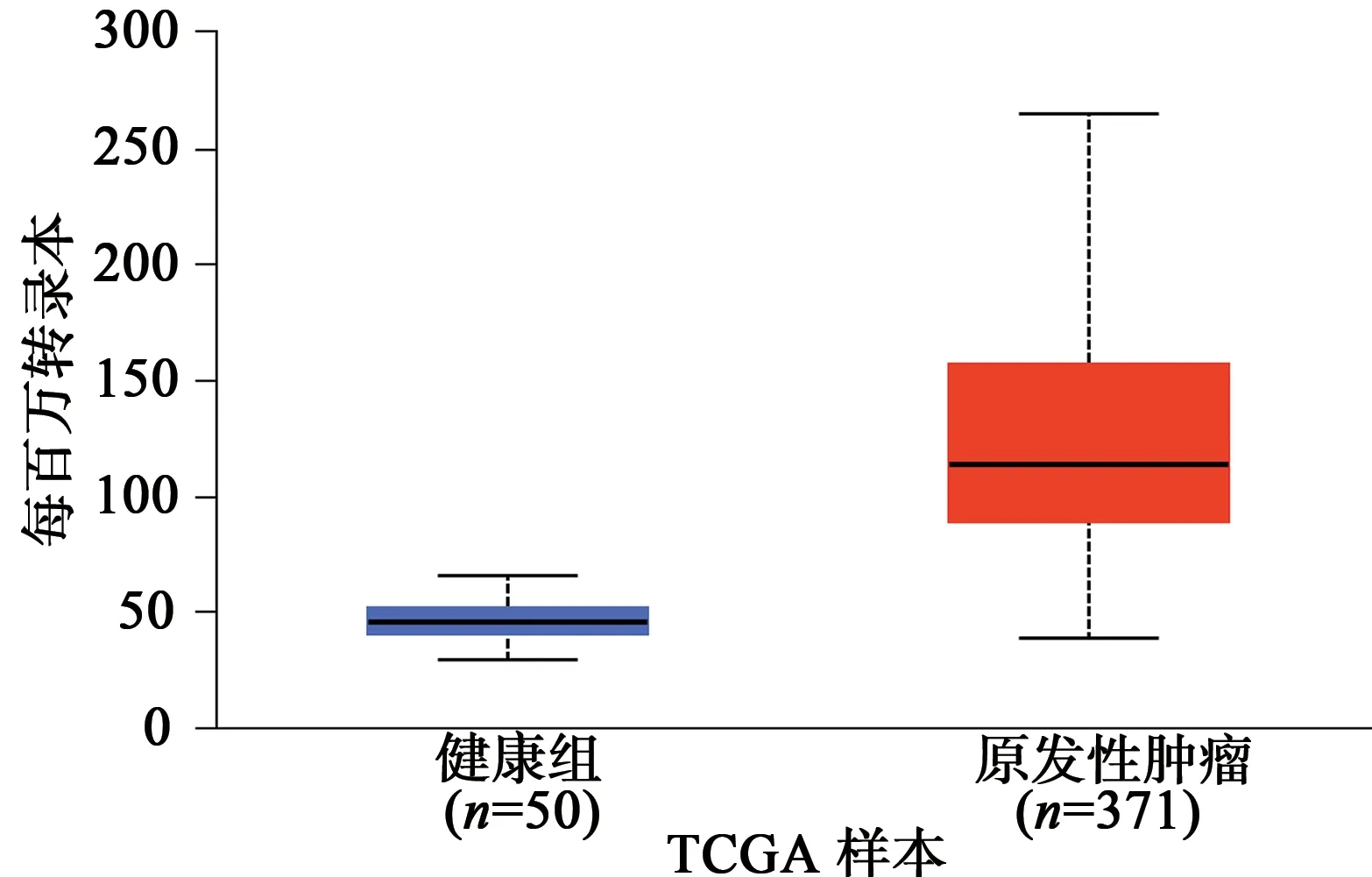
图2 UALCAN数据库中NHP2在HCC中的表达情况Fig.2 The expression of NHP2 in HCC in UALCAN database
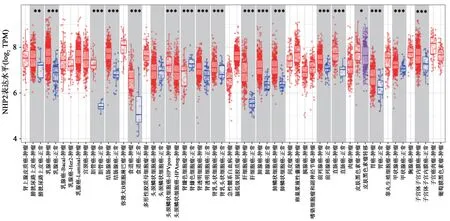
图3 TIMER 2.0数据库中NHP2在多种肿瘤中的表达情况Fig.3 Expression of NHP2 in a variety of tumors in TIMER 2.0 database
2.3 NHP2基因的互作蛋白及功能分析
NHP2基因编码的互作蛋白有10 个,分别是DKC1、FBL、GAR1、NAF1、NHP2L1、NOP10、NOP56、NOP58、RUVBL1、TERT(图4)。将其相关基因放入DAVID 数据库进行功能富集分析发现,这些基因主要参与了1 个KEGG 信号通路,即真核生物核糖体发生的信号通路,6 个分子功能(MF),如端粒酶RNA 结合、端粒酶活性、H/ACA SnoRNA 结合及ATP 酶结合等,11 个细胞组分(CC),如核蛋白复合物、端粒酶全酶复合物、小核仁和蛋白复合物及染色体端粒区等,7 个生物学过程(BP),如核糖体生物发生、端粒中端粒酶的维持、端粒酶RNA 的稳定及对端粒酶活性的正向调节等(图5)。
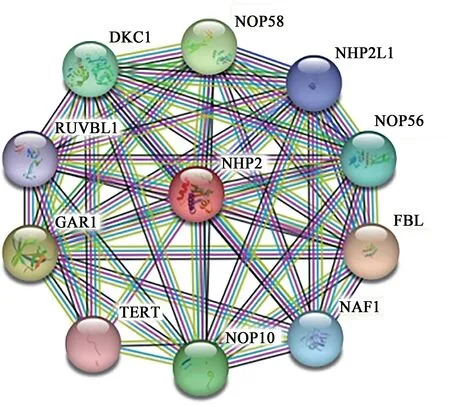
图4 NHP2的互作蛋白Fig.4 The PPI of NHP2
2.4 NHP2与肝癌疾病进展的分析
经UALCAN 数据库分析,NHP2 在HCC 中的表达具有明确的意义。随着HCC 的进展加重,NHP2 表达水平越高,与其发病年龄、疾病分期具有显著的相关性(图6)。GEPIA 2 数据库分析也得出相似的结论。如图7、8 所示,经预后生存曲线分析发现,NHP2 高表达组在肝癌的预后较差,差异具有统计学意义(P<0.05)。故NHP2 在包括HCC 的多种肿瘤的临床疾病进展中具有一定关联,对HCC 的治疗和预后分析具有一定的参考价值。
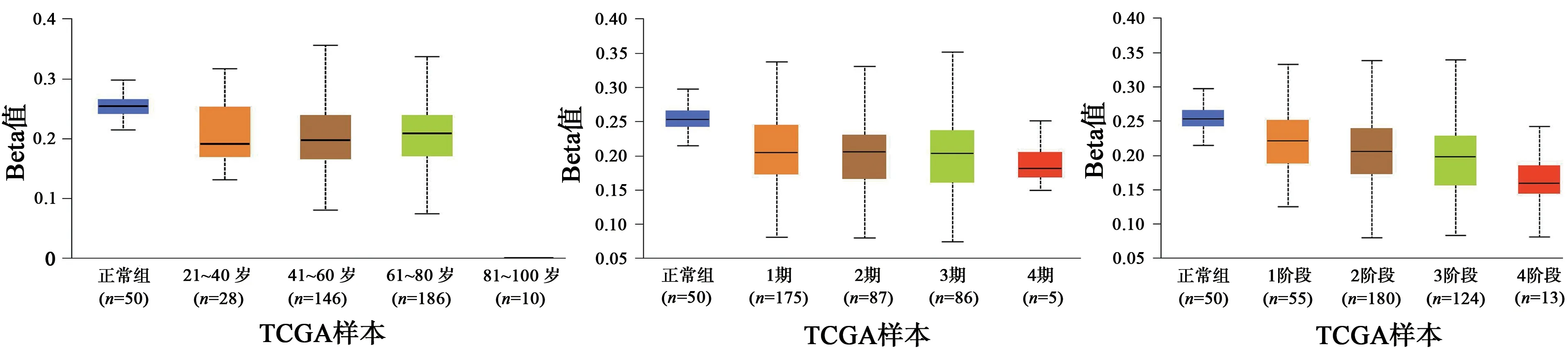
图6 NHP2在HCC不同状态的对比结果Fig.6 Comparison of NHP2 in different states of HCC
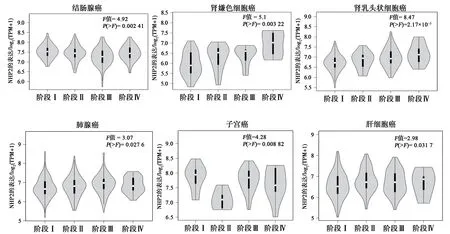
图7 NHP2在泛癌的疾病分期对比结果Fig.7 Comparison of NHP2 in disease staging in pancarcinoma
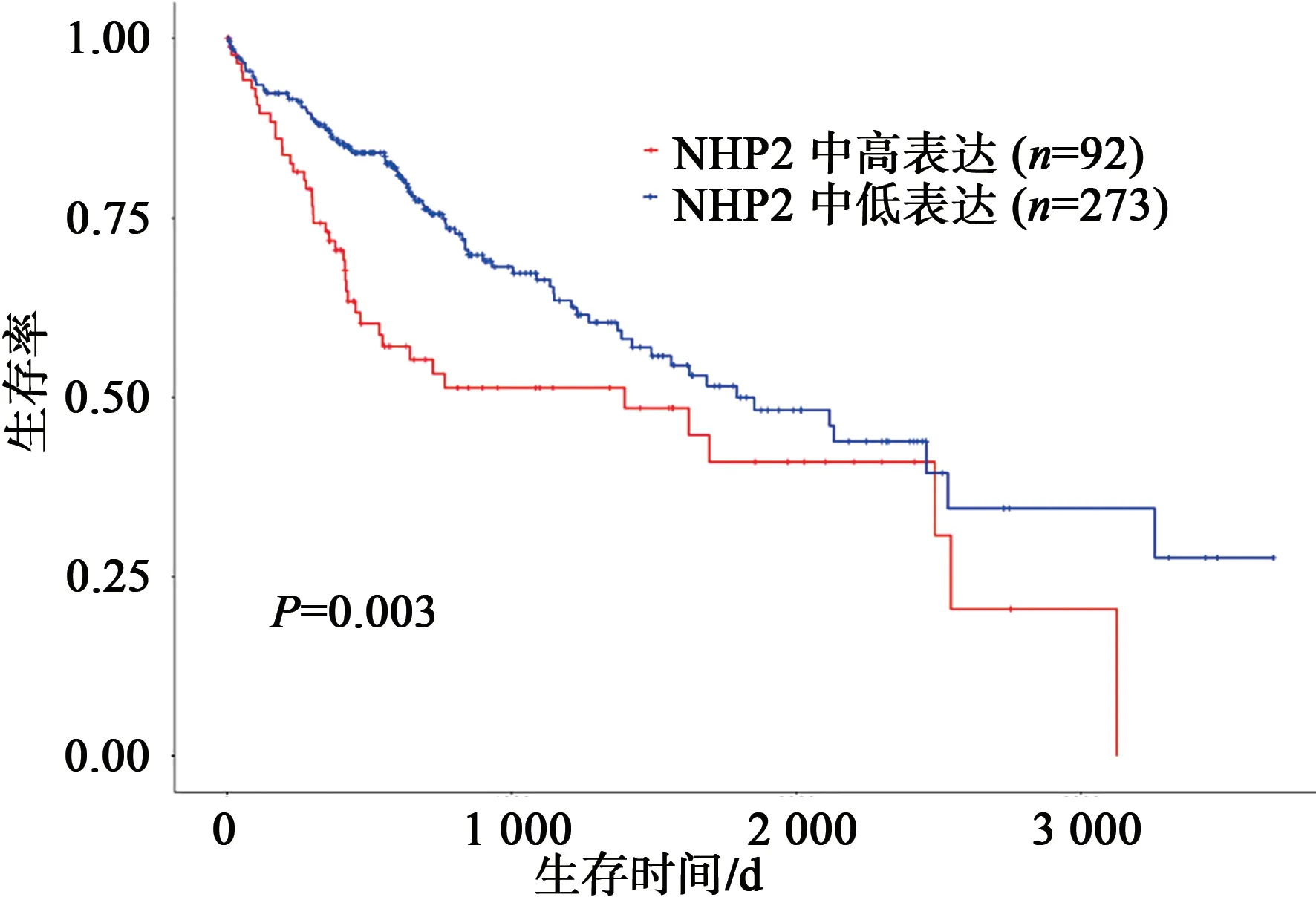
图8 NHP2在HCC中的预后生存分析Fig.8 Prognostic survival analysis of NHP2 in HCC
2.5 NHP2基因ceRNA调控网络图
将NHP2 放入miRNet 数据进行靶向RNA 分析,得出其靶向miRNAs 有2 个:hsa-miR-1-3p 和hsa-miR-124-3p,其靶向的lncRNAs 有57 个。将其靶向关系放入Cytoscape 软件进行网络分析,得出NHP2 调控网络图(图9)。NHP2 在HCC 中可能通过lncRNAs/miR-1-3p/NHP2 或lncRNAs/miR-124-3p/NHP2调控轴进行调节。
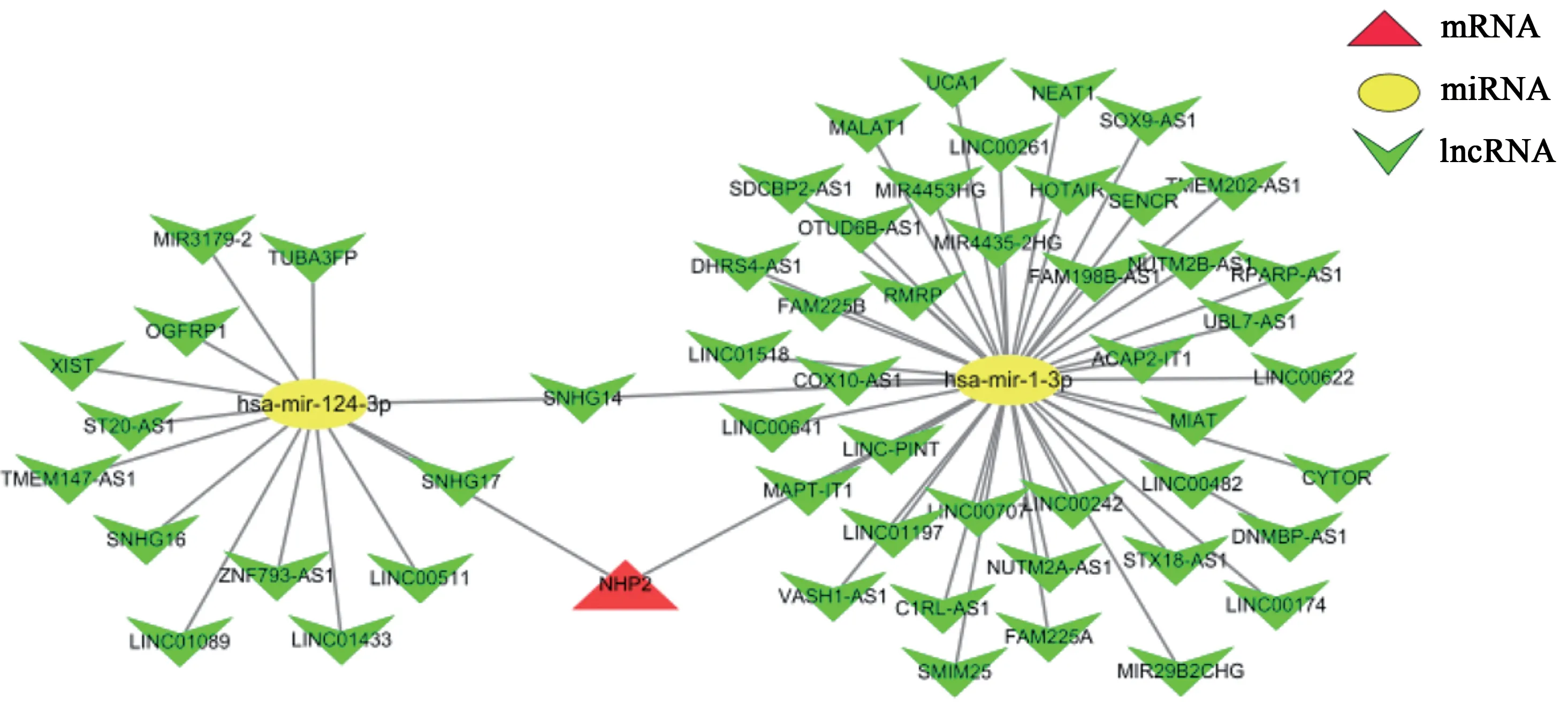
图9 NHP2的ceRNA调控网络图Fig.9 CeRNA regulatory network diagram of NHP2
3 讨论
目前,原发性肝癌的全球发病数已超过90 万例[7],HCC 是其中最常见的类型。HCC 发病通常与生活环境、饮食、遗传、炎症刺激等因素相关[8],治疗方式包括手术切除、免疫治疗、肝移植、介入治疗等[9]。总的来说,肝癌起病隐匿,进展迅速,容易复发和耐药,预后差[2]。细胞衰老是抑制肿瘤生长的潜在机制,有望为肿瘤的进展提供一种治疗机制。
NHP2 是H/ACA snoRNP(小核仁核糖核蛋白)基因家族的成员,是端粒酶复合物的一部分,能够调节核仁和核浆内端粒酶和维持端粒稳定[3]。端粒是位于染色体末端的核蛋白结构。在细胞衰老相关研究中发现,端粒酶的激活可以维持端粒的稳定,当细胞分裂至Hayflick 界限时,进入细胞衰老或凋亡[10]。目前已有研究显示,端粒酶能够促使肝细胞癌无限增殖[11]。通过敲低NHP2 抑制端粒酶逆转录酶(telomerase reverse transcriptase,TERT)表达和破坏端粒酶复合物的稳定性可以抑制HBx 诱导的肝癌发生[4,12]。TERT 是端粒酶的一种催化亚基,由包括NHP2 在内的多种蛋白构成。TERT 对端粒酶的活性具有决定性作用,目前有多项研究发现,TERT 启动子突变与肝细胞癌的遗传突变具有重要关联[13-14]。研究还发现,端粒酶在正常细胞内并不活跃,而在分化能力强的癌细胞内却很活跃[15-17]。有研究证实,敲低NHP2 的表达对乙肝相关性肝癌的增殖、端粒酶活性具有抑制作用,能促进该类肝癌细胞的凋亡,分析试验结果认为可能是通过干扰TERT 的表达来影响细胞的增殖[12]。也有试验证实,原发肿瘤细胞内的端粒酶活性提高,并且端粒的长度与TERT 的转录具有相关性[18]。以上结果表明,NHP2 在肝癌细胞衰老机制中发挥重要的作用。
目前,NHP2的具体调控机制尚未阐明。ceRNA 网络认为NHP2 可以调控肿瘤的增殖和凋亡[19-20]。经过在线数据库miRNet分析发现,NHP2与miR-1-3p、miR-124-3p之间存在靶向关系,并与lnc00242等57个lncRNAs之间形成调控轴。国内学者在对胃癌的研究中发现,lnc00242 竞争性地联合miR-1-3p后可调节mRNA 的表达,进而影响胃癌的增殖。lncRNA 可能通过调控miR-124-3p对膀胱癌产生生物学影响,该miRNA 在食管癌、宫颈癌、肝癌、胃癌中的研究中也得出了类似的结论[21-25]。有研究显示,linc00174、lncR CYTOR 可以调控肝癌的增殖活性[26-27],本研究结果分析提示该lncRNA是调控通路上的一部分,所以我们推测HCC 可能通过lncRNAs/miR-1-3p/NHP2 或lncRNAs/miR-124-3p/NHP2 调控轴调节其增殖或凋亡过程。
生物信息学技术分析发现,NHP2属于细胞衰老相关基因,亦属于HCC 的差异表达基因。通过TIMER 2.0和TCGA 数据库的临床数据分析发现,NHP2在包括肝癌的多种癌症中高表达,间接证明了在肿瘤中端粒酶活性的提高。对NHP2基因进行功能富集分析发现,其参与了真核生物核糖体形成的KEGG,主要参与的CC 有核糖核蛋白复合物,主要MF如端粒酶RNA的形成,参与的BP如核糖体的形成和通过端粒酶维持端粒的稳定性等。经UALCAN和GEPIA 2数据库分析,利用TCGA病例研究显示,NHP2的表达与包括HCC在内的多种癌症分期具有统计学差异,NHP2可能成为HCC潜在的治疗方法和预后指标。
综上所述,NHP2 作为H/ACA snoRNP 基因家族的一员,在HCC中的表达高于正常组织,且与肿瘤患者的年龄、分期等状态紧密联系。数据库分析显示,NHP2高表达与患者预后不佳相关,NHP2高表达的HCC患者预后更差。对其进行功能富集分析发现,NHP2与多个蛋白互作,联系紧密,还参与多个CC、BP 及MF。在对于HCC 的端粒维持和细胞衰老过程中,可能通过lncRNAs/miR-1-3p/NHP2 或lncRNAs/miR-124-3p/NHP2 调控轴进行调节。故NHP2可能参与了HCC的发展和疾病进展,有望作为HCC的治疗靶点和预测因子。

