香蕉枯萎和细菌性软腐病菌的多重PCR检测
蒲小明 张景欣 沈会芳 孙大元 刘平平 林壁润 杨祁云








摘要
香蕉枯萎病菌Fusarium oxysporum f.sp. cubense和細菌性软腐病菌Dickeya zeae的复合侵染为害给香蕉产业发展带来严重挑战,有必要建立相关病害的多重聚合酶链式反应(multiplex polymerase chain reaction,multiplex PCR)检测技术。本文基于尖孢镰刀菌古巴专化型1号生理小种(F.oxysporum f.sp. cubense race 1,FOC1)基因组contig 438区间(35 631-37 693 bp)(GenBank: AMGP01000438.1)和4号生理小种(F.oxysporum f.sp. cubense race 4,FOC4)基因组contig 195区间(4 028-6 126 bp)(GenBank: AMGQ01000195.1)存在160 bp插入序列差异设计特异扩增引物FOCF/R,同时以香蕉细菌性软腐病菌D.zeae的促旋酶B 亚单位基因(the subunit B of gyrase gene)(GenBank: JQ284039)序列设计特异扩增引物gyrBF/R。多重PCR检测结果显示:本技术可在一次PCR扩增反应内同时检测香蕉枯萎病菌1号、4号生理小种和细菌性软腐病菌; 多重PCR的灵敏度结果表明:检测香蕉枯萎病菌的DNA浓度最低限为0.1 ng/μL,细菌性软腐病菌的灵敏度为103cfu/mL;检测结果稳定可靠。因此,本研究建立的多重PCR检测方法可有效应用于检测香蕉发病组织中的香蕉枯萎病菌和细菌性软腐病菌,也可用于香蕉种苗和田间土壤带病菌的监测,为香蕉种植保驾护航。
关键词
香蕉; 尖孢镰刀菌古巴专化型1号生理小种; 尖孢镰刀菌古巴专化型4号生理小种; 玉米迪基氏菌;多重PCR; 促旋酶B 亚单位基因
中图分类号:
S 436.681
文献标识码: A
DOI: 10.16688/j.zwbh.2022799
Detection of banana Fusarium wilt and bacterial soft rot by multiplex PCR amplification
PU Xiaoming, ZHANG Jingxin, SHEN Huifang, SUN Dayuan, LIU Pingping, LIN Birun, YANG Qiyun*
(Institute of Plant Protection, Guangdong Academy of Agricultural Sciences, Key Laboratory of Green Prevention and
Control on Fruits and Vegetables in South China, Ministry of Agriculture and Rural Affairs, Guangdong Provincial
Key Laboratory of High Technology for Plant Protection, Guangzhou 510640, China)
Abstract
The diseases caused by Fusarium oxysporum f.sp. cubense and Dickeya zeae have brought serious challenges to the development of banana industry, and it is necessary to develop a detection method by multiplex polymerase chain reaction (multiplex PCR) technology for them. The specific amplification primers for the molecular multiplex PCR system were designed as followed: FOCF/R targeted the sequences of the contig 438 (35 631-37 693 bp) (GenBank: AMGP01000438.1) in the DNA of F.oxysporum f.sp. cubense race 1(FOC1) and the contig 195(4 028-6 126 bp) (GenBank: AMGQ01000195.1) in the DNA of F.oxysporum f.sp. cubense race 4 (FOC4), and there was a difference of 160 bp between FOC1 and FOC4. The primers gyrBF/R were designed based on the gene sequence (GenBank: JQ284039) in D.zeae. The results of multiplex PCR showed that this technology could simultaneously detect FOC1, FOC4 and D.zeae in one PCR amplification reaction. Moreover, the minimum limit of DNA concentration for detection of F.oxysporum f.sp. cubense was 0.1 ng/μL, and the sensitivity for detecting D.zeae was 103cfu/mL. The detection results were stable and reliable. Therefore, the multiplex PCR detection method can be effectively used to detect F.oxysporum f.sp. cubense and D.zeae in infected banana plant tissues, and can also be used to monitor banana seedling and soilborne pathogens in the field, which provides a useful tool for safe planting of banana.
Key words
banana; Fusarium oxysporum f.sp. cubense race 1; Fusarium oxysporum f.sp. cubense race 4; Dickeya zeae; multiplex PCR; gyrB gene
香蕉是我國热带地区重要的经济作物,在农业乡村振兴方面发挥重要作用。香蕉枯萎病在20世纪60-70年代在广东和广西已局部发生,王碧青等报道1985年-1987年采集的42个香蕉植株发病样本均分离出镰刀菌,形态特征鉴定确定其均为尖孢镰刀菌古巴专化型Fusarium oxysporum f.sp. cubense[1]。Zhang等首次报道在广州市番禺区细菌性软腐病发病香蕉植株中分离鉴定出病原菌为玉米迪基氏菌Dickeya zea[2],同时发现香蕉枯萎病菌和香蕉细菌性软腐病菌存在复合侵染现象。玉米迪基氏菌被证明是一种重要的病原细菌,侵染水稻[3]、菠萝[4]、玉米[5]、蕉芋 Canna edulis[6]、甘蔗[7]等多种植物引起软腐病害。香蕉枯萎病菌和细菌性软腐病菌都具有一定的潜伏期,常在生长半年以上的香蕉植株或在果穗期表现出明显发病症状,造成整株软腐枯死,导致香蕉严重减产甚至绝收。
建立有效的香蕉病害预警监测技术并及时进行防控,是控制和降低香蕉枯萎病和软腐病为害率的关键手段。这两种病害均为系统性侵染病害,一般从根部和虫伤口侵染为害,潜伏期间植株无发病症状,一般采用分子生物学方法检测病菌,如DNA 指纹图谱[8]、常规PCR[910]、实时荧光定量PCR[1112]、loopmediated isothermal amplification(LAMP)[1314]等。PCR是目前采用最普遍的病原菌鉴定方法,灵敏度高,可靠性强。目前国内外尚未有关于同时检测香蕉枯萎病和细菌性软腐病的多重PCR检测技术的报道。本文基于尖孢镰刀菌古巴专化型1号生理小种(F.oxysporum f.sp. cubense race 1,FOC1)基因组contig 438区间(35 631-37 693 bp)(GenBank: AMGP01000438.1)[15]和4号生理小种(F.oxysporum f.sp. cubense race 4,FOC4)基因组contig 195区间(4 028-6 126 bp)(GenBank: AMGQ01000195.1)[15]存在160 bp插入序列差异以及玉米迪基氏菌基因组[16]中的促旋酶B 亚单位基因(gyrB, GenBank: JQ284039)[17]等设计特异引物扩增特异基因片段,依据扩增片段大小区分病原菌种类,从而实现在一个PCR体系中同时检测香蕉病害的多个病原菌,提高检测效率,为香蕉病害预警预防提供技术支撑。
1 材料与方法
1.1 供试菌株
供试的尖孢镰刀菌Fusarium oxysporum不同专化型和迪基氏菌属Dickeya sp.不同种分离自不同寄主植物,其他属菌株为分离自发病植物或为常规试验菌株,具体见表1。
1.2 特异性引物设计
尖孢镰刀菌古巴专化型1号和4号生理小种基因组的种间存在插入序列大小差异,即F.oxysporum f.sp. cubense race 1(FOC1) contig438 (GenBank: AMGP01000438.1)[15]和 F.oxysporum f.sp. cubense race 4(FOC4) contig195 (GenBank: AMGQ01000195.1)[15]序列比较,FOC4比FOC1多160 bp左右的插入片段,在该片段两侧延伸序列设计合适引物,获得引物FOCF/R。
根据Dickeya zeae MS1的gyrB 基因序列(GenBank: JQ284039)[17],比较近似属细菌的gyrB 基因序列,在Dickeya保守序列区域设计通用引物,最终获得引物gyrBF/R。引物序列如表2所示。
1.3 真菌DNA提取
供试真菌菌株接种于PDA液体培养基中,26~28℃培养72 h,过滤取菌丝体,加液氮磨成粉末,采用CTAB法[18]提取真菌基因组DNA, -20℃保存备用。
1.4 多重PCR扩增
1.4.1 特异性分析
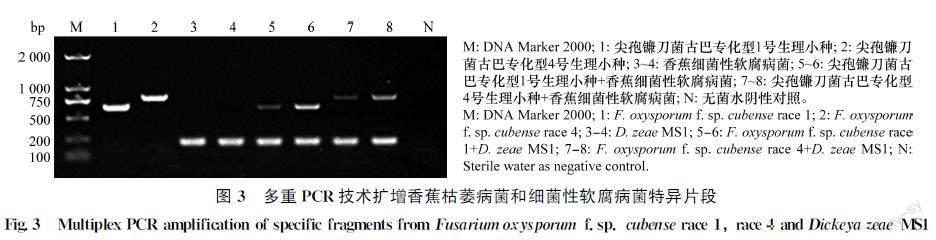
采用引物FOCF/R和gyrBF/R复合扩增不同供试真菌DNA和细菌菌液,分析引物扩增特异性。多重PCR扩增体系为:TaKaRa 2×Premix TaqTM 10 μL,引物FOCF/R和gyrBF/R各0.4 μL,模板(DNA或菌液)1 μL,DNaseFree water (无DNA酶水) 补足至20 μL。仪器BIORAD T100TM Thermal Cycler的PCR反应条件: 94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸60 s,35个循环;72℃延伸10 min。2%琼脂糖凝胶电泳检测扩增产物。
1.4.2 灵敏度检测
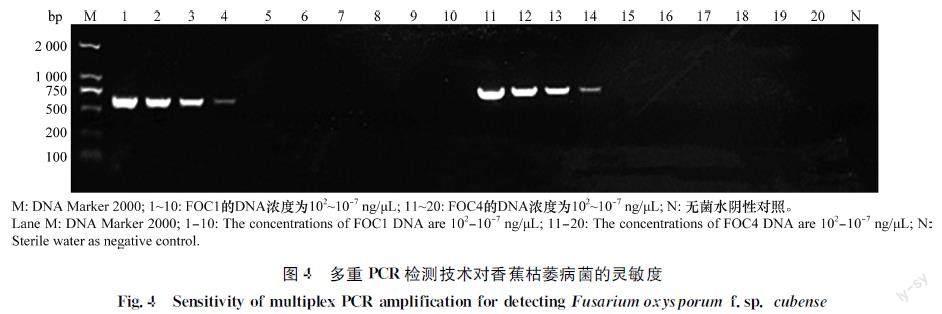
香蕉枯萎病菌DNA按10倍梯度稀释得到102~10-7ng/μL系列浓度,香蕉细菌性软腐病菌菌液按10倍梯度稀释得到108~10-1cfu/mL系列浓度。采用多重PCR扩增体系进行灵敏度分析,PCR扩增反应同1.4.1。
1.5 含菌土壤的检测
将菌株FOC1或FOC4的分生孢子制成104 cfu/mL孢子悬浮液,将菌株MS1菌液制成104 cfu/mL菌悬液。称取10份灭菌土,每份100 g,其中2份分别加入2 mL菌株FOC1孢子悬浮液、2份分别加入 2 mL 菌株FOC4孢子悬浮液、2份分别加入2 mL菌株MS1菌悬液、1份加入2 mL菌株FOC1孢子悬浮液+2 mL菌株MS1菌悬液、1份加入2 mL菌株FOC4孢子悬浮液+2 mL菌株MS1菌悬液、1份加入2 mL菌株FOC1孢子悬浮液+2 mL菌株FOC4孢子悬浮液、1份无菌土加入2 mL无菌水,充分搅拌均勻。用E.Z.N.A Soil DNA kit(OMEGA)提取土壤总DNA, -20℃保存备用。采用引物FOCF/R和gyrBF/R 扩增上述样品DNA。PCR 扩增反应同1.4.1。
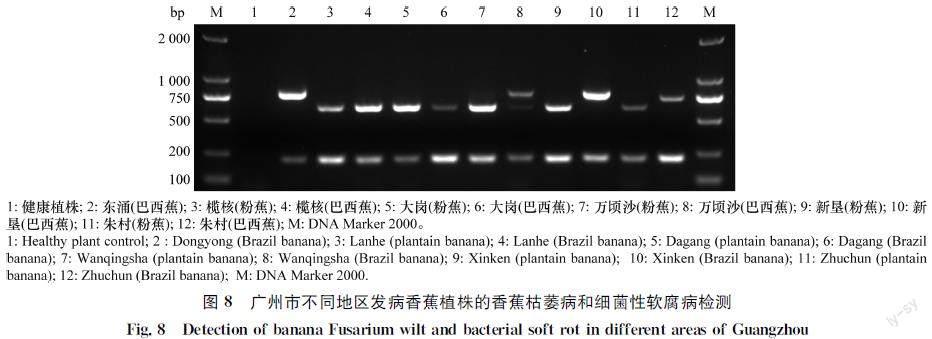
1.6 田间发病植株分析
在广州市东涌、万顷沙、新垦、朱村、榄核、大岗等镇采集样品,每个镇取3~5株发病植株的假茎组织,切碎后用液氮磨成粉末,采用CTAB法[18]提取总DNA, -20℃保存备用。采用引物FOCF/R和gyrBF/R 扩增样品DNA。PCR 扩增反应同1.4.1。
选取香蕉假茎的病健交界处组织进行病原菌分离,提取病原菌DNA。以该DNA为模板,使用真菌ITS保守引物ITS4和ITS5,细菌16S rDNA通用引物27f和1492r,扩增相应的保守基因序列,测序并进行BLAST比对。
2 结果与分析
2.1 引物特异性分析
多重PCR检测不同真菌基因组的特异性结果如图1所示。多重PCR体系仅特异性
扩增出尖孢镰刀菌古巴专化型1号和4号生理小种基因组中的特异片段,而其他19种不同真菌基因组DNA均未扩增出条带(图a);图1b显示多重PCR体系在尖孢镰刀菌古巴专化型4号生理小种基因组中扩增出796 bp的条带,而在尖孢镰刀菌古巴专化型1号生理小种和其他尖孢镰刀菌菌株基因组中扩增出636 bp条带,说明多重PCR体系在尖孢镰刀菌菌株中能特异性扩增出尖孢镰刀菌古巴专化型4号生理小种,由于香蕉尖孢镰刀菌古巴专化型1号和4号生理小种仅侵染香蕉植株,因此该多重PCR扩增体系适用于香蕉发病组织中检测香蕉枯萎病菌。
多重PCR检测不同细菌的特异性结果如图2所示。在迪基氏菌属细菌内不同菌株中均能扩增出218 bp条带,但在其他15个不同属菌株中均不能扩增出条带,说明此多重PCR检测能在迪基氏菌属内特异扩增,也能有效实现香蕉细菌性软腐病菌的检测。
香蕉枯萎病菌和香蕉细菌性软腐病菌的多重PCR检测结果如图3所示。尖孢镰刀菌古巴专化型1号生理小种、尖孢镰刀菌古巴专化型4号生理小种和香蕉细菌性软腐病菌的单独扩增和两两混合扩增,所得到的特异条带清晰,无杂带,说明基于引物FOCF/R和gyrBF/R复合的多重PCR检测体系可靠。
2.2 多重PCR灵敏度分析
多重PCR灵敏度检测结果表明(图4):10-1~102等4个浓度的DNA模板均有相应的扩增带,10-7~10-2 ng/μL浓度的模板及阴性对照等均没有扩增,表明该多重检测体系可检测到香蕉枯萎病菌DNA的含量下限为0.1 ng/μL。
多重PCR检测体系检测玉米迪基氏菌D.zeae的灵敏度结果表明(图5):103~108 cfu/mL 6个浓度DNA模板均有相应的扩增带,10-1~102 cfu/mL浓度菌液的模板及阴性对照等均没有扩增,表明该多重检测体系可检测到的细菌含量下限为103 cfu/mL。
2.3 含菌土壤检测
以土壤总DNA为模板进行多重PCR扩增反应(图6)。结果表明:在拌菌土壤检测中,土壤拌尖孢镰刀菌古巴专化型1号生理小种、尖孢镰刀菌古巴专化型4号生理小种和香蕉细菌性软腐病菌处理的PCR产物分别呈现636、796 bp和218 bp条带,均符合相应菌株的目的条带;土壤拌两种菌处理的PCR产物则分别呈现636 bp和218 bp复合条带、796 bp和218 bp复合条带、636 bp和796 bp复合条带,同样符合土壤所拌菌株的目的条带,表明此多重PCR检测体系可有效检测出土壤中含香蕉枯萎病菌和细菌性软腐病菌。
2.4 田间样品检测
采集广州市主要香蕉种植区的田间香蕉患病组织,严重发病香蕉假茎横截面见图7,截面大部分呈现紫色或褐色,其中部分假茎中心点出现褐色软腐。采用本文的多重PCR检测体系对发病组织进行病原菌的检测,结果表明(图8):广州市主要镇地区采集的香蕉植株发病组织均能检测出玉米迪基氏菌D.zeae相应的特异条带(218 bp);在东涌、万顷沙、新垦、朱村等地采集的香蕉病样均能扩增出FOC4对应的特异条带(796 bp),在榄核、大岗、万顷沙、新垦、朱村等镇粉蕉病样均能扩增出FOC1对应的特异条带(636 bp);表明这些地区的病株受到香蕉枯萎病菌和细菌性软腐病菌复合侵染。
香蕉发病植株分离的病原菌保守序列分析结果表明,所有引起植株发病的病原菌均与多重PCR检测的结果一致。
3 结论与讨论
本研究建立的多重PCR检测体系是在一个PCR 反应体系中加入2对特异引物FOCF/R和gyrBF/R,可以同时扩增出尖孢镰刀菌古巴专化型1号生理小种、4号生理小种和玉米迪基氏菌的特异片段,具有节省时间、降低成本、提高效率等优点[19]。尖孢镰刀菌对不同作物品种具有专性寄生而致病的特点,所以尖孢镰刀菌被进一步分为不同专化型生理小种,传统的形态鉴定和保守基因片段很难区分[20]。本研究基于尖孢镰刀菌古巴专化型1号生理小种、4号生理小种基因组种间存在区域片段的插入序列差异,从而设计出1对特异引物,通过扩增片段长度不同来区别香蕉枯萎病菌的2个生理小种,具有应用价值。香蕉细菌性软腐病病原菌为玉米迪基氏菌Dickeya zeae, gyrB基因在迪基氏属内具有保守性,而侵染香蕉导致发病的只有玉米迪基氏菌,即在香蕉发病组织中gyrB基因可以作为检测香蕉细菌性软腐病病菌的靶标基因。本研究也是基于田间种植过程中,发现香蕉枯萎病菌和細菌性软腐病菌可复合侵染,目前国内外报道仅限于尖孢镰刀菌古巴专化型[2124]和迪基氏细菌[2528] 的单独检测技术,但仅检测其中一种病原菌无法提供精准的香蕉病害预警防控技术指导,本文建立的检测技术弥补了相关技术空白。
本文建立的香蕉枯萎病菌和细菌性软腐病菌的多重PCR检测技术可有效用于检测香蕉患病组织中病菌种类,进而应用于香蕉种苗检疫、田间香蕉病害的早期诊断以及田间土壤带病菌的监测和鉴定,有效防止香蕉枯萎病和细菌性软腐病的扩散与蔓延,保障香蕉安全生产。
参考文献
[1] 王碧青, 胡适连. 香蕉枯萎病的两种症状类型[J]. 植物保护, 1989, 15(1): 49.
[2] ZHANG Jingxin, SHEN Huifang, PU Xiaoming, et al. Identification of Dickeya zeae as a causal agent of bacterial soft rot in banana in China [J]. Plant Disease, 2014, 98(4): 436442.
[3] PU Xiaoming, ZHOU Jianuan, LIN Birun, et al. First report of bacterial foot rot of rice caused by a Dickeya zeae in China [J]. Plant Disease, 2012, 96(12): 1818.
[4] VELEZNEGRON Y I, SIMBAЙACARRERA L L, SOTORAMOS C M, et al. First report of bacterial pineapple heart rot caused by Dickeya zeae in Puerto Rico [J]. Plant Disease, 2023,107(1):210.
[5] MARTINEZCISNEROS B A, JUAREZLOPEZ G, VALENCIATORRES N, et al. First report of bacterial stalk rot of maize caused by Dickeya zeae in Mexico [J]. Plant Disease, 2014, 98(9): 1267.
[6] YANG Qinyun, JIANG Shangbo, ZHANG Jingxin, et al. First report of Dickeya zeae causing bacterial soft rot on Canna edulis KerGawl in China [J]. Plant Disease, 2018,103(1):1.
[7] YANG Yanchang, YAO Ziting, ZHANG Muqing, et al. First report of stalk bacterial soft rot of sugarcane caused by Dickeya zeae in China [J]. Plant Disease, 2021, 105(4):1.
[8] 漆艷香, 谢艺贤, 张欣, 等. 海南省香蕉枯萎菌生理小种的RAPD分析[J]. 菌物学报, 2005, 24(3): 394399.
[9] 杨腊英, 郭立佳, 汪军, 等. 香蕉枯萎病菌SIX2基因序列及特异性分析[J]. 植物保护, 2016, 42(5): 118124.
[10]吕伟成, 张绍升, 林志远. 一步双重PCR 检测香蕉枯萎病菌生理小种[J]. 中国农学通报, 2009, 25(1): 237240.
[11]AGUAYO J, MOSTERT D, FOURRIERJEANDEL C, et al. Development of a hydrolysis probebased realtime assay for the detection of tropical strains of Fusarium oxysporum f.sp. cubense race 4 [J/OL]. PLoS ONE, 2017, 12(2): e0171767. DOI: 10.1371/journal.pone.0171767.
[12]马月萍, 戴思兰, 马艳蓉. 荧光定量PCR 技术在植物研究中的应用[J]. 生物技术通报, 2011(7): 3745.
[13]NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loopmediated isothermal amplification of DNA [J/OL]. Nucleic Acids Research, 2000, 28(12): E63. DOI: 10.1097/RLU.0b013e3181f49ac7.
[14]PENG Jun, ZHANG He, CHEN Fengping, et al. Rapid and quantitative detection of Fusarium oxysporum f.sp. cubense race 4 in soil by realtime fluorescence loopmediated isothermal amplification [J]. Journal of Applied Microbiology, 2014, 117(6): 17401749.
[15]GUO Lijia, HAN Lijuan, YANG Laying, et al. Genome and transcriptome analysis of the fungal pathogen Fusarium oxysporum f.sp. cubense causing banana vascular wilt disease [J/OL]. PLoS ONE, 2014, 9(4): e95543. DOI: 10.1371/journal.pone.0117621.
[16]ZHANG Jingxin, LIN Birun, SHEN Huifang, et al. Genome sequence of the banana pathogen Dickeya zeae strain MS1, Which causes bacterial soft rot [J/OL]. Genome Announcements, 2013, 1(3): e0031713. DOI: 10.1128/genomeA.0031713.
[17]MARRERO G, SCHNEIDER K L, JENKINS D M, et al. Phylogeny and classification of Dickeya based on multilocus sequence analysis [J]. International Journal of Systematic & Evolutionary Microbiology, 2013, 63(Pt.9): 35243539.
[18]吳发红, 黄东益, 黄小龙, 等. 几种真菌DNA提取方法的比较[J]. 中国农学通报, 2009, 25(8): 6264.
[19]李敏慧,余雄涛,王鸿飞,等. 香蕉枯萎病菌1 号和4 号生理小种的快速检测与鉴定[J]. 中国农业科学, 2012, 45(19): 39713979.
[20]RECORBET G, STEINBERG ;C, OLIVAIN C, et al. Wanted: pathogenesisrelated marker molecules for Fusariumoxysporum [J]. New Phytologist, 2003, 159(1): 7392.
[21]吕伟成,张绍升,林志远. 一步双重PCR 检测香蕉枯萎病菌生理小种[J]. 中国农学通报, 2009, 25(1): 237240.
[22]廖林凤,董章勇,王振中,等. 香蕉枯萎病菌RAPD分析及4 号生理小种的快速检测[J]. 植物病理学报, 2009, 39(4): 353361.
[23]WAALWIJK C, DITA M A, BUDDENHAGEN I, et al. A detection method for tropical race 4 of the banana pathogen Fusarium oxysporum f.sp. cubense [J]. Acta Horticulturae, 2011, 897: 339344.
[24]YANG Leiliang, SUN Lixia, RUAN Xiaolei, et al. Development of a singletube duplex realtime fluorescence method for the rapid quantitative detection of Fusarium oxysporum f.sp. cubense race 1 (FOC1) and race 4 (FOC4) using TaqMan probes [J]. Crop Protection, 2015, 68: 2735.

