青蒿中番茄斑萎病毒和烟草花叶病毒的分子鉴定及相关序列分析
钟静 李婷婷 韩天华 李学卫 尹跃艳 陈越 马文广 丁铭


摘要
番茄斑萎病毒(tomato spotted wilt virus, TSWV)和煙草花叶病毒(tobacco mosaic virus, TMV)是2种重要的植物病原病毒,对多种经济作物的产量和品质均造成严重影响。2021年-2022年,在云南省丽江市烟草种植区不同烟区采集叶片黄化、皱缩以及无症状的青蒿Artemisia caruifolia样品共计14份,利用免疫金标速测卡和RTPCR对其病原病毒进行检测。利用免疫金标速测卡检测结果显示,在所检样品中有9份样品检测出TSWV,检出率为64.28%,有3份样品检测出TMV,检出率为21.43%,2种病毒复合侵染的检出率同样为21.43%;利用RTPCR对复合侵染的3份样品进行分子检测,结果显示,在3份复合侵染青蒿样品中获得3条TSWV N基因序列、3条TMV cp基因序列和2条TMV RdRp部分序列。TSWV青蒿分离物与分离自云南的TSWV2分离物相似性最高,为99.6%;TMV青蒿分离物与分离自辽宁的TMVShenyang分离物和分离自云南的TMVYongren1相似性最高,均大于99.4%。这是首次发现TSWV和TMV 2种不同属病毒复合侵染青蒿。
关键词
番茄斑萎病毒; 烟草花叶病毒; 青蒿; 复合侵染
中图分类号:
S 435.72
文献标识码: A
DOI: 10.16688/j.zwbh.2022728
Molecular identification and sequence analysis of tomato spotted wilt virus and tobacco mosaic virus on Artemisia caruifolia
ZHONG Jing1#, LI Tingting1#, HAN Tianhua2, LI Xuewei2, YIN Yueyan3, CHEN Yue1,
MA Wenguang2*, DING Ming1*
(1. Institute of Biotechnology and Germplasm Resources, Yunnan Academy of Agricultural Sciences, Yunnan Provincial
Key Laboratory of Agricultural Biotechnology, Key Laboratory of the Southwestern Crop Gene Resources and
Germplasm Innovation, Ministry of Agriculture and Rural Affairs, Kunming 650223, China; 2. Lijiang Branch
Company of Yunnan Tobacco Company, Lijiang 674100, China; 3. Institute of Alpine Economic Plant, Yunnan
Academy of Agricultural Sciences, Lijiang 674199, China)
Abstract
Tomato spotted wilt virus (TSWV) and tobacco mosaic virus (TMV) are two important viral pathogens that account for significant yield losses and quality damage in many economically important crops. During 2021-2022, 14 sweet wormwood (Artemisia caruifolia) leaf samples with leaf yellowing and curling symptoms or asymptomatic were collected from tobacco fields in Lijiang of Yunnan province. The colloidal gold antigen rapid screen kits and RTPCR were used to identify the pathogens of diseased plants. Immunological assays using colloidal gold antigen rapid screen kits showed that nine leaf samples were infected with TSWV (64.28% positive rate), three infected with TMV (21.43% positive rate), and three infected with both TSWV and TMV. RTPCR was carried out to obtain viral sequences from these three coinfected sweet wormwood samples. Then three N gene sequences of TSWV, three cp sequences and two partial RdRp sequences of TMV were obtained. Sequence alignment showed that the TSWV isolates were most closely related to the TSWV2 isolate from Yunnan sharing 99.6% sequence identity, and the TMV isolates shared the highest sequence identity (>99.4%) with the Shenyang isolate from Liaoning and Yongren1 isolate from Yunnan. It is the first report that sweet wormwood plants were coinfected by TSWV and TMV.
Key words
tomato spotted wilt virus; tobacco mosaic virus; Artemisia caruifolia; mixed infection
番茄斑萎病毒(tomato spotted wilt virus, TSWV)属于布尼亚病毒目Bunyavirales番茄斑萎病毒科Tospoviridae正番茄斑萎病毒属Orthotospovirus,病毒粒子为球状,大小为80~120 nm[1]。TSWV基因组包含L RNA(9.8 kb)、M RNA(4.8 kb)和S RNA(2.9 kb)3条链,共编码5个蛋白。L链编码331.5 kD的RNA聚合酶蛋白(RNA polymerase),M链编码33.6 kD的非结构蛋白NSm和127.4 kD的糖蛋白GnGc,S链编码52.4 kD的非结构蛋白NSs和28.8 kD的核壳体蛋白(uncleocapsid protein, N),其中核殼体蛋白N为TSWV分类的重要依据[2]。TSWV侵染后植株表现出枯萎、环斑以及顶梢枯死等症状。目前至少有9种蓟马能够传播番茄斑萎病毒,其中西花蓟马Frankliniella occidentalis是最重要的一种,传播方式为持久性循回增殖传播,由于TSWV可以在蓟马体内复制增殖,所以蓟马不仅是番茄斑萎病毒的传播介体,还是番茄斑萎病毒的天然宿主[3]。自1915年在澳大利亚发现至今,TSWV已在中国、伊朗、土耳其、意大利、美国、孟加拉、韩国等几十个国家和地区发生,在世界范围内对各地农作物造成严重危害,从而造成严重的经济损失[46]。在我国,TSWV也对不同地区的作物造成了严重危害,且分布范围广,从北京、山东到宁夏再到云南均有TSWV发生;而在云南省辣椒Capsicum annuum、莴苣Lactuca sativa、生菜L.sativa var. romosa、番茄Solanum lycopersicum等作物均不同程度地受到TSWV危害[712]。
烟草花叶病毒(tobacco mosaic virus, TMV)属于马泰利病毒目Martellivirales植物杆状病毒科Virgaviridae烟草花叶病毒属Tobamovirus,病毒粒子为杆状,大小为18 nm×300 nm。TMV为正义单链RNA病毒,基因组全长为6 395 bp,有3个开放阅读框,至少编码4个蛋白,分别为126 kD和 183 kD 的复制蛋白(replication protein, Rep)、30 kD 的运动蛋白(movement protein, MP)以及17.5 kD的外壳蛋白(coat protein, CP),其中外壳蛋白是TMV分类的重要依据[2]。在自然界中TMV主要通过汁液摩擦传播,同时也通过蚜虫、土壤以及种子传播,不同寄主被侵染后表现出不同的症状,侵染烟草时表现出黄绿相间的花叶症状,严重时形成疱斑。TMV的分布范围十分广泛,在巴西、韩国、美国、中国、德国等国家均有发生[1315]。2011年TMV被列为世界十大植物病毒之首[16]。
青蒿Artemisia caruifolia为菊科Compositae蒿属Artemisia一年生草本植物,具有清热、凉血以及解暑等药用价值[17],在我国各地均有分布,是田间重要杂草,同时也是多种植物病原病毒的重要中间寄主。丽江市金沙江流域烟草产区是云南省特色烟草产区,本研究利用免疫金标速测卡和RTPCR 2种检测方法对云南省丽江市烟草种植区表现黄化、皱缩以及无症的青蒿样品进行病原鉴定,并对感病青蒿样品中的TSWV的N基因和TMV的部分基因进行了克隆和序列分析,以期为丽江市金沙江流域烟草种植区内病毒病害的防治提供理论基础。
1 材料与方法
1.1 材料
试验材料:2022年对云南省丽江市烟草种植区进行病毒病害调查时,采集不同烟区表现叶片黄化、皱缩以及无症状的青蒿样品(图1,表2),新鲜样品带回实验室编号后立即利用免疫金标速测卡进行病毒检测并进行植物总RNA提取。
1.2 方法
1.2.1 总RNA提取
取约0.1 g青蒿叶片,在液氮中迅速研磨成粉末,按照Trizol总RNA提取试剂盒(Invitrogen公司)说明书提取青蒿叶片总RNA。
1.2.2 免疫金标速测卡检测
按照烟草花叶病毒(TMV)和番茄斑萎病毒(TSWV)免疫金标速测卡(上海佑隆生物科技有限公司)说明书进行样品检测,具体检测原理与检测步骤如下:
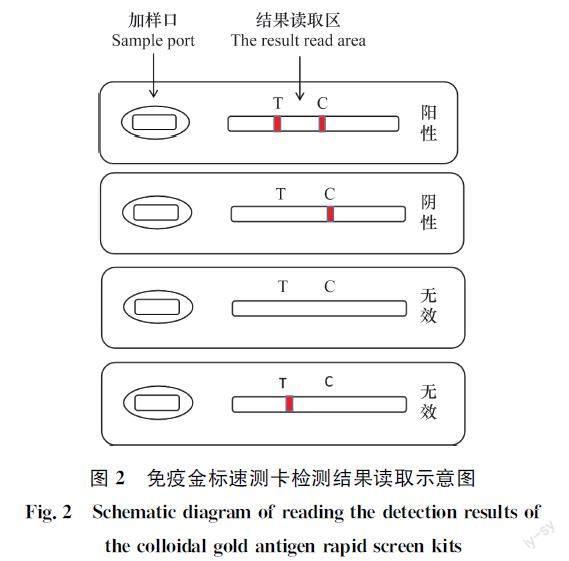
检测原理:烟草花叶病毒(TMV)和番茄斑萎病毒(TSWV)免疫金标速测卡应用双抗体夹心免疫层析的原理,样本中的抗原在侧向移动的过程中与胶体金标记的特异性单克隆抗体1结合,形成抗原抗体复合物,继续向前方流动和NC膜检测线上特异性单克隆抗体2结合形成双抗体夹心复合物。如果样本中抗原含量大于检测限,检测线显红色,结果为阳性;反之,检测线不显色,结果为阴性(图2)。
检测步骤:将采集的青蒿叶片按照编号分别放置于小号自封袋中并封口,利用研磨器将自封袋中样本研磨出大量汁液,加入2 mL 磷酸盐缓冲液(phosphate buffer solution tween, PBST),继续研磨使缓冲液与样品汁液充分混匀,用移液枪加200 μL待检样品混合液至加样口,加样后开始计时,5~8 min后读取结果。
1.2.3 RTPCR检测
采用一步法对不同青蒿样品总RNA进行反转录,第一链cDNA合成反应体系(20 μL):20×Enzyme Mix(Invitrogen公司)1 μL、2×RT Buffer Mix 10 μL、RNA 5 μL,加DEPC水定容至20 μL;
反应条件:42℃ 30 min,95℃ 5 min,保存于-20℃备用。以cDNA为模板,分别利用番茄斑萎病毒和烟草花叶病毒特异性引物TSWVNF/TSWVNR、TMVF/TMVR和TMVCPF/TMVCPR对青蒿样品进行检测(表1)。PCR反应体系(50 μL):10×PCR 反应缓冲液(含 Mg2+) 5 μL,2.5 μmol/L
dNTPs 4 μL,20 μmol/L上、下游引物各 1 μL,5 U/μL Taq Plus DNA 聚合酶(上海申能博彩生物
科技有限公司)1 μL、cDNA 2 μL,加DEPC水定容至50 μL。扩增条件:94℃预变性2 min;94℃变性45 s,50℃退火45 s,72℃延伸60 s,30个循环;72℃延伸10 min。将PCR产物于1.0%琼脂糖凝胶中进行电泳检测,选择目标条带切胶,利用Axygen DNA凝胶回收试剂盒(Axygen公司)進行纯化回收,将回收产物与pEASYT5 Blunt zero载体(北京全式金生物技术股份有限公司)进行连接,通过热激转化到大肠杆菌TransT1中后进行涂板,过夜培养后挑取阳性克隆,送生工生物工程(上海)股份有限公司进行测序。
1.2.4 数据分析
利用NCBI中BLAST(https:∥blast.ncbi.nlm.nih.gov/Blast.)进行基因序列同源性初步比较分析。利用DNAMAN(Lynnon Biosoft, Quebec, Canada)和DNASTAR. Lasergene.v7.1软件进行开放阅读框的查找;利用DNASTAR. Lasergene.v 7.1软件进行核苷酸序列比对;利用MEGA 6软件中的邻接法(neighborjoining)构建系统进化树,自展值设置为1 000。
2 结果与分析
2.1 青蒿中番茄斑萎病毒和烟草花叶病毒检测结果
2021年7月-2022年7月对丽江市不同烟区进行病害调查,发现丽江不同烟草种植区的烟田周边均有大量青蒿杂草,采集不同烟区青蒿样品进行病毒检测。通过烟草花叶病毒(TMV)和番茄斑萎病毒(TSWV)免疫金标速测卡对所采集的14份青蒿样品进行检测,结果显示:YN550、YN551、YN693、YN571、YN583、YN682、YN832、YN833和YN839等9个青蒿样品TSWV检测均呈阳性,其中YN693、YN682和YN833等3份青蒿样品TMV检测呈阳性,其他样品病毒检测均呈阴性(表2)。分别可以从不同症状表现的青蒿样品中检测到TSWV和TMV,如表现黄化、卷曲、皱缩的青蒿叶片样品YN550,表现黄化、卷曲的青蒿叶片样品YN551和YN583,仅表现黄化的青蒿叶片样品YN571,叶片无症状的青蒿样品YN839均可检测出TSWV;叶片表现黄化的青蒿样品YN693和YN682,叶片无症状的青蒿样品YN833,均可检测出TSWV和TMV;而叶片无症状的青蒿样品YN786、YN830、YN831、YN989和叶片表现褪绿的青蒿样品YN797均未检测出TSWV和TMV。
根据免疫金标速测卡检测的结果,对3个复合侵染的青蒿样品YN693、YN682和YN833的病毒种类进行分子鉴定。利用TSWVNF/TSWVNR(N基因序列)引物对样品进行RTPCR检测,结果显示:3个样品均能扩增出777 bp的目的片段,阴性对照无条带,将目的片段进行切胶回收、连接转化及测序,共获得3条序列,分别命名为YN83351、YN6821和YN6935。利用TMVF/TMVR(RdRp部分序列)引物进行扩增,仅在YN693和YN833样品中扩增出1 549 bp的目的片段,阴性对照无条带,将目的片段进行切胶回收、连接转化及测序,共获得2条序列,分别命名为YN6934和YN83393;利用TMVCPF/TMVCPR(cp基因序列)引物进行扩增,结果在3个样品中均能扩增出约500 bp的目的片段,阴性对照无条带,将目的片段进行切胶回收、连接转化及测序,共获得3条序列,分别命名为YN68210、YN6932和YN8334(表2和表3)。
2.2 青蒿中番茄斑萎病毒和烟草花叶病毒分离物的相似性分析
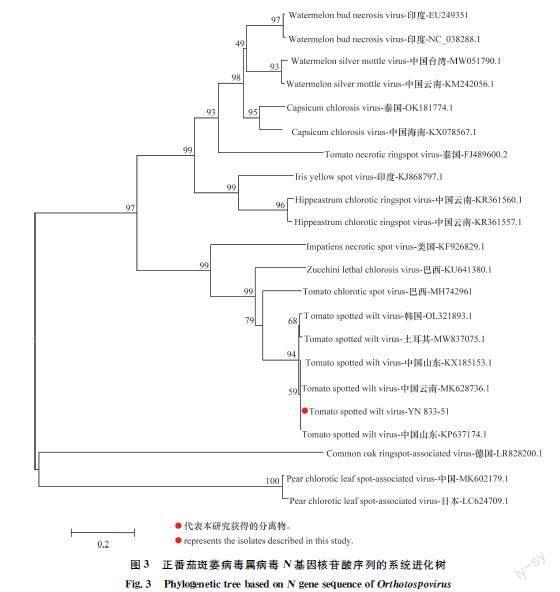
利用TSWVNF/NR对青蒿样品进行病毒扩增,共获得3条序列分别为YN83351、YN6821和YN6935,3条序列均为完整的TSWV N基因。通过BLAST进行序列比对,结果发现:3条序列均与TSWV的不同分离物相似性较高,故认为该3条序均为TSWV的不同分离物,将序列YN83351、YN6821和YN6935在NCBI上进行登录,并获得了登录号(表3),3条序列之间的相似性均高于99.4%,选取TSWVYN83351进行下一步分析。将YN83351分离物N基因序列与国内外同属的其他种或分离物N基因序列进行相似性分析,结果发现:YN83351分离物N基因核苷酸序列与TSWV的各个分离物的N基因核苷酸序列相似性在98.3%~99.7%之间,与云南省番茄分离物TSWV2(GenBank登录号:MK628736.1)的相似性最高,为99.7%;而与正番茄斑萎病毒属其他种病毒相似性在78.0%以下(表4),故认为该分离物为TSWV的一个分离物,命名为TSWVYN83351。
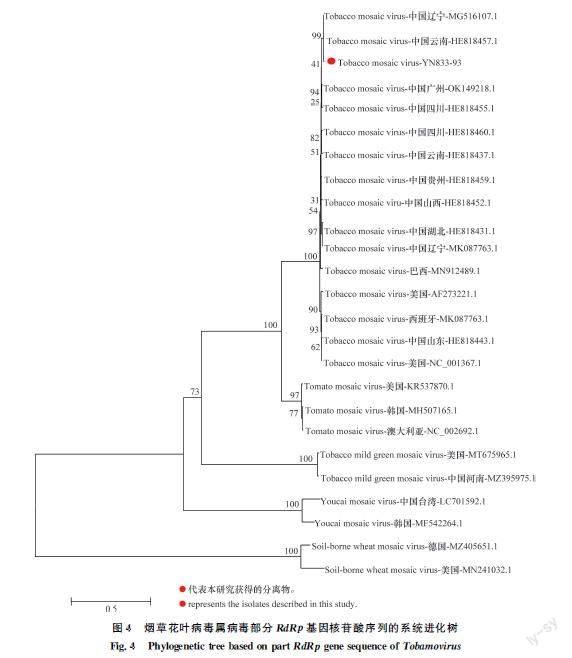
利用TMVF/R对青蒿样品进行病毒扩增,共获得2条序列,分别为YN83393和YN6934,2条序列为部分TMV RNA依赖的RNA复制酶基因。通过BLAST比对发现,2条序列均与TMV的不同分离物相似性较高,因此它们均为TMV的分离物,将2条序列YN83393和YN6934在NCBI上进行登录,并获得了登录号(表3),2条序列之间的相似性高于99.7%,选取YN83393进行下一步分析。将YN83393分离物RdRp基因序列与国内外其他种或分离物RdRp基因序列进行相似性分析,结果发现:YN83393分离物RdRp基因核苷酸序列与TMV各分离物的RdRp基因核苷酸序列相似性在95.5%~99.6%之间,与TMV辽宁分离物Shenyang(GenBank登录号:MG516107.1)的核苷酸序列相似性最高,为99.6%;而与烟草花叶病毒属其他种病毒相似性在81.8%以下(表5),因此,该分离物为TMV的一个分离物,命名为TMVYN83393。
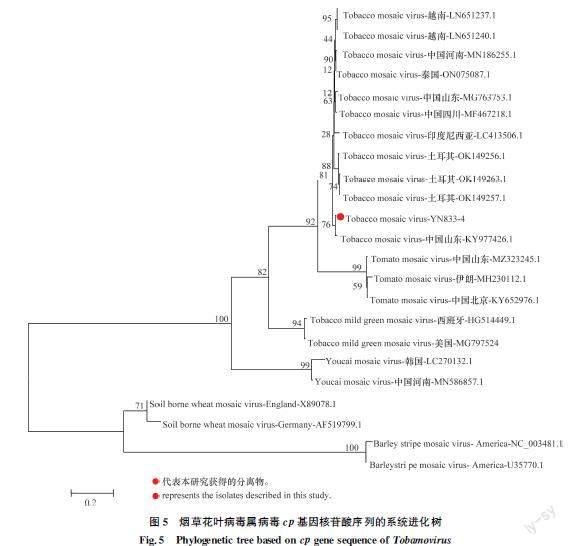
利用TMVCPF/CPR对青蒿样品进行扩增,共获得3条序列分别为YN8334、YN6932和YN68210,3条序列均为完整的TMV cp基因。通过BLAST比对发现:3条序列均与TMV的不同分离物相似性较高,因此该3条序列均为TMV的分离物,将序列YN8334、YN68210和YN6932在NCBI上进行登录,并获得了登录号(表3),3条序列之间的核苷酸相似性均高于99.2%,选取YN8334进行下一步分析。将YN8334分离物cp基因核苷酸序列与国内外其他种或分离物cp基因序列进行相似性分析,结果發现:YN8334分离物cp基因核苷酸序列与TMV各分离物的cp基因核苷酸序列相似性在95.4%~99.4%之间,与TMV辽宁分离物Shenyang(GenBank登录号:MG516107.1)和云南分离物Yongren1(GenBank登录号:HE818457.1)的核苷酸相似性最高,均为99.4%;而与烟草花叶病毒属其他病毒相似性在74.8%以下(表5),因此,该分离物为TMV的一个分离物,命名为TMVYN8334。
2.3 青蒿中番茄斑萎病毒和烟草花叶病毒系统进化分析
由于YN833、YN682和YN693等3个样品中均能扩增到TSWV和TMV的特异片段,且所获核苷酸序列相似性较高,故随机选取YN833样品中获得的各分离物核苷酸序列进行系统进化分析。将TSWVYN83351的N基因与番茄斑萎病毒不同分离物及同属病毒N基因构建系统进化树,结果显示:TSWVYN83351青蒿分离物与TSWV各个分离物聚于一个大的分支,且与云南和山东TSWV分离物聚于一个小的分支,说明TSWVYN83351青蒿分离物与云南和山东TSWV分离物亲缘关系最近(图3)。
将TMVYN83393的RdRp部分序列与烟草花叶病毒其他分离物及同属病毒相同片段构建系统进化树,结果显示:TMVYN83393青蒿分离物与TMV各分离物聚于一个大的分支,与TMV云南和辽宁分离物聚于一个小的分支,说明TMVYN83393青蒿分离物与TMV云南和辽宁分离物的亲缘关系最近(图4)。
将TMVYN8334的cp基因与烟草花叶病毒其他分离物及同属病毒相同片段构建系统进化树,结果显示:TMVYN8334青蒿分离物与TMV各分离物聚于一个大的分支,与TMV山东分离物聚于一个小的分支,说明TMVYN8334青蒿分离物与TMV山东分离物的亲缘关系最近(图5)。
3 结论与讨论
本研究利用免疫金标速测卡和分子检测方法,从云南省丽江市烟草种植区田间杂草青蒿中检测出正番茄斑萎病毒属病毒TSWV和烟草花叶病毒属病毒TMV,属于不同属病毒复合侵染,此2种病毒为丽江市烟草种植区内造成烟草减产甚至绝产的主要病原,在无症状的田间杂草青蒿中也可检测出2种病毒复合侵染,进一步证明田间杂草青蒿为重要中间寄主。
田间杂草是病毒的重要中间寄主,对病害流行有重要作用。铲除田间杂草是一项有效的防控措施,能有效地防治TSWV[18]。目前TSWV能侵染1 000多种植物,包括凹头苋Amaranthus blitum、马兜铃Aristolochia debilis、胜红蓟Ageratum conyzoides、蒲公英Taraxacum mongolicum、欧洲千里光Senecio vulgaris、水飞蓟Silybum marianum、龙葵Solanum nigrum、刺苍耳Xanthium spinosum等田间杂草,其中菊科植物就有247种,说明菊科植物为TSWV的易感寄主[1920],本研究首次报道TSWV侵染菊科植物青蒿。TSWV青蒿分离物与云南分离物相似性较高,系统进化上也与云南TSWV分离物亲缘关系较近。TMV是世界上发现和研究最早的病毒,也是第一个完成完整测序的植物病毒,可侵染番茄、烟草Nicotiana tabacum、车前Plantago asiatica、辣椒、茄子Solanum melongena、姜Zingiber officinale、兰花Cymbidium以及豆类等350多种植物[2122],但TMV的杂草寄主报道不多,这也是首次发现TMV能侵染田间杂草青蒿,TMV青蒿分离物与云南和辽宁TMV分离物相似性较高,在系统进化上也是与云南和辽宁TMV分离物亲缘性较近。青蒿常生于烟田及周边区域,并且青蒿受病毒侵染后会不表现出症状,因此其很可能成为作物病毒病的潜在初侵染源传播至烟草等农作物寄主,造成病害发生流行,引起烟草等作物病毒病害。
2种病毒复合侵染往往造成更为严重的危害,例如在非洲,甘薯羽状斑驳病毒(sweet potato feathery mottle virus, SPFMV)和甘薯褪绿矮化病毒(sweet potato chlorotic stunt virus, SPCSV)單独侵染甘薯时并不造成危害,但当SPFMV和SPCSV复合侵染时对当地甘薯产业造成严重危害,并造成巨大的经济损失[2324]。长期以来,在病毒的研究上常常关注的是单一病毒或株系,随着测序技术不断的革新,发现2种或2种以上病毒复合侵染同一寄主植物的现象越来越多,2种或2种以上病毒之间可能表现协同作用、拮抗作用或者中性作用。在2种或2种以上病毒感染的寄主植物上常常观察到病害症状更加严重,其中的原因主要是1种或者2种病毒的病毒积累量增加,病毒之间表现出协同作用[2529]。ChávezCalvillo等在研究木瓜环斑病毒(papaya ringspot virus,PRSV)和木瓜花叶病毒(papaya mosaic virus,PapMV)互作时发现,在先接种PRSV或PRSV和PapMV一起接种时,两种病毒发生协同作用;在先接种PapMV后接种PRSV时,2种病毒发生拮抗作用,说明2种病毒之间的相互作用与病毒感染先后顺序有关[29]。赵丽玲等在杂草凹头苋中检测到中国胜红蓟黄脉病毒(ageratum yellow vein China virus,AYVCNV)和云南番茄黄化曲叶病毒(tomato yellow leaf curl Yunan virus,TYLCYnV),并通过重组分析发现AYVCNV凹头苋分离物是一个重组病毒[30]。由此可见,杂草不但作为病毒侵染寄主的初侵染源,还成为病毒进化变异的重要场所。前期研究发现,在杂草中虽然病毒复合侵染情况较多,病毒种类也较多,但很多杂草寄主感染病毒后表现出的却是无症状或有轻微症状,与该病毒在经济作物上所表现症状并不尽相同[3133],本文同样在无症状的青蒿样品中鉴定出2种病毒,与前人研究结果相符。虽然在杂草中2种病毒复合侵染并不会造成更严重的危害,但当杂草中的多种病毒传播到经济作物上则可能对经济作物造成严重危害,因此,应加强对丽江烟草种植区田间杂草中病毒监测和病原种类鉴定,以期为丽江烟草种植区烟草病毒病防控提供科学依据。
参考文献
[1] MAES P, ALKHOVSKY S V, BAO Yiming, et al. Taxonomy of the family Arenaviridae and the order Bunyavirales: update 2018 [J]. Archives of Virology, 2018, 163(8): 22952310.
[2] KING A M Q, ADAMS M J, CARSTCNS E B, et al. Virus taxonomy: ninth report of the international committee on taxonomy of viruses [M]. San Diego: Elsevier/Academic Press, 2012: 351373.
[3] GUPTA R, KWON S Y, KIM S T. An insight into the tomato spotted wilt virus (TSWV), tomato and thrips interaction [J]. Plant Biotechnology Reports, 2018, 12(3): 157163.
[4] FERRAND L, ALMEIDA M M S, ORLIO A F, et al. Biological and molecular characterization of tomato spotted wilt virus (TSWV) resistancebreaking isolates from Argentina [J]. Plant Pathology, 2019, 68(9): 15871601.
[5] GUNES N, GUMUS M. Detection and characterization of tomato spotted wilt virus and cucumber mosaic virus on pepper growing areas in Antalya [J]. Journal of Agricultural Sciences, 2019, 25(3): 259271.
[6] ABADKHAH M, KOOLIVAND D, EINI O. A new distinct clade for Iranian tomato spotted wilt virus isolates based on the polymerase, nucleocapsid, and nonstructural genes [J/OL]. The Plant Pathology Journal, 2018, 34(6): 514. DOI: 10.5423/PPJ.OA.04.2018.0062.
[7] 鄭宽瑜, 吴阔, 董家红, 等. 番茄斑萎病毒对云南莴苣类蔬菜的侵染危害[J]. 植物保护, 2015, 41(5): 174178.
[8] 毛莲珍, 赵凯, 邓明华, 等. 云南省昆明地区番茄斑萎病毒核衣壳蛋白和运动蛋白变异分析[J]. 西北植物学报, 2019, 39(11): 19291934.
[9] 刘佳, 陈东亮, 梁玉镯, 等. 北京辣椒和番茄上番茄斑萎病毒的鉴定[J]. 植物检疫, 2021, 35(2): 4448.
[10]张万红, 冯佳, KAMRAN A, 等. 山东烟区首次发现番茄斑萎病毒侵染[J]. 中国烟草科学, 2020, 41(5): 8791.
[11]康华军, 李建设, 高艳明, 等. 宁夏银川地区番茄斑萎病毒和南方番茄病毒复合侵染分子鉴定[J]. 中国蔬菜, 2022(4): 2934.
[12]桂敏, 高雪, 贾志强, 等. 云南辣椒正番茄斑萎病毒属病毒的分子鉴定[J]. 植物保护, 2022, 48(4): 286292.
[13]JUNG H W, YUN W S, HAHM Y I, et al. Characterization of tobacco mosaic virus isolated from potato showing yellow leaf mosaic and stunting symptoms in Korea [J]. Plant Disease, 2002, 86(2): 112117.
[14]KIM B S, RUHL G, CRESWELL T, et al. Molecular identification of a tobacco mosaic virus isolate from imported petunias [J]. Plant Health Progress, 2014, 15(4): 153154.
[15]YANG Jinguang, WANG Fenglong, CHEN Dexin, et al. Development of a onestep immunocapture realtime RTPCR assay for detection of tobacco mosaic virus in soil [J]. Sensors, 2012, 12(12): 1668516694.
[16]SCHOLTHOF K B G, ADKINS S, CZOSNEK H, et al. Top 10 plant viruses in molecular plant pathology [J]. Molecular Plant Pathology, 2011, 12(9): 938954.
[17]中國医药信息查询平台[DB/OL]. [20221117]. https:∥www.dayi.org.cn/cmedical/1008545.
[18]MARCHOUX G, HOSTACHY B, GEBRE S K, et al. Tomato spotted wilt virus: htes et méthodes delutte [J].PHMRevue Horticole, 2000, 418: 4652.
[19]PARRELLA G, GOGNALONS P, GEBRE S K, et al. An update of the host range of tomato spotted wilt virus [J]. Journal of Plant Pathology, 2003, 85(4): 227264.
[20]MORCA A F, ELIK A, COSKAN S, et al. Population analysis on tomato spotted wilt virus isolates inducing various symptoms on tomato, pepper, and Chenopodium album in Turkey [J/OL]. Physiological and Molecular Plant Pathology, 2022, 118: 101786. DOI: 10.1016/j.pmpp.2022.101786.
[21]OSHIMA N, OHASHI Y, UMEKAWA M. Studies on some strains of tobacco mosaic virus pathogenic to crucifer plants 2. Host range [J]. Japanese Journal of Phytopathology, 1974, 40(3): 243251.
[22]ALISHIRI A, RAKHSHANDEHROO F, ZAMANIZADEH H R, et al. Prevalence of tobacco mosaic virus in Iran and evolutionary analyses of the coat protein gene [J]. Plant Pathology Journal, 2013, 29(3): 260273.
[23]SCHAEFERS G A, TERRY E R. Insect transmission of sweet potato disease agents in Nigeria [J]. Phytopathology, 1976, 66(5): 642645.
[24]KARYEIJA R F, KREUZE J F, GIBSON R W, et al. Synergistic interactions of a potyvirus and a phloemlimited crinivirus in sweet potato plants [J]. Virology, 2000, 269(1): 2636.
[25]SYLLER J. Facilitative and antagonistic interactions between plant viruses in mixed infections [J]. Molecular Plant Pathology, 2012, 13(2): 204216.
[26]UNTIVEROS M, FUENTES S, SALAZAR L F. Synergistic interaction of sweet potato chlorotic stunt virus (Crinivirus) with carla, cucumo, ipomo, and potyviruses infecting sweet potato [J]. Plant Disease, 2007, 91(6): 669676.
[27]MASCIA T, GALLITELLI D. Synergies and antagonisms in virus interactions [J]. Plant Science, 2016, 252: 176192.
[28]TATINENI S, ALEXANDER J, GUPTA A K, et al. Asymmetry in synergistic interaction between wheat streak mosaic virus and triticum mosaic virus in wheat [J]. Molecular PlantMicrobe Interactions, 2019, 32(3): 336350.
[29]CHAVEZCALVILLO G, CONTRERAS P C A, MORA M J, et al. Antagonism or synergism between papaya ringspot virus and papaya mosaic virus in Carica papaya is determined by their order of infection [J]. Virology, 2016, 489(9): 179191.
[30]赵丽玲, 钟静, 尹跃艳, 等. 云南凹头苋上分离到的2种菜豆金色花叶病毒属病毒基因组结构特征[J]. 植物病理学报, 2017, 47(6): 738746.
[31]SAMPANGI R K, MOHAN S K, PAPPU H R. Identification of new alternative weed hosts for iris yellow spot virus in the Pacific Northwest [J]. Plant Disease, 2007, 91(12): 1683.
[32]PAPAYIANNIS L C, KATIS N I, IDRIS A M, et al. Identification of weed hosts of tomato yellow leaf curl virus in Cyprus [J]. Plant disease, 2011, 95(2): 120125.
[33]HOSSEINI S A, SALARI K. Detection and molecular characterisation of potato virus S of weed reservoirs in Iran [J]. Archives of Phytopathology and Plant Protection, 2017, 50(15/16): 828838.
(責任编辑:田 喆)

