玉米白斑病的症状识别与诊断
何鹏搏 何鹏飞 吴毅歆 陈倩 赵正龙 亢波 唐萍 谭万忠 何月秋 王云月

摘要
由寬颈附球孢菌Epicoccum latusicollum Qian Chen,Crous & L. Cai引起的玉米白斑病正在我国局部地区流行,导致重大损失,并有扩大流行范围的趋势。为了增加植保及玉米抗病育种工作者对玉米白斑病的了解,本文描述了该病害的症状特点、病原菌特征,总结了发生规律、病害循环及分离鉴定和诊断技术。玉米白斑病菌能在病残体上越冬,种子带菌是其远距离传播的主要途径,风夹雨、昆虫及农事操作人员活动是近距离传播途径。7月中下旬至9月中下旬是白斑病流行高峰期,病菌与玉米适宜生长温度基本一致,具有扩散传播的风险。
关键词
玉米白斑病; 宽颈附球孢菌; 病害症状; 发生规律; 诊断
中图分类号:
S 435.131.49
文献标识码: A
DOI: 10.16688/j.zwbh.2022727
Symptom recognition and diagnosis of maize white spot
HE Pengbo1, HE Pengfei1, WU Yixin1, CHEN Qian2, ZHAO Zhenglong1, KANG Bo1,MUNIR Shahzai1, TANG Ping1, TAN Wanzhong1, HE Yueqiu1*, WANG Yunyue1*
(1. Yunnan Agricultural University, Kunming 650201, China; 2. State Key Laboratory of Mycology,
Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101,China)
Abstract
Maize white spot (MWS), caused by Epicoccum latusicollum Qian Chen, Crous & L. Cai, is endemic in local areas of China, resulting in significant losses and exhibiting a tendency to expand endemic area. In order to deepen understanding of MWS among plant protection workers, maize resistance breeders and related parties, the characteristics of symptoms and the MWS pathogen were described, and the occurrence regularity, disease cycle, isolation and identification of the pathogen and diagnosis techniques were summarized in this paper. E.latusicollum can overwinter on the diseased bodies, and the carriage by maize seeds is the main way of its longdistance transmission, wind and rain splash, insects and farm operators are the way of closedistance transmission. The MWS epidemic peak occurred from midlate July to midlate September, and the optimum growth temperature of the pathogen was basically the same as that of maize, implying that the disease has the risk of spreading nationwide.
Key words
maize white spot; Epicoccum latusicollum; disease symptom; occurrence regularity; diagnosis
玉米白斑病(maize white spot, MWS)在我国于20世纪90年代在广西、云南南部山区偶有所见,但近年来在我国西南玉米产区来势汹汹,目前在云南、广西、贵州、四川、湖北、重庆山区均有发生[1],其中云南省最为严重,我们的调查结果表明,该病可导致玉米感病品种产量损失20%~40%。国外学者把与本病症状相似的玉米病害归于玉米暗球腔菌Phaeosphaeria maydis引起的叶斑病(Phaeosphaeria leaf spot,PLS),Casela等[2]与Flett等[3]报道PLS在巴西和南非已成为玉米重要病害之一。由于病菌对实验室常规分离中消毒剂较敏感,分离不易成功,致使不同研究者对病原菌的归属看法不一致[2, 45]。为了给植物保护工作者、玉米抗病育种者及其他人员提高对玉米白斑病的认识和鉴定能力,本文依据我们的研究结果,就病害症状、病原菌、发生规律、病害循环、分离与鉴定技术进行了简单的归纳总结。
1 玉米白斑病症状
玉米白斑病为叶部病害。在玉米叶片上首先出现针尖大小的暗绿色圆形病斑,后逐渐扩大成白色圆形、长圆形、长形、不规则形,边缘整齐,内侧有宽约1 mm褐色环形坏死线。叶片上病斑正反两面大小和颜色完全一致,或者几近一致。病斑因失水而出现突然下陷、干瘪的症状。病斑变白、变干(图1a、1c)。病斑初期单生,直径为0.3~2.0 cm,后期常多个病斑愈合成不规则的大病斑,直径3~5 cm。病斑增多时,整个叶片变白、枯草色,枯死(图1b),少数病斑因中间脱落而出现穿孔现象(图1c)。中后期的病斑长出褐色或黑褐色小颗粒(分生孢子器喷吐出胶质状的分生孢子堆),分生孢子器埋生于叶片表皮之下,在病斑中排列不规则(图1cf)。但发病初期或者遇不适宜天气条件时,病斑上无黑色小颗粒。
2 玉米白斑病的病原菌
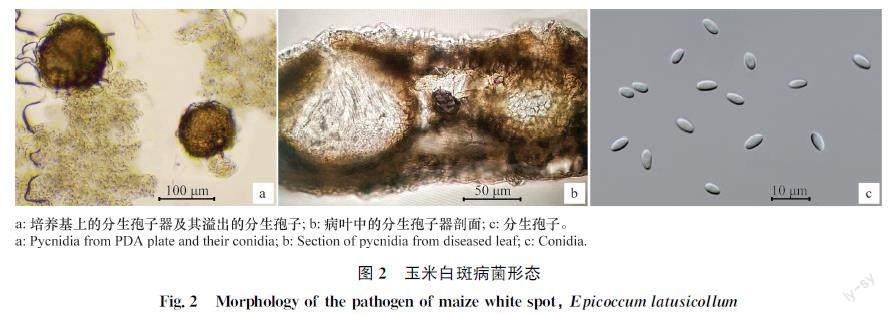
玉米白斑病是由子囊菌门Ascomycota座囊菌纲Dothideomycetes格孢腔菌目Pleosporales亚隔孢壳科Didymellaceae宽颈附球孢菌Epicoccum latusicollum Qian Chen,Crous & L. Cai所引起。在马铃薯葡萄糖培养基(PDA)上接种1个直径5~6 mm菌丝块,于28℃下暗培养7 d后,菌丝可布满直径9 cm的培养皿。菌丝初期为白色密绒毛状,中后期分泌浅红色色素,菌落边缘整齐规则,菌落正面中央粉白至浅棕色,边缘为白色,背面淡棕色或浅粉红色,但因培养基不同,菌落的颜色有变化。分生孢子器球形,上端有孔口,但有时不明显,埋生于病斑之下,遇雨水时,其内喷出分生孢子,后期孢子溢出物变浅褐色、褐色、黑色。分生孢子器在PDA上易形成,半埋生或者表生。在培养3~5 d后,用灭菌的玻片轻刮菌落上的表生菌丝,24 h后,便可以看到分子孢子器上喷出大量脓样的孢子溢出物。孢子溢出物浅泥土色。分生孢子器褐色、黑褐色,直径90~110 μm。分生孢器在显微镜下,遇水喷出柱状、蛇曲状的分生孢子束。单个分生孢子透明、薄壁且光滑,呈卵圆形至长卵形,无隔,单胞,大小为:(5.4~6.5) μm×(2.5~3.5) μm[1](图2)。
图2 玉米白斑病菌形态
Fig.2 Morphology of the pathogen of maize white spot, Epicoccum latusicollum
玉米白斑病菌菌丝在5~35℃下均能生长,最适生长温度为 28~30℃;pH 3.0~10.0范围内均可生长,最适pH为7.0 左右。分生孢子在13~44℃温度范围内均能萌发,最适宜萌发的温度在25~30℃,最适宜萌发湿度在90%以上。它在玉米汁蔗糖培养基(玉米200 g,煮沸20 min后过滤,取滤液加琼脂粉15 g、蔗糖15 g,加水定容至1 000 mL;MSA)上生长速度最快,在PDA、燕麦琼脂培养基 (OA)上生长速度居中,在玉米汁培养基(玉米200 g,高压煮沸20 min后过滤,取濾液加琼脂粉15 g,加水定容至1 000 mL;MA)上生长较慢[1]。
3 玉米白斑病发生规律
玉米白斑病发生规律还不完全清楚。从作者近3年调查的结果来看,玉米品种对白斑病的抗病性差别大,从近乎免疫到高度感病。中抗以上的品种约占50%。田间主要在大喇叭口期后开始出现病斑,越往后,病情越重。在乳熟期,高感品种的叶片慢慢枯死,至成熟期,叶片全部枯死。山区病害比平原严重,田间肥料多少与病害严重度关系不密切。在周年种植玉米的区域,病菌没有越冬期,可以周而复始地辗转传播,引起发病。但一年内病情发生最为严重时间在7月中旬至9月中下旬。
4 病害循环
玉米白斑病菌可以分生孢子器和菌丝体在玉米病叶片、苞叶上越冬,亦可随着这些病残体在土壤表面越冬,病菌可以分生孢子或者分生孢子器粘附到种子表面越冬和远距离传播。在田间适合发病的条件下,风夹雨是传播的主要途径,爬行的昆虫及田间农事操作者也可近距离传播。
5 分離鉴定技术
5.1 分离技术
5.1.1 组织分离法
用常规组织分离法从发病植株叶片的典型病斑上分离白斑病病原物。将新鲜病叶冲洗干净,取病健交界处大小5 mm×5 mm的组织,用75%乙醇消毒5 s,2.5%次氯酸钠浸泡2 min,无菌水漂洗3次,置于无菌吸水纸上吸干水分后转移至含有10 μg/mL氯霉素的PDA平板上,置于28℃恒温培养箱中,待病叶组织边缘长出菌丝后,挑取菌丝尖端,转入新的PDA平板进一步纯化培养。
5.1.2 涂板分离法
鉴于白斑病菌对常用的乙醇、升汞和漂白粉很敏感,不易分离成功的特点,病菌的分离可以采用涂板法。病组织按上述方法表面消毒后,放入灭菌的研钵中,加入少量灭菌水,用碾槌碾磨至糊状体,再加入适量的灭菌水充分稀释,取稀释液涂布于加有10 μg/mL氯霉素的PDA平板上,置于28℃恒温培养箱中,待培养皿上长出圆形小菌落后,挑取菌丝灰白色,背面有浅棕色或浅粉红色、淡褐色杂糅的菌落边缘转入新的PDA平板进一步纯化培养。注意务必挑取类型占比多的菌落,如果挑取比例较少的菌落,可能分离不易成功。
5.2 鉴定技术
5.2.1 显微切片法
玉米白斑病发生早期或者天气原因,时常只是看到白色病斑症状,无菌丝、无子实体等病征,有时直接刮取病组织表面,在显微镜下也看不到真正的病菌,而时常会看到少量镰刀菌Fusarium spp.、链格孢Alternaria spp.等腐生性强的真菌。遇到这种情况时,采用常规组织切片法是可行的。即切好病组织薄片后,直接在显微镜下检查,看是否有分生孢子器埋生于病组织中,如果见到了典型分生孢子器,那就可能获得了一个初步证据,该病可能由宽颈附球孢菌引起。
5.2.2 形态学鉴定法
1)观察菌落形态、颜色;2)观察菌落中的分生孢子器和分生孢子形态,测量它们的大小。如果符合前述形态特征,就可以进一步确认所分离到的病菌可能为宽颈附球孢菌。
5.2.3 分子鉴定法
如有需要,则按文献[1,6]方法进行。采用CTAB法[7]提取可能菌株的基因组DNA。分别用ITS1(5′TCCGTAGGTGAACCTGCGC3′)/ITS4(5′TCCTCCGCTTATTGATATGC3′),Btub2Fd(5′GTBCACCTYCARACCGGYCARTG3′)/Btub4Rd
(5′CCRGAYTGRCCRAARACRAAGTTGTC3′),
RPB25F2(5′GGGGWGAYCAGAAGAAGGC3′)/
fRPB27cR(5′CCCATRGCTTGYTTRCCCAT3′),
LR0R(5′AGATGAAAAGAACTTTGAAAAGA
GAG3′)/LR7(5′TACTACCACCAAGATCT3′)引物对ITS、tub2、rpb2和LSU基因片段进行PCR扩增。PCR扩增体系(20 μL):5 U/μL Taq DNA polymerase 0.2 μL,10×Taq Buffer 2.0 μL,0.2 mmol/L dNTPs 1.6 μL,DNA 1.0 μL,10 μmol/L上下游引物各1.0 μL,用超纯水补足体积至20.0 μL。ITS扩增程序:95℃预变性5 min;95℃变性30 s,48℃退火30 s,72℃延伸80 s,35个循环;72℃再延伸10 min。tub2扩增程序:95℃预变性5 min;95℃变性30 s,52℃退火30 s,72℃延伸80 s,35个循环;72℃再延伸10 min。rpb2扩增程序:94℃预变性5 min;94℃变性45 s,60℃退火45 s,72℃延伸2 min,5个循环;94℃变性45 s,58℃退火45 s,72℃延伸2 min,5个循环;94℃变性45 s,54℃退火45 s,72℃延伸2 min,30个循环;72℃再延伸8 min。LSU扩增程序:95℃预变性5 min;95℃变性45 s,48℃退火45 s,72℃延伸2 min,35个循环;72℃再延伸10 min。对扩增片段进行测序,从GenBank网站下载其他近似菌株及WS1 (OM131567)和WS191 (OM131595)序列和外组菌株对应序列,使用MEGAX软件剪切各序列,使相同基因片段序列的长度一致,按照rpb2tub2ITSLSU的顺序首尾拼接,分析系统发育关系,构建系统发育树,采用邻接法进行聚类分析,自展值设为1 000,确定种的分类地位。当新分析的未知菌株与已知菌株序列同源性达99%以上,与已知菌株WS1和WS191聚为一支时,且切片法所用的叶片症状与白斑病基本一致,病菌形态学与Epicoccum latusicollum基本一致,所分离的病害属于玉米白斑病。
参考文献
[1] 张珊, 朱自萍, 何鹏搏,等. 云南省玉米白斑病的病菌鉴定与品种田间抗病性调查分析[J]. 植物保护学报, 2022, 49(3): 840847.
[2] CASELA C R. The Phaeosphaeria leaf spot [M]∥ CASELA C R, RENFRO R, KRATTIGER A F. Diagnosing maize diseases in Latin America. Isaa/Embrapa, Ithaca, NY, USA and Brasilia, BR, Brazil, 1998:157.
[3] FLETT B C, BENSCH M J, SMIT E, et al. A ;field guide for identification of maize diseases in south Africa [Z]. ARCLNR, Potchefstroom, South Africa, 1996.
[4] CARSON M L, GOODMAN M M, GLAWE D A. Phaeosphaeria leaf spot of maize in Florida [J]. Plant Disease, 1991, 75: 968.
[5] CARSON M L. Vulnerability of U.S. maize germ plasm to Phaeosphaeria leaf spot [J]. Plant Disease, 1999, 83(5): 462464.
[6] 陈倩. 亚隔孢壳科的系统演化及分类学研究[D]. 北京: 中国农业大学, 2015.
[7] HE Yueqiu. An improved protocol for fungal DNA preparation [J]. Mycosystema, 2000, 19(3): 434.
(責任编辑:田 喆)

