钙基脱氯剂脱除重整高温烟气中HCl的研究
刘聪,单红飞
(沈阳三聚凯特催化剂有限公司,辽宁 沈阳 110144)
固态脱氯技术的核心是脱氯剂[1],有很多种类,其中按照活性组分分类,主要分为浸渍碱性金属的氧化铝、钙系脱氯剂和铜系脱氯剂。脱氯剂脱除无机氯的原理为原料中的HCl和脱氯剂中的碱性有效金属进行反应,生成稳定的金属氯化物而被固定在脱氯剂上,其反应式如下:
MxOy+2yHCl=MxCl2y+yH2O
反应实际上是酸碱中和反应,M可以是碱金属和卤族元素等。原料中若含有有机氯,难以被脱氯剂吸收,常用的有概率吸收方法为分子筛吸附,吸附脱氯效率较低,一般需在经过加氢转化催化剂作用下先将有机氯氢解为HCl后再被脱氯剂吸收。
重整再生循环气的特点是含有较多的水、CO2、氧气,且使用温度高和气体流速快,在工业生产中,属较苛刻使用工况,因此对脱氯剂的性能要求非常高,主要有以下几点:①脱氯剂必须具有防粉化结块的优点;②脱氯剂不能对重整催化剂产生危害和影响。重整催化剂的活性组分是铂钯等贵金属,对各种重金属杂质的要求非常苛刻,应避免有害成分进入催化剂;③脱氯剂要有很高的氯容,减少脱氯剂更换频次和停、开工时间,满足至少4个月更换一次的需要;④脱氯剂应有较高的机械强度和较低的磨耗。国内已有多家机构开发出了重整再生气的固态脱氯剂,有的已经完成了几次改进,在工业应用上也取得了较好的应用效果。
1 钙基脱氯剂的研究
1.1 钙基脱氯剂
钙基脱氯剂的活性组分为含钙的化合物,一般为氢氧化钙、碳酸钙、氧化钙中的一种或几种,由于其在自然界中普遍存在、原料价格低,且对氯化氢有较好的吸收效果,因此采用钙基脱氯剂脱除氯化氢是一种低价有效的污染物的控制方法。脱氯剂在吸附氯化氢时主要发生以下几个反应:
Ca(OH)2+ 2HCl = CaCl2+ 2H2O
CaCO3+ 2HCl = CaCl2+ H2O + CO2
CaO + 2HCl = CaCl2+ H2O
CaCO3= CaO + CO2
Ca(OH)2= CaO + H2O
郭小汾[2]等以PVC为HCl的释放源,采用热重法在不同气氛下对Ca(OH)2、CaCO3、CaO三种钙化合物的脱氯性能进行了研究,结果表明氢氧化钙的脱氯效果最好,氧化钙其次,碳酸钙的脱氯性能则一般,这可能是由于氢氧化钙是强碱而碳酸钙是弱酸强碱盐,而脱氯反应本质是酸碱反应,因此氢氧化钙的效果更好一些。
蒋旭光等[3]通过固定床试验分别考察了CaO、CaCO3、Ca(OH)2、MgO、MgCO3五种组分对HCl的吸附性能,得出Ca(OH)2和CaO的脱氯性能较好,在适宜的温度下HCl的脱除率可达到60%~75%,相比之下镁基吸附剂的HCl脱除率很低,不到30%,如图1所示。但有研究[4]表明钙基吸附剂中添加少量MgO能够提高钙转化率,原因是MgO的存在提供了支撑骨架,较好地维持孔隙结构。
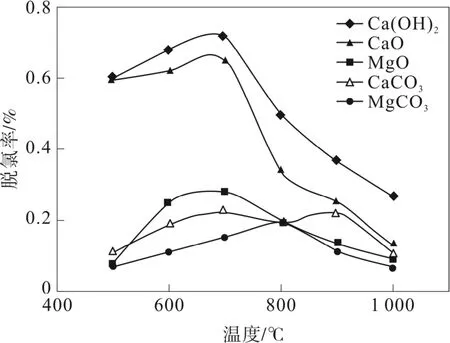
图1 不同活性组分对HCl的脱除率
1.3 钙基脱氯剂的改性
陈德珍等[5][6]用特定浓度的NaOH、Na2CO3、KOH、K2CO3溶液代替水消化CaO,得到改性型氢氧化钙并制备成吸附剂,在200~300 ℃条件下考察了吸附剂净化HCl气体的能力,实验表明NaOH和Na2CO3溶液消化生成的氢氧化钙具有更高的脱氯能力,二者的最佳添加量为0.76%~2.27%,即钠碱对氢氧化钙具有改良作用,主要是因为改性后的氢氧化钙比表面积和孔体积增加,颗粒内的孔隙分布得到改良,最佳孔径区内比表面积和孔体积增加,反应产物层疏松多孔,减小了扩散阻力,同时钠碱的引入也增强了碱性位,有助于提升脱氯能力。
汪雄平等[7]用一定量的NaOH溶液处理工业用CaCO3制备成改性吸附剂,并在中高温段考察了对HCl的吸附能力,发现钠碱处理后的CaCO3脱氯能力显著提升,与Ca(OH)2相差不大,其所用CaCO3颗粒粗、相对密度大,加上廉价、易得等优点,有望代替Ca(OH)2作为干式吸收剂[8]。
1.4 影响钙基脱氯剂性能的因素
金余其等[8]研究发现在一定范围内增加Ca/Cl摩尔比能够显著提升钙基吸附剂的脱氯性能,但当达到一定值之后,继续提高Ca/Cl摩尔比脱氯效果基本不变。郭小汾等[4]的研究也得到了类似的结果。因此考虑到经济性,Ca/Cl比不宜过大。
李诗媛等[9]的试验表明,Ca(OH)2、CaCO3、CaO的脱氯效率开始随温度的升高而增大,达到一个最大值后反而逐渐减小,Ca(OH)2和CaO在550~750 ℃表现出较高的活性,此外还指出钙基吸附剂的脱氯反应在开始阶段受化学反应控制,随后是化学反应和产物层扩散共同控制,最后受产物层扩散控制,不同温度下生成的产物层结构不同,从他们的扫描电镜图中可以看到在相同反应时间,500 ℃时的产物层比600 ℃时致密、孔隙少,这会使气体扩散阻力增大,导致钙转化率较低。蒋旭光等[5]也得到了类似结论,他们还在同一温度下对比了纯氧气气氛和纯空气气氛中CaO的脱氯效果,结果证明氧气的存在可促进CaO的转化,有利于脱氯反应的进行。
林瑜等[11]指出当烟气中含有CO2时,特别是CO2的体积分数远高于HCl时,CO2与HCl对吸附剂存在竞争吸附,并在钙基吸附剂的产物层中形成CaCO3,增大了扩散阻力,削弱了吸附剂对HCl的净化能力,他们采用NaOH溶液处理制得的改性Ca(OH)2,能够抑制CaCO3的生成,进而降低CO2对HCl脱除性能的影响。
在水蒸气存在的情况下,钙基吸附剂的脱氯产物CaCl2可能发生如下水解反应:
CaCl2+ H2O = CaO + 2HCl
CaCl2+ 2H2O = Ca(OH)2+ 2HCl
水解反应可能导致钙基吸附剂脱氯性能降低,但CaCl2的水解是一个吸热反应,一般在650 ℃以上开始,因此为降低水蒸气对脱氯效果的影响,反应温度不宜过高。
2 实验部分
2.1 实验所用原料、试剂和仪器

表1 原材料表
2.2 实验方法
2.2.1 样品制备方法
样品制备方法采用滚球成型,配方中有较多含量的钠盐,混捏过程中会导致物料变硬,无法正常挤出。
首先100 g左右混合均匀的原料在转鼓内进行喷水,滚成1 mm直径左右的小种子, 小种子要尽量滚圆滑;然后加入适量种子,加水加料,掌握好比例与速度,滚成2~3 mm的成品,让成品在转鼓内继续滚动2~3 h以增加强度。通过调整物料及水的平衡,筛分出均匀的球体,滚球结束后,样品进行自然养生48 h以上,然后烘箱120 ℃干燥1~2 h,烘箱500 ℃焙烧2 h。
2.2.2 样品评价方法
评价装置如图2。

图2 评价装置图
采用图中装置进行评价。二氧化碳、氧气、氮气混合气体经质量流量计精确控制流量,通入盐酸中带出HCl气体,经干燥剂脱水后进入反应管,出口放空,每隔一定时间检测出口气体氯含量,检测时接HCl气体检测管(量程1~30 mg/m3)。当出口氯质量浓度大于1 mg/m3,即HCl气体检测管有读数时视为穿透,停止实验。反应后取出废剂,混匀后用银量法滴定并计算出废剂中的氯含量。
2.3 自制脱氯剂
2.3.1 脱氯剂制备
采用以下配比进行实验室的成型研究和性能考察:
1#样品:产品的基础配方,成型过程比较顺利,但样品的强度较差。
2#样品:在1#配方基础上进行调整,加入氢氧化钙。成型过程顺利,样品强度较好。
3#样品:替换1#样品中的黏土,有膨润土替换为凹凸棒土,样品不宜成型。说明使用凹凸棒在此配方下不易成型,确定产品黏土使用膨润土。
4#样品:对1#样品进行重复实验,考察样品强度,强度依然较差。
5#样品:保持氢氧化钙10%的加入量,调整配方,成型过程较为顺利,样品强度较好。
6#样品:提高黏土含量至30%,考察成型效果。由于此样品在成球过程中加料过快,在晾晒以后,有明显的开裂情况,且样品反碱情况严重。
7#样品:降低样品中氢氧化钙含量至5%,考察成型效果。成型后样品强度较好。
8#样品:对6#样品进行重复考察,控制加料速度,考察是否有开裂和反碱的情况。成型后样品没有开裂情况,但反碱情况依然很严重。
2.3.2 成型结论
①使用凹凸棒成型效果较差,确定黏土使用膨润土。
②提高黏土含量,容易造成反碱,无法进行成型。
③对成型后样品进行强度测试,加入氢氧化钙的2#、5#、7#样品强度较好,可以满足要求,分析原因,氢氧化钙遇水有变硬的反应,可能有利于提高强度,最终配方中需加入氢氧化钙。
2.4 自制样品的活性评价
对成型效果较好的三批次样品进行脱氯活性评价,结果如表2。

表2 自制样品脱氯评价结果
使用钠改性的钙镁体系高温脱氯剂具有较高的脱氯效果。
3 结 论
以碳酸钙及氢氧化钙为主要组分的重整高温脱氯剂,经过纳改性,具有较高的脱氯效果。其成型采用滚球成型,可以有效防止钠在混捏过程中的吸水变硬,改性后,提供碱性体系,促进脱氯反应发生。

