基于低压静电场及高通量测序技术对中华管鞭虾(Solenocera crassicornis)保鲜过程中微生物群落影响分析*
沐楠智 谢 超① 吴玉婷 周卓颖 张海玲
(1. 浙江省海产品健康危害因素关键技术研究重点实验室 浙江海洋大学食品与药学学院 浙江舟山 316022; 2. 舟山汇丰冷藏物流发展有限公司 浙江舟山 316002)
中华管鞭虾(Solenoceracrassicornis)隶属于甲壳纲(Crustacea), 真软甲亚纲(Eumalacostraca), 十足目(Decapoda), 管鞭虾科(Solenoceridae), 管鞭虾属(Solenocera), 是我国重要的水产养殖种类, 因通体呈红色又称红虾, 甲壳薄且光滑, 触角鞭呈管状, 主要分布于我国东南海。中华管鞭虾含有多种人体必需氨基酸的高蛋白低脂肉类, 且富含镁、碘、磷和钙等矿物质, 具有较高营养价值(李志鹏, 2022)。新鲜虾肉含水量较高且质地柔软, 容易受微生物污染从而发生腐败变质, 影响虾肉感官品质(崔蓬勃等, 2022),研究其贮藏和运输过程中的保鲜及维持其优良品质的加工工艺, 具有较好的理论意义和生产方面的重要实际应用价值。但传统纯培养技术获取微生物量低,细菌总数无法准确地表达微生物对水产品腐败变质的影响, 不足以深入探讨样本微生物多样性及群落结构。因此需引用基于16S rRNA 的现代分子生物学技术的高通量测序技术准确测定水产品微生物群落组成成分变化。研究发现, 捕获和贮运过程中水产品初始微生物种群的丰度较低、多样性高, 在一定的贮藏环境中, 小部分优势菌群表达出对水产品极高的致腐能力, 导致水产品质变。低温贮藏水产品中常见的腐败微生物有假单胞菌属(Pseudomonas)、肉食杆菌属(Carnobacterium)、希瓦氏菌属(Shewanella)和沙雷氏菌(Serratia)等(王航, 2016), 原料来源、种类和贮藏条件等因素均能影响水产品中的菌属组成(蓝蔚青等, 2020)。
电场保鲜是一种电场对食品非热加工的保鲜技术, 分为高压静电场技术(HVEF)和低压静电场技术(LVEF)。HVEF 电场场强高于2 500 V/m, LVEF 电场场强低于2 500 V/m。电场保鲜技术可以影响到细胞膜电位效用, 使细胞膜电位发生变化, 进而影响到生物体的生化反应(丹阳等, 2004)。根据不同输出模式分为静电场、交变电场、脉冲电场和感应电场, 该技术最早应用于果蔬保鲜, 能够影响果蔬的冰温点, 减缓其成熟过程中乙烯产生量, 延缓水产品和肉制品的腐败变质速率。内源性酶对冷藏过程中水产品的品质有重要影响, 改变鲜度和促进微生物生长(章骞等,2021)。低压静电场可以与细胞内水分子产生共振, 改变水分子与酶的结合状态, 进而影响到酶活性; 高压静电场能够使空气产生微量臭氧和负离子, 这些物质作用于果蔬可以抑制其呼吸。电场处理能够降低微生物细胞表面的平整度, 使细胞生物膜丧失活性, 从而抑制微生物生长繁殖(段伟文, 2019)。低压静电场能减缓蛋白质的降解, 较好地维持虾肉原本的口感,抑制虾肉中腐败微生物的生成, 延长对虾的货架期(张珊等, 2020)。
水产品贮藏后期的关键腐败菌群仅有少数几种(Nianetal, 2022), 而诸如Quantitative Real-time PCR等常规鉴定方法在检测过程中受多重因素干扰, 在判定中极易出现偏差。如希瓦氏菌属和嗜冷杆菌属等少数优势腐败菌, 仅凭传统方法难以对其群落结构加以全面分析(Zhuangetal, 2023)。高通量测序技术具有低成本、高通量和高准确度优势, 可以对样品中的微生物菌群分布加以准确反映, 并完成对微生物基因的序列测定, 能够更加精准和全面鉴定样品中微生物的单一或全面基因组, 因此已成为当前研究微生物多样性及群落结构差异的重要技术手段, 在多学科领域均有所应用。本文基于高通量测序技术,通过检测中华管鞭虾在电场结合微冻贮藏过程中微生物菌落种群组成成分及丰度的变化情况, 旨在研究电场对微冻虾肉微生物的影响, 深入探讨影响其保鲜效果的微生物群落组成及发育基础信息, 对中华管鞭虾资源的合理开发和利用具有重要意义。
1 材料与方法
1.1 实验材料
以采购自浙江省舟山市沈家门渔港的新鲜中华管鞭虾(Solenoceracrassicornis)作为原材料, 实验虾体长约10~12 cm, 体重约12~15 g。购买以后置于含冰袋的泡沫箱, 在30 min 内运送至实验室。选取体况健康且规格相近的个体用于实验, 蒸馏水冲洗后以无菌棉擦拭表面水分, 平均分为7 组: 分组为新鲜样本(G0), 2 kV、3 kV 及对照组贮藏中期(G1、G2、G3), 2 kV、3 kV、对照组贮藏末期(G4、G5、G6)。
1.2 实验试剂
实验所需主要试剂包括DNA 提取试剂盒(QIAamp Fast DNA Stool Mini Kit) (上海赛百盛公司)、TransStart Fastpfu DNA Polymerase (TransGen AP221-02) (北京全式金生物公司)、AxyPrep DNA 凝胶回收试剂盒(AXYGEN 公司)。
1.3 主要仪器设备
试验所需主要仪器设备包括微量检测仪Microplate Reader (美国MD 公司)、QuantiFluorTM-ST蓝色荧光定量系统(Promega 公司)、ICS-1600 型离子色谱仪 (美国戴安公司)、MiSeq PE300 测序平台(美国Illumina 公司)、GeneAmp® 9700 型PCR 仪(美国ABI 公司)。
1.4 实验方法
1.4.1 样品预处理 将各组样品清水洗净后, 在干净无菌操作台上沥干水分, 将贮藏25 d 的3 组虾肉和新鲜虾肉剪碎, 各组称取0.5 g 样品进行破碎处理,37 °C 培养箱中放置48 h。取各组贮藏样品及新鲜样品进行基于细菌16S rRNA 高通量测序, 对中华管鞭虾微生物群落进行提取分析。
1.4.2 DNA 提取 将采集的各组样品(新鲜样本及2 kV、3 kV、对照组贮藏中期和贮藏末期)进行0.22 μm 滤膜真空抽滤, 参照DNA 提取试剂盒说明书提取中华管鞭虾虾肉中微生物中总基因组DNA, 用1%体积分数琼脂糖凝胶电泳检测分析DNA 完整度,采用Microplate Reader 微量检测仪来检测提取所得DNA 的质量纯度, 并将合格的基因组DNA 保存于-80 °C 储存备用。采用细菌16S rRNA 基因V3-V4区进行PCR 扩增, 测试区域为338F_806R, 细菌引物为338F (5’-ACT CCT ACG GGA GGC AGC AG-3’)和806R (5’-GGA CTA CHV GGG TWT CTA AT-3’)。
1.4.3 PCR 扩增 根据张欣等(2017)的方法进行PCR 扩增, 采用TransStart Fastpfu DNA Polymerase,20 µL 反应体系进行PCR 试验, 5×FastPfu buffer 4 μL,2.5 mmol/L dNTPs 2 μL, 正向与反向引物各0.8 μL,浓度均为5 μmol/L, TransStart FastPfu DNA Polymerase 0.4 μL, DNA 模板2 μL, ddH2O 补充至20 μL, 27 个循环, 72 °C 10 min。每个样本3 个重复, 2%浓度琼脂糖凝胶电泳检测PCR 产物混合物, 使用AxyDNA 凝胶回收试剂盒回收所得PCR 产物, 使用Tris-HCl 对其进行洗脱。
1.4.4 Miseq 文库构建及测序 采用Illumina MiSeq PE300 测序平台高通量并行对核酸片段进行深度测序。采用可逆性末端边合成边测序反应, 首先在DNA片段两端加上序列已知的通用接头构建文库, 每条片段经过桥式PCR 扩增形成一簇, 在碱基延伸过程中每个循环反应只能延伸一个正确互补的碱基, 经过多个循环后完整读取核酸序列。将PCR 产物用QuantiFluor™-ST 蓝色荧光系统进行检测定量, 根据每个样本的测序量标准混合。由上海美吉生物医药科技有限公司协助完成后续检测。
1.4.5 数据处理 本实验的理化数据处理采用SPSS 22.0, 采用Origin 9.0 作图, 实验结果显示为平均值±标准差, 采用Duncan 模型进行比较检验, 得出显著性差异。高通量测序部分实验使用fastp 软件对原始序列加以质控, 采用FLASH 软件进行拼接,根据97%相似度对序列进行OTU 聚类, 并对嵌合体加以剔除。逐条对序列进行物种分类注释, 比对Silva 16S rRNA 数据库, 将比对阈值设置为70%。
2 结果与讨论
2.1 样品测序信息分析
采用高通量测序技术对不同贮藏环境不同贮藏时期的7 个虾肉样本的16S rRNA 基因区进行微生物多样性检测分析, 获得细菌总优化序列325 540, 碱基平均长度428 bp (表1)。OTU (operational taxonomic units)是在系统发生学或群体遗传学研究中人为地给分类单元(品系、属、种等)设置的标志(徐国栋等,2023)。通常在97%的相似水平下的OTU 进行生物信息统计分析, 相似度在95%以下则可以判定为不同菌属(许小璐, 2021)。结合表2 的OTU 序列数统计表和表3 的OTU 分类学信息表来看, 在-5 °C 微冻贮藏条件下电场组与对照组虾肉中微生物群落均为细菌。虾肉的蛋白质和水分含量高, 细菌的快速生长繁殖是虾肉腐败变质的主要因素, 但细菌总数无法准确地表达微生物对水产品腐败变质地影响, 需进一步测定水产品微生物群落组成成分变化。

表1 不同电场强度处理下中华管鞭虾序列数据统计Tab.1 Statistics of S. crassicornis sequence data under different electric field intensities
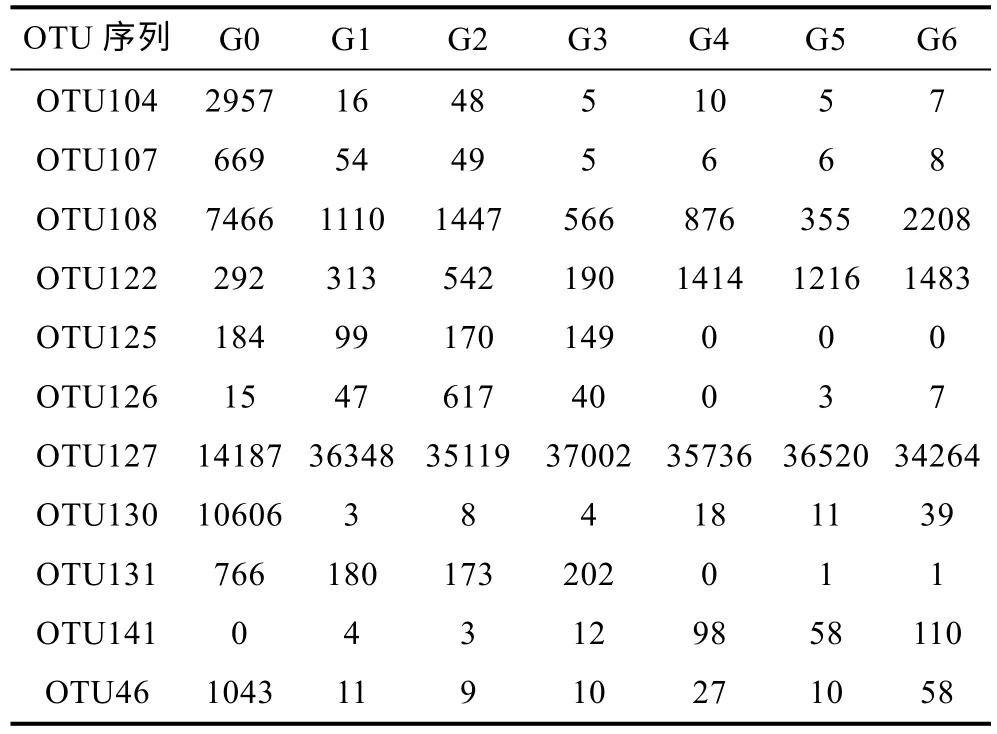
表2 主要OTU 序列数统计表Tab.2 Statistics of main OTU sequences

表3 主要OTU 分类学信息表Tab.3 Taxonomic information of main OTU
从门水平来看, 优势菌群为变形杆菌门(Proteobacteria)和厚壁菌(Firmicutes); 从纲水平来看,优势菌群为芽孢杆菌纲(Bacill)和丙种球蛋白菌纲(Gammaproteobacteria); 从目水平来看可知交替单胞菌目(Alteromonadales)和乳杆菌目(Lactobacillales)为优势菌群, 同时虾肉中还有少部分假单胞菌目(Pseudomonadales)和芽孢杆菌目(Bacillales); 从科角度可以看出假单胞菌科(Pseudoalteromonad)和李斯特菌科(Listeriaceae)在菌群中具有一定优势, 同时虾肉中还存在莫拉氏菌科(Moraxellaceae)、肉杆菌科(Carnobacteriaceae)和葡萄球菌科(Staphylococcaceae)。该试验中属水平有假交替单胞菌属(Pseudoalteromonas)、假单胞菌属(Pseudomonas)、嗜冷杆菌属(Psychrobacter)和热杀索丝菌属(Brochothrix)等。
2.2 物种韦恩图分析
物种韦恩图中不同圆圈代表不同样本, 圆圈重叠处标定数字表示样本间共有的物种数。图1 为2 kV组、3 kV 组和对照组贮藏15 d 和25 d 时属水平下的物种韦恩图, 由图1 可得出, 与对照组相比, 电场组可有效的保持物种个数, 随着贮藏时间的延长, 3 组物种个数均有不同程度的减少, 随着优势菌的生长繁殖, 在贮藏末期, 虾肉微生物物种多样性不断下降;在贮藏中期G2 物种个数最多, G1 次之, 随着蛋白质分解和水分流失G3 微生物群落中优势菌大量生长,其他菌种生长空间减少, 导致物种多样性快速下降;贮藏末期G4、G5 和G6 3 组物种个数相近, 此时优势菌在三种贮藏环境中均显示出明显的优势。综上, 贮藏前中期电场能够抑制优势菌的生长, 维持虾肉微生物物种间的平衡, 使腐败微生物的生长受到阻碍,延缓了虾肉的腐败进程, 且3 kV 的抑菌效果较为明显, 贮藏末期时由于虾肉腐败严重, 虾肉微生物物种大量减少, 优势菌更能适应腐败环境, 电场对物种多样性的影响不大。施加电场对虾肉的前中期贮藏有积极的促进作用, 防止了腐败微生物优势的形成, 保护了虾肉前中期的外观状态。

图1 贮藏中期和贮藏末期微生物物种韦恩图Fig.1 Venn diagram of microbial species in the middle and end storage
2.3 Alpha 多样性分析
Alpha 多样性分析中Sobs 指数代表检测到的物种数; Ace 和Chao 指数均表明物种丰度, 且数值越大表明物种种类越多; Shannon 和Simpson 指数表明物种的丰富度和均匀程度; Coverage 指数可表明低丰度OTU 的覆盖情况, 其数值越接近于1 表明菌群测序覆盖率越高, 越能较好地进行菌落多样性分析(张溪,2021)。从表4 中7 个样本的五类指数可以得出, 7 个样本菌群测序覆盖率均>0.999, 测序深度适宜, 可满足对虾肉物种多样性的分析。对于Sobs、Chao、Ace指数, 电场组均大于对照组, 且前中期 3 kV 组与2 kV 组相比较, 3 kV 组物种丰度和物种种类高于2 kV 组, 末期电场组物种丰度和物种种类也略高于末期对照组。对于Simson 指数, 除新鲜样本外的6组数值相近, 虾肉微生物各物种个体数目分布均匀度一致, 对于Shannon 指数。说明贮藏前中期微冻结合电场抑制了一些非嗜冷菌的生长, 同时延缓了优势菌的大量生长繁殖, 维持虾肉中的微生物种类多样性稳定性, 在贮藏末期电场组与对照组相差不大,说明电场在贮藏末期对物种多样性影响较小, 这与上述物种韦恩图结果一致。微冻结合3 kV 电场在虾肉贮藏过程中更能较好维持微生物物种多样性, 减缓腐败优势菌的快速生长。
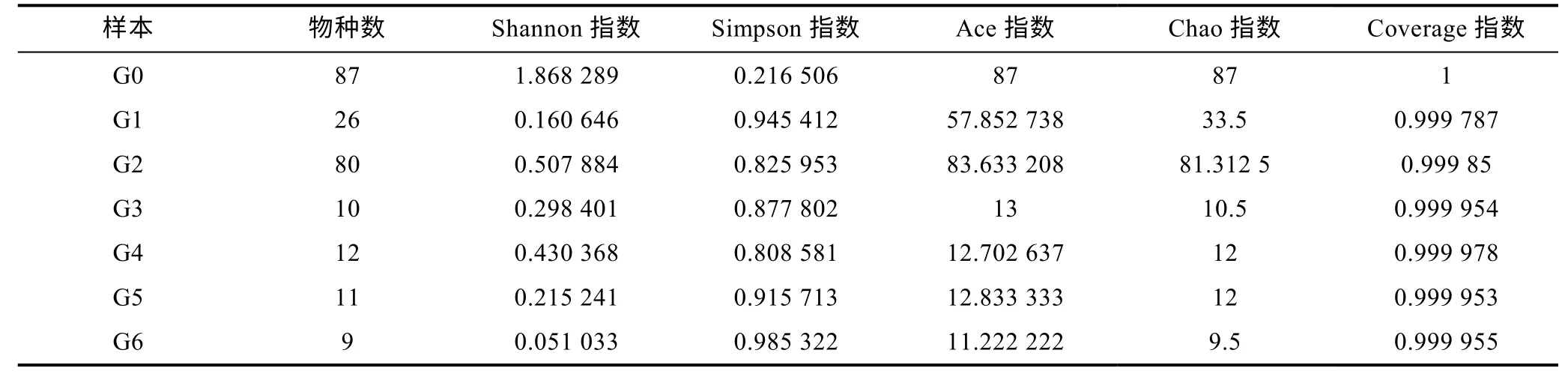
表4 多样性指数分析表Tab.4 Analysis of diversity index
稀释性曲线用来比较测序数据量不同的样本中物种的丰富度, 同时说明样本的测序数据量是否合理(程依梦, 2022)。由图2 中稀释曲线图可以得出, 当样本序列超过30 000 时, 各组的曲线趋向平坦, 这即说明该测序的数据量是在合理范围内, 如果再添加更多数据则产生的新物种数量极少。对于G0 和G2样品, 抽样数<10 000 时, 样本所检测出的OTU 数量随抽样数的增加而快速上升, 抽样数>10 000 后,OTU 数量的上升较为则缓慢且曲线逐渐趋于平坦,同时G0 和G2 变化趋势相近, 说明前中期3 kV 的电场能够维持微生物物种平衡, 虾肉得到较好的贮藏。Rank-Abundance 曲线可以表明物种的丰富度和均匀度(樊英等, 2021), 物种多样性越高曲线下降越平滑,优势菌群所占比例较高时, 曲线会呈现陡然下降的趋势。由图2 中Rank 曲线可得, G0 和G2 横轴上最长, 下降平缓, 物种组成较为均匀, 其他几组下降曲线陡峭程度相近。可能是因为贮藏初期虾肉腐败变质较轻, 生化环境较为稳定, 虾肉中有较多的菌种生长繁殖, 电场释放电荷影响微生物表面生物膜稳定性从而抑制微生物正常生长代谢(沈俊等, 2022)。
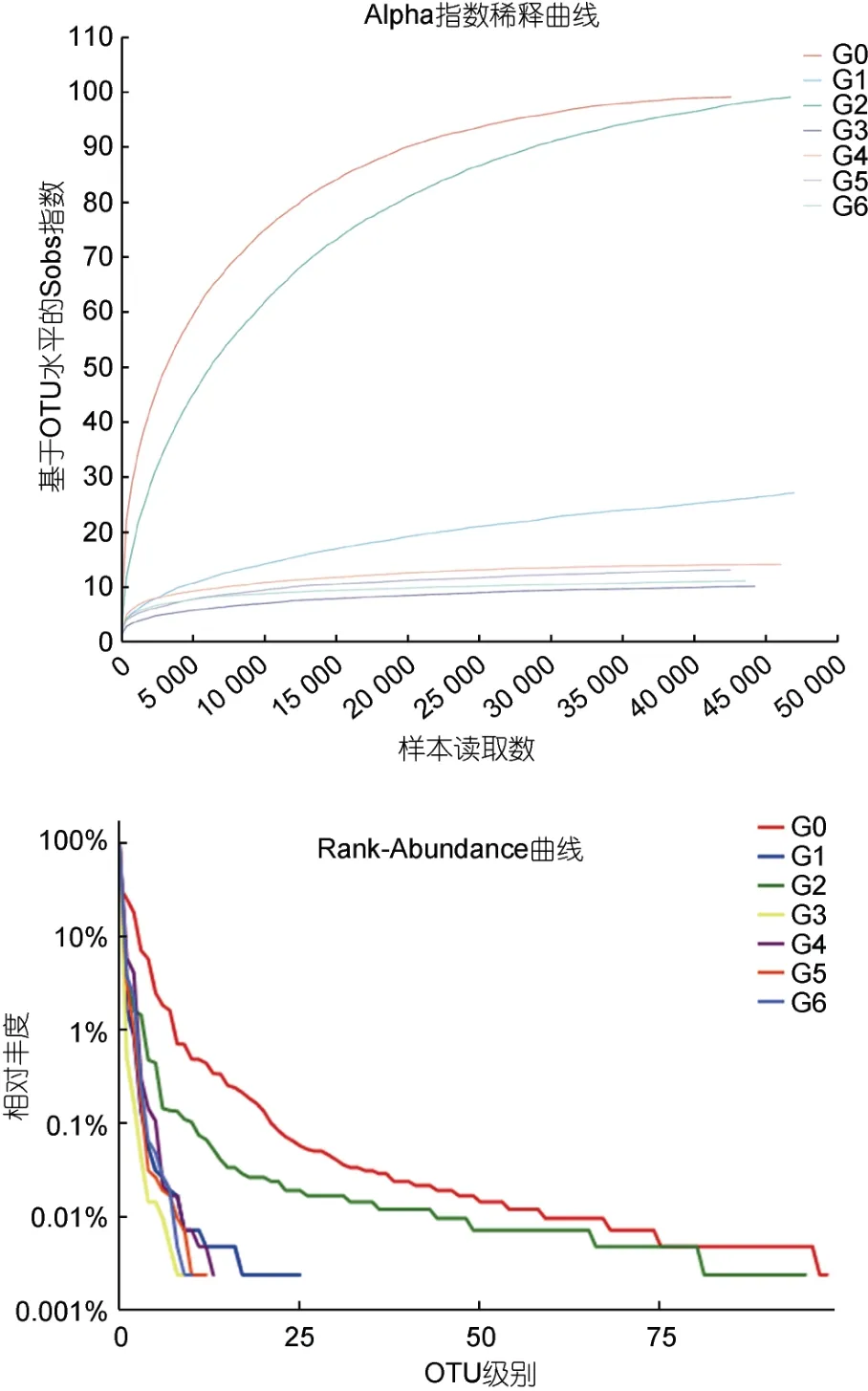
图2 Alpha 指数稀释曲线和Rank-Abundance 曲线Fig.2 Alpha index dilution curve and Rank-Abundance curve
2.4 物种组成分析
由图3 可以得出, 新鲜虾肉中微生物群落结构丰度最高的为假交替单胞菌属(Pseudoalteromonas)、假单胞菌属(Pseudomonas)和热杀索丝菌属(Brochothrix),且三者占比相近, 在-5 °C 微冻贮藏环境中, 中华管鞭虾虾肉中的优势微生物变为假交替单胞菌属(Pseudoalteromonas), 而贮藏中后期6 个样本假交替单胞菌占比微生物群落结构超过了85%, 可能是虾肉在贮藏过程中蛋白质解构, 水分迁移, 盐类物质大量析出, 假交替单胞菌属更能适应此时的温度和生化环境,分解虾肉蛋白质和脂肪, 并产生大量挥发性物质, 从而造成感官评分的下降(Broekaertetal, 2017); Li 等(2022)在对太平洋白虾贮藏过程腐败菌生长的研究中也得出相似结论。如图4 所示, 选择所有样本中丰度排名前10 物种。图中左半圆表示分组, 右半圆表示物种。从物种到分组连线的宽度表示分组中物种的相对丰度。左半圆的外环, 颜色表示分组; 右半圆的外环,颜色表示物种, 环的长度表示物种的丰度(史恬恬等,2022), 共线性关系图可以更直观地观察物种丰度和数值占比。本文研究表明, 在贮藏中期施加电场后能够抑制假交替单胞菌成为绝对的优势菌群, 而3 kV 的抑制效果优于2 kV 组, 然而在贮藏后期, 随着虾肉的进一步腐败变质, 3 组菌群中热杀索丝菌属(Brochothrix)和肉食杆菌属(Carnobacterium)占比有所增加, 3 kV 组与2 kV 组增加较少, 对照组增加最为剧烈, 可能是长期的贮藏过程中虾肉腐败环境发生变化, 有利于其生长, 贮藏后期电场强度对微生物种群多样性影响不大,但可能抑制了热杀索丝菌属的生长。
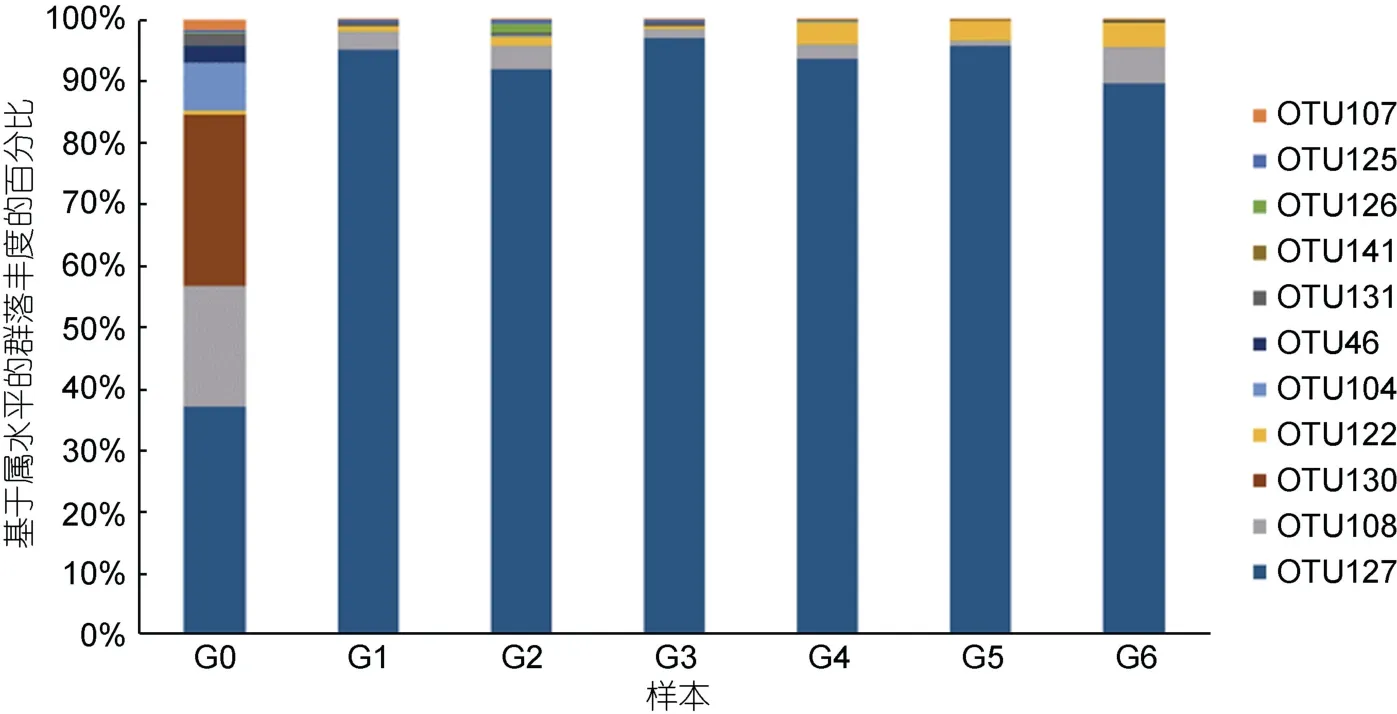
图3 微生物群落结构图Fig.3 Structure of microbial community
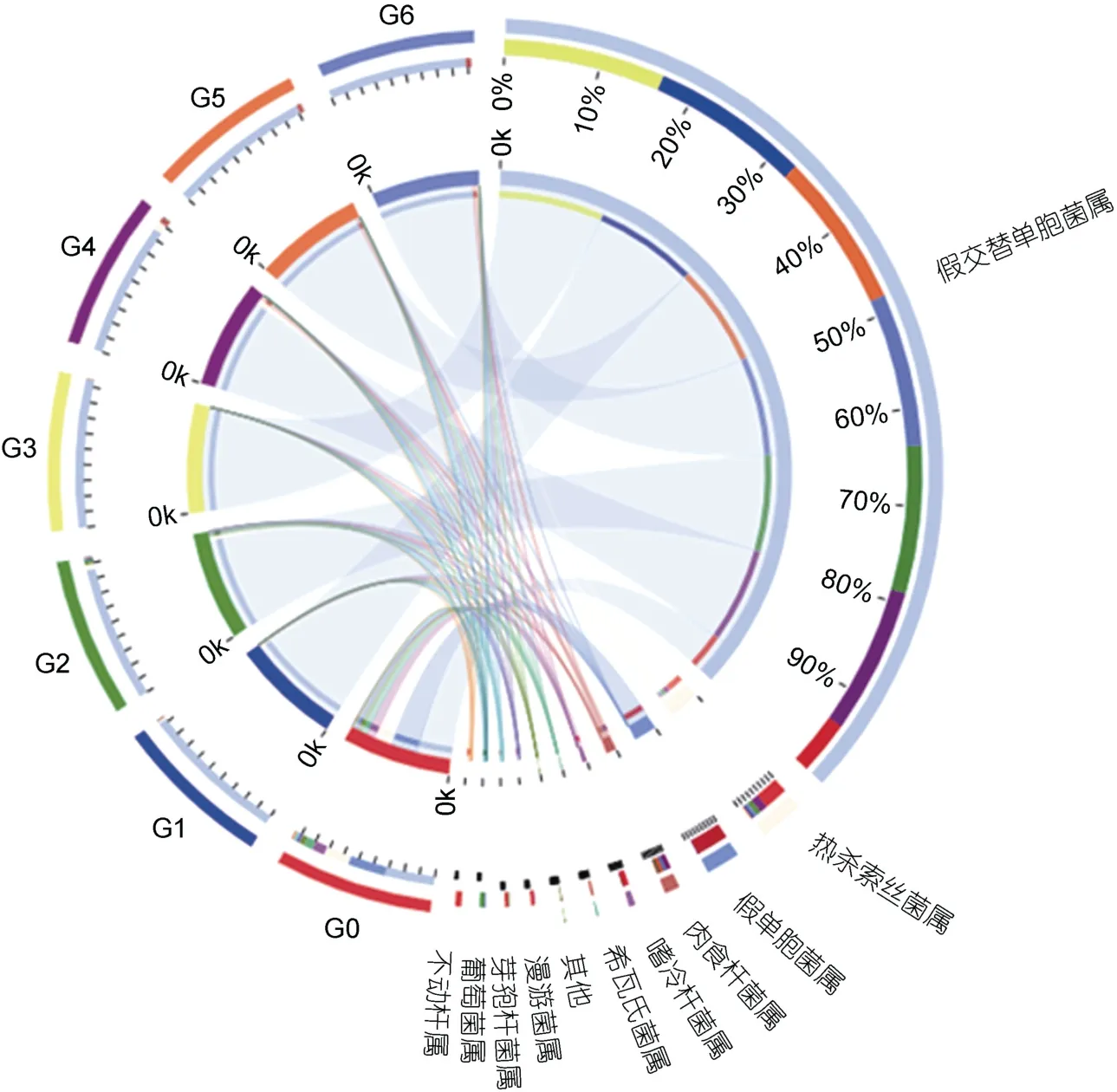
图4 共线性关系图Fig.4 Collinearity diagram
2.5 Beta 多样性分析
β 多样性作为可反映各组样本间群落物种组成差异的指数, 一般由PCA 和PCoA 分析图来展示。PCA分析(principal component analysis), 即主成分分析对数据进行简化分析后找出数据中最具优势性的关健因素及其结构。样本物种组成的相似度高低反映了其在PCA 图中距离的近与远, 点越接近, 其菌群组成就越相似(史恬恬等, 2022)。数据显示贮藏中期G1 和G2 样本间也具有较大差异, 不同电场强度导致物种组成也有较大影响, 由图5 的PCA 图可得, 而G3、G4、G5、G6 间差距小说明在贮藏中期电场对微生物菌群具有一定影响, 并且电场强度的大小对微生物菌群生长的抑制程度不同, 贮藏末期电场强度对样本物种分布无明显影响。PCoA 分析(principal coordinates analysis)研究样本群落组成的差异性, 在这点与PCA 分析类似; 但它们的主要区别在于PCoA 基于所选距离矩阵进行作图, 而PCA 是基于欧氏距离利用物种丰度表直接作图。因此相较于PCA 图, PCoA图更能反映7 个样本间的区别。由图5 的PCoA 分析图可得, 贮藏中期的G1、G2、G3 组有一定距离且较为接近, 贮藏末期的G4、G5、G6 组较为接近, 说明在同一贮藏期间的几组微生物种群结构相近, 除此之外, 可以看出在坐标系中贮藏中期的3 组相较于贮藏末期的3 组更为分散, 说明在贮藏中期电场强度对微生物种群的影响较大, 而贮藏末期贮藏时间对种群影响度较大。

图5 PCA 主成分分析和PCoA 主成分分析图Fig.5 PCA principal component analysis and PCoA principal component analysis diagram
3 结论
本研究采用高通量测序技术对不同贮藏时期各组虾肉微生物群落碱基进行基因测序, 产生的碱基序列通过OTU 聚类、多样性分析、相关性分析等手段分析, 得到微生物发育信息和群落组成变化规律,研究不同电场环境(2 kV、3 kV、0 kV)对虾肉微生物群落组成的影响, 结论如下:
(1) OTU 分析中属类有假交替单胞菌属(Pseudoalteromonas)、假单胞菌属(Pseudomonas)、嗜冷杆菌属(Psychrobacter)和热杀索丝菌属(Brochothrix)等。根据菌属相对丰度结果, 虾肉在贮藏过程中蛋白质解构, 水分迁移, 盐类物质大量析出, 假交替单胞菌属(Pseudoalteromonas)更能适应高盐浓度环境, 分解虾肉蛋白质和脂肪并产生大量挥发性物质造成感官评分的下降, 是中华管鞭虾微生物腐败主要致腐菌。随着贮藏时间的延长, 3 组物种个数均有不同程度的减少, 随着优势菌的生长繁殖, 虾肉微生物物种多样性不断下降; 在贮藏中期3 kV 组物种个数最多,2 kV 组次之, 对照组中优势菌大量生长, 减少其他菌种生长资源与空间, 导致物种多样性快速下降; 贮藏末期3 组物种个数相近, 此时优势菌在三种贮藏环境中均显示出明显的优势。综上, 贮藏前中期电场能够抑制优势菌的生长, 使得虾肉微生物物种多样性较高, 且3 kV 更佳, 贮藏末期3 组物种结构相近, 电场对物种多样性的影响不大。
(2) PCoA 主成分分析图中发现, 在坐标系中贮藏中期的G1、G2、G3 组距离较为接近, 贮藏末期的G4、G5、G6 组距离较为接近, 说明在同一贮藏期间的各组微生物种群结构类似。综上, 贮藏前中期电场能够抑制优势菌的生长, 使得虾肉微生物物种多样性较高, 且3 kV 更佳, 贮藏末期时电场对物种多样性的影响不大。

