漂白粉消毒后对虾养殖源水细菌群落的响应特征研究*
王庚申 颜 懿 李 彤 董鹏生 谢建军许文军 张德民 张化俊 ①
(1. 宁波大学 农产品质量安全危害因子与风险防控国家重点实验室 浙江宁波 315211; 2. 宁波大学海洋学院 浙江宁波 315211; 3. 浙江省海洋水产研究所 浙江省海水增养殖重点实验室 浙江舟山 316021)
为了防控凡纳滨对虾(Litopenaeusvannamei)的传染性疾病, 对源水消毒是养殖的关键环节之一。漂白粉是对虾养殖源水消毒中常用的一种卤素类消毒剂, 具有价格低、杀菌力强、使用方便等特点。漂白粉是氢氧化钙、氯化钙、次氯酸钙的混合物, 溶解在水中时水解成次氯酸离子和氯离子。次氯酸离子的强氧化作用可以杀死细菌, 氯离子也表现出一定的杀菌功能(Maetal, 2019)。研究表明, 大多数病原对次氯酸钙敏感, 且杀菌效果与剂量有关(Parketal, 2004;Limsuwanetal, 2008; Chaetal, 2012)。一般认为, 对养殖源水消毒可以有效去除病原微生物, 但由于消毒机制的非特异性, 水体中的有益微生物也会被杀灭。由于细菌类群生理及群落组成的多样性, 水体中不同的微生物类群会对消毒表现出不同的响应或恢复能力(Becerra-Castroetal, 2016)。目前, 对消毒后养殖源水细菌群落的恢复动态仍知之甚少。
抗生素抗性基因(antibiotic resistant genes, ARGs)可以通过水平转移将移动遗传元件转至病原菌中,使病原菌产生抗生素抗性, 威胁公共卫生健康(Joet al, 2021)。由于河流汇入及水产养殖活动, ARGs 在近海海区环境中普遍存在(Hedbergetal, 2018), 近海养殖源水是对虾养殖池塘环境中ARGs 的主要来源(夏涛涛等, 2022), 在华南及华东地区的对虾养殖源水中均检测到了多种养殖中常见抗生素的ARGs (Wangetal, 2019a; Yuanetal, 2019)。近几年, 城市污水、饮用水处理领域的研究显示, 氯消毒可以有效降低水中的ARGs 丰度(Yoonetal, 2017; Wangetal, 2020), 水产养殖用水消毒的研究也证实了这一点(赵晓雨等,2021)。但氯消毒不能完全去除水体中的ARGs (Yuanetal, 2015), 即使携带ARGs 的细菌被杀灭, ARGs 仍可以释放到水环境中通过水平转移进行传播(姜瀚集等, 2019)。然而, 关于养殖源水消毒后ARGs 丰度的动态变化规律尚未见报道。
养殖水体细菌群落是对虾养殖系统的重要组成,对维持水质稳定及对虾健康具有重要意义(杜世聪等,2019)。一般认为, 源水进入养殖系统后除改善水体理化因子外, 也会影响水体微生物群落组成(Heyseetal,2021)。有研究报道氯消毒会引起水体细菌类群的异常增殖, 当消毒后病原菌和耐抗生素细菌增殖时, 可能导致潜在的微生物健康风险(Linetal, 2016; Dengetal, 2019; Wangetal, 2021a)。因此, 了解漂白粉消毒后养殖源水细菌群落、病原菌及抗生素抗性基因的恢复动态, 尤其是不同消毒浓度的影响, 对优化对虾养殖系统微生物管控策略具有重要的指导作用。基于此, 本研究利用不同浓度漂白粉消毒养殖源水, 通过高通量测序比较消毒前后养殖源水的理化因子、细菌群落结构及病原菌丰度变化, 同时利用RT-qPCR 检测养殖源水ARGs 的丰度变化, 探究源水细菌群落对不同浓度漂白粉消毒后的响应特征, 以期为对虾养殖生产中漂白粉的使用提供理论基础。
1 材料与方法
1.1 实验材料与设计
本实验在浙江省海洋水产研究所试验场进行,实验用对虾养殖源水取自周边海域, 温度27.3~ 27.9 °C,盐度25.5~25.7, pH 8.25~8.21。漂白粉购自湖北省应城市利必康化工有限公司, 有效氯含量28%~35%。
实验在室内300 L 塑料水槽中进行, 共设置2 个高、低漂白粉消毒浓度: 60、20 mg/L, 每组4 个重复。消毒前(DC)、消毒后余氯衰减至0.1 mg/L 时0~3 d(D0、D1、D2、D3)定时取2 L 水样, 1 L 用于水质理化指标测定; 1 L 用0.22 μm 滤膜过滤后保存于-80 °C,用于检测微生物和抗性基因。
采用HANNA HI-97734 余氯和总氯便携光度计(DPD 法, 量程0.00~10.00 mg/L, 精度为±0.03 mg/L)测定水体中的余氯浓度; 用YSI Pro2030 测定水体溶解氧, YSI Pro10 测定水体pH。水体理化因子化学需氧量(COD)采用碱性高锰酸钾法, 氨氮采用靛酚蓝分光光度比色法, 亚硝酸盐氮(NO2-N)采用萘乙二胺分光光度法, 硝酸盐氮(NO3-N)采用锌-铬还原法, 活性磷酸盐(AP)用磷钼蓝分光光度法测定。
1.2 DNA 提取、高通量测序
使用PowerSoil ®Pro Kit (Qiagen)试剂盒提取水样DNA, 通过0.8%琼脂糖凝胶电泳检测提取DNA 的质量, 用紫外分光光度计检测DNA 的浓度和纯度。用带Barcode 的338F (5′-ACTCCTACGGGAGGCAGC AG-3′)和806R (5′-GGACTA CHVGGGTWTCTAAT-3′)引物对细菌16S rRNA 的V3~V4 区进行PCR 扩增。PCR 扩增条件: 98 °C 预变性30 s; 98 °C 变性15 s,50 °C 退火30 s, 72 °C 延伸30 s, 27 个循环; 72 °C 延伸5 min。反应体系(25 μL): 5 μL 5×High GC Buffer、5 μL 5×Reaction Buffer、2 μL 10 mmol/L dNTPs、2 μL引物(10 μmol/L )、0.25 μL FastPfu 聚合酶; 2 μL 模板DNA, 灭菌双蒸水补足25 μL。PCR 产物经纯化、定量后, 使用TruSeq Nano DNA LT Library Prep Kit 建库, 构建的文库经质检和定量后, 使用 Illumina NovaSeq 平台PE250 进行双端测序。
1.3 测序数据处理
使用QIIME2 2021.2 版本对原始数据进行质量控制, 去除接头, 利用DADA2 插件去噪, 并生成扩增子序列变体(ASV)表。以每个ASV 中丰度最高的作为代表序列, 在SILVA138 数据库中比对确定其所属类群。去除叶绿体(Chloroplast)、线粒体(Mitochondria)及未被鉴定的ASVs, 共获得了2933 个ASVs。
1.4 水环境细菌病原数据库分析
将实验样品中每个ASV 的代表序列在水环境细菌病原数据库(DPiWE, dayuz.com) (董鹏生等,2021)进行BLAST 比对、注释, 参数阈值E-value<1×10-6, 序列同源性>98.5%, 最后输出病原菌比对信息, 共比对获得病原菌169 个ASV。由于数据库注释信息的差异, 所得病原菌序列以病原菌库的注释信息为准。
1.5 抗性基因检测
采用Real-time qPCR 方法对常见的8 种ARGs(表1)进行定量分析。qPCR 在罗氏LightCycler480 上使用AceQ qPCR SYBR Green Master Mix (Vazyme)进行, 反应体系: 10 μL 2×SYBR real-time PCR premixture、0.8 引物(10 μmol/L)、1 μL 模板DNA, 灭菌双蒸水补足20 μL。PCR 反应条件: 95 °C 5 min;95 °C 15 s, 55~62 °C 30 s, 72 °C 30 s, 40 个循环, 之后进行熔解曲线分析。通过Ct 值和标准曲线计算基因拷贝数, 以每毫升养殖源水的拷贝数来测定ARGs 的浓度。

表1 抗生素抗性基因及RT-PCR 引物Tab.1 Antibiotic resistance genes and RT-PCR primers
1.6 统计分析
通过Bray-Curtis 距离进行非度量多维尺度分析(NMDS)分析, 展示漂白粉消毒后水体细菌群落的演替规律。基于Bray-Curtis 距离的相似性分析(ANOSIM)分析各组细菌群落的相似性。通过R 中的“pheatmap”软件包绘制热图。使用“psych”软件包计算类群相关性矩阵, 保留皮尔森相关性系数|r|>0.6, 且P<0.05 的数据矩阵, 使用Gephi(v0.9.2)构建微生物群落的共现网络, 并进行加权随机模块化网络分析。利用SPSS 20.0 在用单因素方差分析(one-way ANOVA)分析样品间ARGs 丰度的差异(P<0.05)。
2 结果
2.1 消毒前后对虾养殖源水水体理化因子变化
实验期间, 对虾养殖源水温度在27.5~32.9 °C,盐度在漂白粉消毒后小幅升高, 高浓度组始终高于低浓度组; 溶解氧、化学需氧量浓度在消毒后(D0)迅速下降并保持稳定; pH、硝酸盐浓度在消毒后(D0)升高随后保持稳定; 亚硝酸盐浓度在消毒后(D0)升高,之后大幅震荡, 氨氮浓度则在消毒后缓慢上升; 活性磷酸盐浓度在消毒后出现分化, 低浓度消毒组始终高于高浓度组(图1)。


图1 消毒前后对虾养殖源水水质理化因子变化Fig.1 Changes of physicochemical factors of shrimp source water before and after bleaching powder disinfection
2.2 消毒前后对虾养殖源水的细菌群落组成
消毒后, 高、低浓度组细菌类群门水平组成均发生了显著的变化, 拟杆菌门(Bacteroidota)的相对丰度较消毒前均显著升高(P<0.05), 高浓度组变形菌门(Proteobacteria)的相对丰度则显著下降(P<0.05) (图2a)。消毒前(DC), 高浓度组养殖源水的主要门类包括变形菌门(53.71%)、拟杆菌门(27.15%)、放线菌门(Actinobacteriota, 9.32%)、Patescibacteria (1.84%)及蓝细菌门(Cyanobacteria, 1.46%)等; 消毒后余氯衰减至0.1 mg/L 时(D0), 优势菌门为变形菌门(25.54%)、拟杆菌门(73.91%)。而低浓度组在消毒前(DC)的主要门类为变形菌门(74.74%)、拟杆菌门(12.76%)、蓝菌门(7.34%)、放线菌门(2.76%)及Patescibacteria (1.55%)等; 消毒后(D0), 优势菌门为变形菌门(69.26%)、拟杆菌门(29.19%)。消毒后第1~2 天, 高浓度组的优势菌门以变形菌门(79.90%、51.17%)、拟杆菌门(19.83%、44.85%)为主, 而低浓度组则以变形菌门为优势菌, 相对丰度达到了98.78%、95.78%。至第3天, 高浓度组的优势菌门均以变形菌门(91.58%)、蛭弧菌门(Bdellovibrionota) (5.17%)、拟杆菌门(2.19%)为主, 低浓度组的优势菌门为变形菌门(87.92%)、蛭弧菌门(6.34%)、拟杆菌门(2.79%)、Patescibacteria(1.67%)。

图2 消毒前后对虾养殖源水细菌群落相对丰度图Fig.2 Relative abundance of bacterial community in shrimp source water before and after bleach disinfection
从属水平看(图2b), 消毒前高低浓度组养殖源水的优势菌属包括Thalassococcus、Nautella、unclassified Stappiaceae、Candidatus_Aquiluna、Erythrobacter、Synechococcus_CC9902、Hymenobacter、Phaeodactylibacter,以上菌属的总相对丰度在高、低浓度组分别占比27.80%、29.61%。消毒后第0~2 天, 高浓度组中薄层菌属(Hymenobacter, 19.77%~73.88%) 和Nautella(5.26%~55.98%)交替占据优势, 第3 天, 薄层菌属丰度迅速下降。而低浓度组中薄层菌属(29.06%)仅在第0 天占据优势,Nautella(37.40%~78.34%)则在第1~2天维持优势。消毒后第2 天, 高、低浓度组的小红卵菌属(Rhodovulum)丰度开始升高, 第3 天在两组中均占据优势(24.08% 、 14.52%), 其次是Nautella(22.00%、12.12%)。
在ASV 水平上(图3), 源水细菌群落中相对丰度最高的50 个ASVs 主要归类于红杆菌科Rhodobacteraceae(16 个)、交替单胞菌科Alteromonadaceae (4 个)、黄杆菌科Flavobacteriaceae (3 个)和Nitrincolaceae (3 个),其中21 个ASVs 在消毒后相对丰度下降, 22 个ASVs相对丰度升高。消毒后, ASV848 (Nautella)在高、低浓度组的相对丰度均较消毒前显著上升, 归类于薄层菌属的ASV1561、ASV953 的相对丰度在第1 天显著升高, 之后开始下降; 红杆菌科的 ASV1480、ASV1249、ASV2053 仅在高浓度组显著下降,ASV1764 (小红卵菌属)则在高浓度组中显著上升。

图3 消毒前后对虾养殖源水中的优势ASVs 热图(相对丰度前50 个ASVs)Fig.3 Dominant ASVs of shrimp source water before and after bleaching powder disinfection (top 50 ASVs in relative abundance)
2.3 消毒前后细菌群落结构演替特征
基于Bray-Curtis 距离的NMDS 分析发现消毒后水体细菌群落与消毒前分区明显, 而高、低浓度组未完全分离(图4); ANOSIM 分析也发现, 消毒前、后细菌群落差异显著(P<0.05), 而消毒后高、低浓度之间差异不显著(P>0.05)。
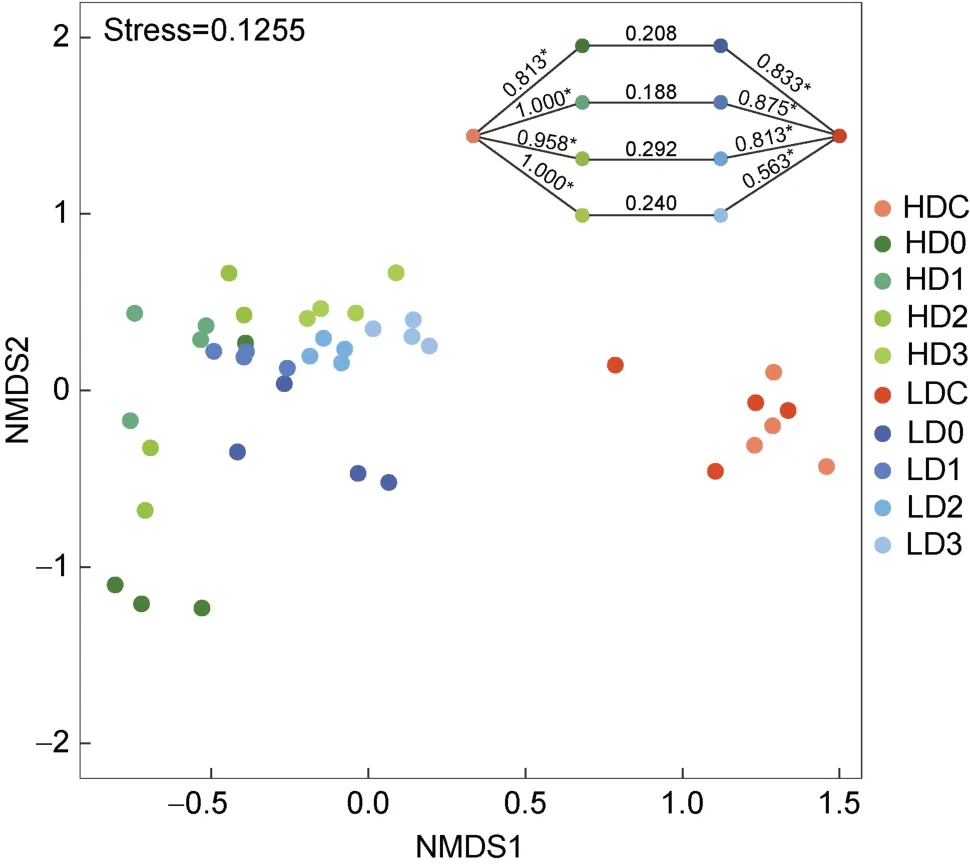
图4 基于Bray-Curtis 距离的NMDS 分析水体细菌群落结构Fig.4 NMDS analysis of bacterial community structure in source water based on the Bray-Curtis distance
2.4 消毒前后水体细菌群落的共现模式
消毒前及高、低浓度组消毒后的水体细菌群落的共现网络包含425、238、348 个节点, 分别由1 776、1 137、1 958 个边连接(图5a~5c, 表2), 说明消毒后节点减少, 低浓度消毒会增加群落间的相互作用。相比消毒前, 消毒后水体细菌群落共现网络的模块化系数、平均聚类系数降低, 而其他网络拓扑学参数则升高; 消毒后, 除了网络直径外, 高浓度组共现网络的平均聚类系数、平均路径长度、平均度均低于低浓度组。高、低浓度组的网络分别由6 个主要模块构成,分别占整个网络的69.74% (9.24%~13.87%)、79.38%(8.33%~18.39%), 而对照组模块较为平均, 模块Ⅰ到模块Ⅵ仅占整个网络的26.6% (4%~4.71%)。
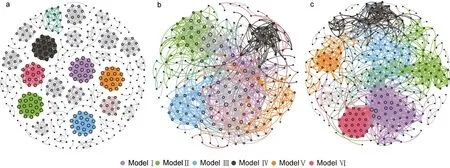
图5 消毒前后水体微生物群落共现网络Fig.5 Co-occurrence network of bacterial communities
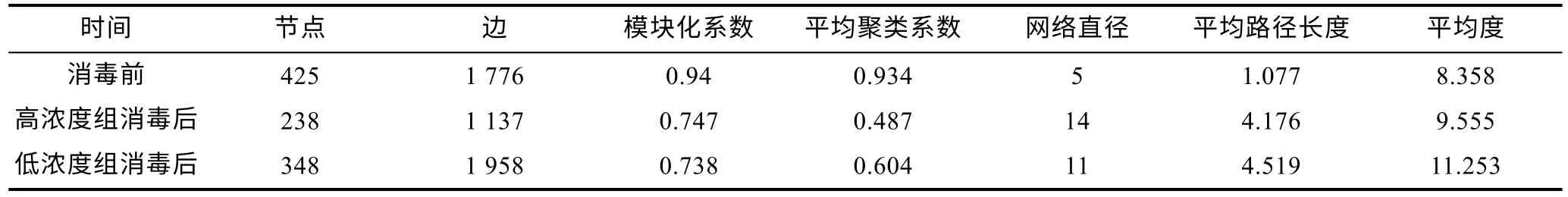
表2 共现网络的拓扑学参数Tab.2 Topological parameters of co-occurrence networks of water bacterial communities before and after bleaching powder disinfection
2.5 消毒前后水体病原菌的组成
使用DPiWE 数据库对消毒前后的水体细菌高通量测序数据进行序列比对和病原菌物种注释, 消毒前水体病原菌有23 属, 总序列数为6 461; 消毒后高浓度组病原菌有37 属, 总序列数为2 912, 低浓度组有31 属, 总序列数为6 584, 说明消毒后病原菌种类增加, 而高浓度组总序列数显著下降。
对虾养殖源水的优势病原菌(平均相对丰度大于0.01%)丰度占总病原菌丰度的95.59%, 其中50%为鱼类病原, 50%为跨宿主共患病病原。消毒前, 优势病原菌为假埃希氏菌(Pseudescherichia, 1.56%)、微球菌属(Micrococcus, 0.53%)、Thalassobius(0.23%)等; 消毒后, 高浓度组的优势病原菌Thalassobius(0.32%)、不动杆菌属(Acinetobacter, 0.10%), 低浓度组则为Thalassobius(0.88%) 、 假 交 替 单 胞 菌 属(Pseudoalteromonas, 0.13%)等。水中优势病原菌在消毒后具有一定时间上的差异, 而Thalassobius在高、低浓度组均逐渐占据绝对优势。值得一提的是, 弧菌属(Vibro)病原菌的相对丰度在消毒后明显下降, 但在源水中仍存在(图6)。

图6 消毒前后病原菌的相对丰度堆积图Fig.6 Relative abundance of pathogenic bacteria before and after bleaching powder disinfection
2.6 消毒前后抗性基因的动态变化
本研究中, 4 大类8 个ARGs 在消毒前的养殖源水中均有检出(图7),tetA 是丰度最高的ARG, 达到107copies/mL,cfr是丰度最低的ARG (102copies/mL),其他ARGs 的丰度在103~104copies/mL 水平。消毒后, 余氯衰减至0.1 mg/L 时(D0), 高、低浓度组sul1、floR、cfr、tetQ 的丰度较消毒前(DC)显著下降(P<0.05),而tetA、strB、cmlA、sul2 的丰度变化趋势在高、低浓度组出现分化。sul1、floR 的丰度均在随后的1~2 d内恢复到消毒前的数量级水平, 而cfr、tetQ 基因在实验期间未能恢复到消毒前的数量级。

图7 消毒前后8 种ARGs 的动态变化Fig.7 Changes of abundances of 8 ARGs before and after bleaching powder disinfection
3 讨论
含氯消毒剂在海水养殖疾病预防中的应用已被养殖业者广泛接受, 但由于水体中不同细菌对消毒剂的敏感性存在差异, 消毒后水体的细菌群落结构的恢复动态值得关注。研究表明, 氯消毒会改变饮用水的细菌群落组成, 降低群落结构多样性(Holingeret al, 2014; Daietal, 2020)。Becerra-Castro 等(2016)研究发现紫外线、臭氧及光催化臭氧化等多种方式消毒城市污水和地表水, 3 d 后的两种类型水体的变形菌门丰度明显上升。Duan 等(2020)报道漂白粉消毒对虾育苗用水5 d 后, 变形菌门和拟杆菌门丰度上升, 放线菌门丰度下降。本研究中, 漂白粉消毒后养殖源水的细菌群落与消毒前差异显著, 但高低浓度组之间无显著差异。消毒后(D0), 高浓度组变形菌门丰度明显下降, 拟杆菌门占据主导地位, 而低浓度组变形菌门丰度无明显变化, 说明高浓度漂白粉对变形菌门的杀灭效果更强, 存在剂量依赖效应。消毒后第3 天,高、低浓度组细菌群落组成趋于一致, 变形菌门丰度占据优势, 表明消毒后变形菌门类群可快速恢复。共现网络的复杂性代表了不同样本微生物群落之间的根本差异(Shietal, 2016), 网络的拓扑学参数可以表征微生物之间的相互作用(Barberánetal, 2012)。漂白粉消毒后, 细菌网络节点数量减少, 模块化程度降低,说明消毒降低了细菌的共现网络复杂程度。低浓度组共现网络节点之间的连接最为复杂, 并且网络中心性最高, 表明消毒后低浓度的水体细菌群落稳定性高于高浓度组。
从属水平看, 消毒后(D0)养殖源水优势属的数量减少, 但总相对丰度增加, 与Wan 等(2022)的研究结果一致。属水平的变化趋势与ASV 水平相似, 主要由单个或几个优势ASV 的丰度变化主导。消毒后0~2 d, 薄层菌属和Nautella在占据主导地位, 高浓度组薄层菌属丰度高于低浓度组; 第3 天, 小红卵菌属在高低浓度组均占据优势, 其次是Nautella丰度, 且高浓度丰度均高于低浓度组。有研究认为, 薄层菌属具有辐射抗性, 能适应多种极端环境(Collinsetal,2000)。Nautella常见于海水养殖环境及对虾肠道中(李秋芬等, 2011; Sakamietal, 2014; Zhengetal,2016), 但尚未发现对凡纳滨对虾的致病性。小红卵菌属是一类光养细菌, 分泌多种杀菌活性物质, 对水产动物有益生作用(Looetal, 2013; Changetal, 2019;Kogaetal, 2021)。
DPiWE 是一个基于高通量测序数据分析水体环境病原菌群落特征和溯源的综合数据库, 提供了人类介水传染病、水产动物疾病及跨宿主共患病等病害的细菌病原的分类学和宿主信息(董鹏生等, 2021)。通过DPiWE 数据库比对, 养殖源水中优势病原菌为埃希氏菌、微球菌属及Thalassobius等, 与象山大黄鱼网箱养殖区水体中优势病原菌(弧菌属、黏着杆菌属Tenacibaculum、埃希氏-志贺氏菌属Escherichia-Shigella和不动杆菌属)不同, 且总体丰度偏低(Houet al, 2021), 说明本实验源水环境受到水产养殖活动影响的程度低。漂白粉消毒后病原菌总丰度降低, 但种类增加, 与病原菌对氯消毒的抗性有关(Songetal,2019; Wangetal, 2019b), 如消毒后新增链球菌Streptococcus、梭状芽孢杆菌Clostridium、埃希氏-志贺氏菌等病原菌被普遍报道具有氯消毒抗性(Wangetal, 2021b)。高浓度组病原菌在消毒后初期丰度下降,而低浓度组在D0 时高于消毒前, 说明高浓度漂白粉对病原菌有更好地杀灭作用。源水病原菌组成与丰度存在明显的动态演替, 实验后期均以Thalassobius占主导地位, 有研究认为Thalassobius中包含多种鱼类病原菌, 但未见对虾类致病的报道(Kanehisa, 2018)。
本研究中, 养殖源水中丰度最高的ARG 是tetA,其次是cmlA 与floR, 与文献报道对虾养殖近海水源水主要为磺胺类ARGs (sul2)不同, 养殖源水中ARGs丰度与该水产养殖区常用的抗生素类型有关(夏涛涛等, 2022), 同时受人类活动、生活污水排入、降雨等多种因素影响(Shaoetal, 2018; Liuetal, 2020)。有研究表明, 氯消毒能有效去除水体中的ARGs (Yoonet al, 2017), 去除效率与有效氯浓度有关(Huangetal,2013)。本实验中, 漂白粉消毒后(D0)仅对sul1、floR、cfr、tetQ 有一定的去除效果, 且在有效氯衰减后短时间内恢复至消毒前水平, 说明漂白粉消毒养殖源水不能有效去除ARGs (Tangetal, 2023)。值得注意的是, 消毒后高浓度组sul1、sul2、tetA、tetQ 等ARGs的丰度高于低浓度组, 分析原因可能与消毒后携带相关抗性基因的细菌快速再生有关(Sullivanetal,2017)。氯消毒对水体ARGs 的去除具有选择性, 对引用水的研究发现, 氯消毒除对sul1 有明显的去除作用外, 对ampC、aphA2、blatem1、tetA、tetG、ermA、ermB 等ARGs 均有富集作用(Shietal, 2013)。Wan 等(2022)也报道氯消毒30 min 对多种ARGs 的丰度没有影响。本实验也有类似结果,tetA、cmlA 和strB 的丰度在消毒后无明显变化, 但具体机制有待进一步研究。
4 结论
研究发现, 漂白粉消毒改变了源水的细菌群落结构及共现网络的复杂性。消毒后, 两个浓度组源水的拟杆菌门丰度上升, 而60 mg/L 漂白粉组变形菌门的丰度显著降低; 属水平上, 薄层菌属和Nautella在消毒后源水中占据优势; 至第3 天, 两组的细菌群落组成在门和属水平趋于一致。60 mg/L 漂白粉对病原菌丰度和恢复速度的抑制作用优于20 mg/L。漂白粉消毒对养殖源水中sul1、floR、cfr、tetQ 有一定的去除作用, 但对其他 ARGs 几乎无影响, 显示了对ARGs 去除的选择性, 且高低浓度组之间无差异。综合分析认为, 相比20 mg/L 组, 60 mg/L 漂白粉消毒可以显著降低变形菌门的丰度, 抑制病原菌快速增殖,可以作为凡纳滨对虾养殖中更好地消毒选择。

