平扫及钆塞酸二钠增强MRI鉴别诊断透明细胞型与普通型肝细胞癌
宋明月,杜明占,郭凌川,张卫国
(1.苏州大学附属第一医院放射科,3.病理科,江苏 苏州 215006;2.苏州大学附属第四医院放射科,江苏 苏州 215028)
透明细胞型肝细胞癌(clear cell hepatocellular carcinoma, CCHCC)为相对罕见的肝细胞癌(hepatocellular carcinoma, HCC)病理类型,在全部HCC中的占比约为3%~7%[1],预后好于其他类型[2-4]。根据2019年消化系统肿瘤WHO分类(第5版),普通型HCC(non-otherwise specified HCC, NOS-HCC)指无特殊病理特征的HCC[1]。钆塞酸二钠(gadolinium ethoxybenzyl diethylenetriamine pentaacetic acid, Gd-EOB-DTPA)为细胞内钆对比剂,可用于检查肝脏局灶性病变、评估肝细胞功能[5-6]。本研究观察平扫及Gd-EOB-DTPA增强MRI鉴别CCHCC与NOS-HCC的价值。
1 资料与方法
1.1 研究对象 回顾性收集2015年1月—2021年10月于苏州大学附属第一医院经手术病理确诊的36例CCHCC患者(CCHCC组);以年龄与之相匹配为条件,以近似1∶2比例(卡尺宽度为0.2)行倾向性得分匹配,纳入72例经手术病理诊断NOS-HCC患者(NOS-HCC组)作为对照(对照组);全部患者均于术前2周内接受上腹部MR平扫及Gd-EOB-DTPA增强扫描。CCHCC组男22例、女14例,年龄37~78岁、中位年龄62.5岁;肝功能Child-Pugh A级2例、B级32例、 C级2例;单发病变33例、多发3例(病灶数2~3);35例接受血清甲胎蛋白(alpha fetoprotein, AFP)检测,其中6例AFP>400 μg/L;9例接受血清维生素K缺乏或拮抗剂-Ⅱ诱导的蛋白质(protein induced by vitamin K absence or antagonist-Ⅱ, PIVKA-Ⅱ)检测,其中6例PIVKA-Ⅱ>40 mAU/ml。NOS-HCC组男52例、女20例,年龄35~78岁、中位年龄63.0岁;肝功能Child-Pugh A级5例、 B级66例、C级1例;单发病灶64例、多发病灶8例(病灶数2~3);64例接受血清AFP检测,其中19例AFP升高;18例接受血清PIVKA-Ⅱ检测,其中14例PIVKA-Ⅱ升高。对多发病灶选取MRI特征最明显者进行分析。排除标准:①术前接受其他抗肿瘤治疗;②合并其他恶性肿瘤或肝癌复发;③病理及影像学资料不全。本研究通过院伦理委员会批准[(2024)伦研批第015号],检查前患者及家属均签署知情同意书。
1.2 仪器与方法 采用Siemens Magnetom Skyra 3.0T超导MR仪、16通道相控阵体线圈行上腹部平扫;参数:轴位T1WI,TR 3.90 ms,TE 1.89 ms,FOV 260 mm×320 mm,层厚3 mm;轴位T2WI,TR 4 688.56 ms,TE 105 ms,FOV 260 mm×320 mm,层厚7 mm;弥散加权成像(diffusion weighted imaging, DWI)采用自由呼吸单次回波平面序列,TR 5 300 ms,TE 57 ms,FOV 312 mm×384 mm,层厚7 mm,b值为50、800 s/mm2。平扫结束后以1 ml/s流率团注Gd-EOB-DPTA(普美显,拜耳先灵制药公司)对比剂(25 μmol/kg体质量),以相同流率跟注30 ml生理盐水;分别于注入对比剂后20、30、65、90 s及20 min采集肝脏早期动脉期(early arterial phase, EAP)、晚期动脉期(late arterial phase, LAP)、门静脉期(portal venous phase, PVP)、移行期(transitional phase, TP)及肝胆期(hepatobiliary phase, HBP)图像。
1.3 分析图像 扫描结束后,MR设备自动生成表观弥散系数(apparent diffusion coefficient, ADC)图。由具有15及20年影像学诊断经验的副主任医师各1名参照2018版肝脏影像报告和数据系统(liver imaging reporting and data system, LI-RADS)以盲法独立分析MRI,观察病灶表现,有分歧时经协商达成一致:①于T1WI显示病灶最大层面测量其直径[7];②记录病灶T1WI及HBP信号;③判断病灶内有无脂肪成分(相比同相位T1WI、反相位T1WI信号降低成分)、廓清外观、瘤内有无出血、有无强化包膜及门静脉癌栓;④计算T1WI及HBP图中病灶信号强度比值,包括病灶与肝脏比值(lesion-to-liver ratio, LLR)、病灶与脾脏比值(lesion-to-spleen ratio, LSR)及病灶与肌肉比值(lesion-to-muscle ratio, LMR)。经图像校正后,分别于平扫T1WI和HBP图显示病灶最大层面、避开脂肪抑制T1WI所示病灶内高信号(出血)区放置1个面积100~200 mm2的类圆形ROI,测量其信号强度(signal intensity, SI);避开血管、胆管、局灶性病灶、脾脏Gamna-Gandy小体及伪影区域,分别于病灶相同层面或邻近上下层面非瘤肝脏及脾脏实质内放置3个大小与病灶ROI相似的ROI,测量其内SI(图1)。以相同方法于脂肪抑制平扫T1WI和HBP图相同或邻近层面测量肌肉(竖脊肌)SI。对以上参数均重复测量3次,取均值进行分析。LLR=SI病灶/SI肝脏,LSR=SI病灶/SI脾脏,LMR=SI病灶/SI肌肉。

图1 患者男,72岁,CCHCC A、B.于轴位平扫T1WI(A)、HBP图(B)中非瘤肝脏(长箭)和脾脏(短箭)实质内放置ROI示意图
1.4 病理学分析 由分别具有10年、20年病理学诊断经验的副主任医师各1名参照2019年消化系统肝细胞癌WHO分类(第5版)要求分析并进行病理诊断,以病灶内透明细胞占比超过80%作为诊断CCHCC标准[1];根据Edmondson-Steiner分级(Ⅰ~Ⅳ级)评估肿瘤分化程度,以Ⅰ级、Ⅲ级为高分化,Ⅲ级为中分化,Ⅳ级为低分化;评估脂肪肝背景,记为无(<5%)、轻度(5%~33%)、中度(34%~66%)或重度(>66%)[8];记录有无肝硬化、微血管浸润(microvascular invasion, MVI)、血管包绕肿瘤团簇(vessels encapsulating tumor clusters, VETC)及卫星结节等。
1.5 统计学分析 采用SPSS 27.0统计分析软件。以中位数(上下四分位数)表示不符合正态分布者,行Mann-WhitneyU检验。采用χ2检验或Fisher精确概率法比较计数资料。针对组间差异有统计学意义的参数,以多因素logistic回归分析筛选CCHCC与NOS-HCC的独立预测因素。绘制受试者工作特征(receiver operating characteristic curve, ROC)曲线,计算曲线下面积(area under the curve, AUC),评估各MRI相关独立预测因素及其联合鉴别CCHCC与NOS-HCC的效能,并以DeLong检验进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 临床及病理资料 CCHCC组与NOS-HCC组间肿瘤Edmondson-Steiner分级差异有统计学意义(P=0.001),其余临床及病理特征差异均无统计学意义(P均>0.05)。见表1。
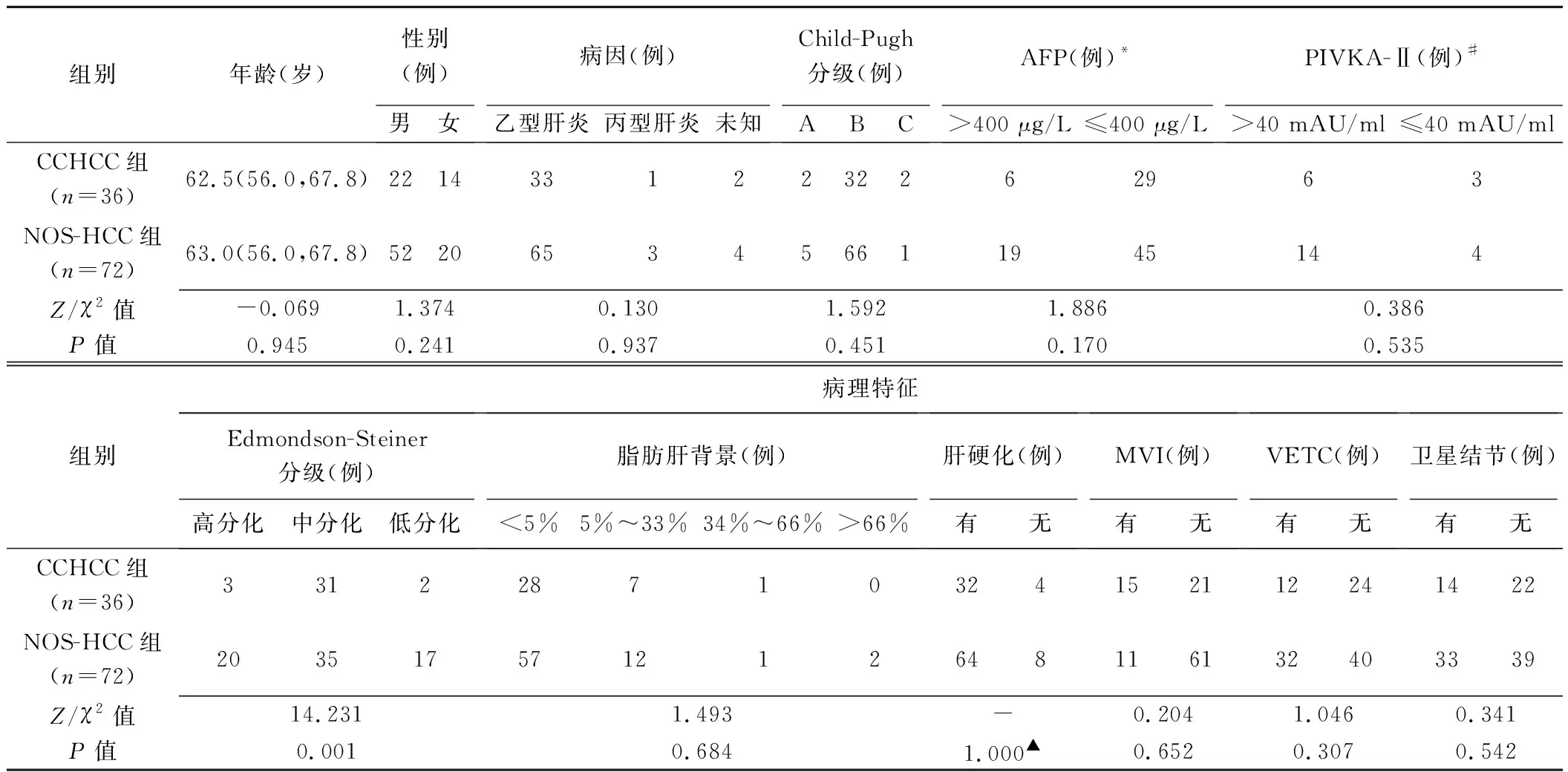
表1 36例CCHCC及72例NOS-HCC患者临床及病理特征
2.2 MRI表现 组间LI-RADS分类、病灶含脂肪成分与否、LLRT1WI、LMRT1WI、LLRHBP及LMRHBP差异均有统计学意义(P均<0.05),其余MRI参数差异均无统计学意义(P均>0.05)。见表2及图2。

表2 CCHCC与NOS-HCC病灶MRI表现

图2 患者女,70岁,肝S7/S8段CCHCC A.上腹部轴位同相位T1WI示肝S7/S8直径7.4 cm等信号病灶(箭); B.上腹部轴位反相位T1WI示病灶内含脂肪成分(箭); C.病理图(HE,×100)示肿瘤内透明细胞占比超过80%; D.病理图(HE,×400)示肿瘤内含脂肪变性
2.3 多因素logistic回归分析及ROC曲线 肿瘤Edmondson-Steiner分级(中分化)、病灶内含脂肪成分、LLRT1WI及LMRT1WI均为CCHCC与NOS-HCC的独立预测因素(P均<0.05,表3)。
ROC曲线显示,以单一病灶内含脂肪成分、LLRT1WI及LMRT1WI鉴别CCHCC与NOS-HCC的AUC分别为0.652、0.689及0.687,三者联合的AUC为0.762,高于单一病灶内含脂肪成分(Z=-2.401,P=0.016)而与单一LLRT1WI(Z=-1.841,P=0.066)及单一LMRT1WI(Z=-1.440,P=0.150)差异无统计学意义。见图3。
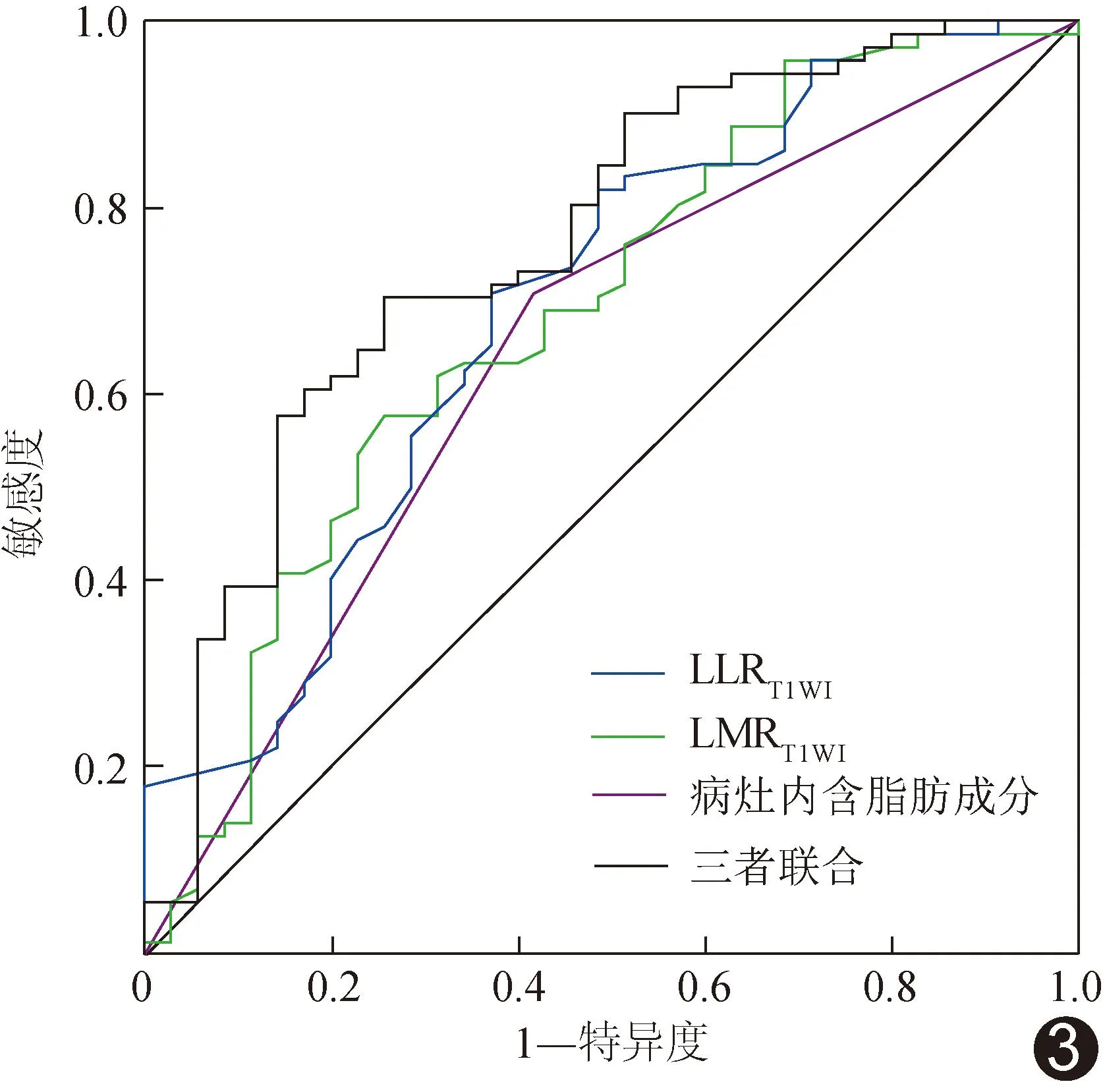
图3 单一独立预测因素及其联合鉴别CCHCC与NOS-HCC的ROC曲线
3 讨论
CCHCC由大量透明细胞构成,细胞质内存在较明显的糖原蓄积和含量不等的脂质空泡,组织学上多为中等分化肿瘤[2,9];其肿瘤胞质内富含脂肪可能与门静脉供血减少所致短暂性细胞内缺氧和糖代谢紊乱有关[10-11]。及时明确诊断CCHCC有利于临床治疗决策。徐鹏举等[12]研究表明,CCHCC内透明细胞占比与病理分化级别呈正相关,透明细胞占比越高,其分化程度越高。部分CCHCC表现为“快进快出”的典型肝癌强化方式[8],此时影像学鉴别CCHCC与NOS-HCC存在一定难度。
CCHCC肿瘤细胞内含有较多糖原和脂质,使其在反相位MRI中的信号低于同相位MRI[5],故脂肪/水化学位移成像有助于检测CCHCC。Gd-EOB-DTPA增强MRI可用于诊断肝内病变。本研究结果显示,CCHCC组与NOS-HCC组之间,LI-RADS分类差异有统计学意义,与CCHCC内透明细胞占比较高有关[10];CCHCC病灶内多含脂肪成分,其LLRT1WI、LMRT1WI、LLRHBP、LMRHBP均高于NOS-HCC,且多存在脂肪变性,与TORBENSON[13]的结果相符。
本研究多因素logistic回归分析结果显示,Edmondson-Steiner分级为中分化、病灶内含脂肪成分、LLRT1WI及LMRT1WI均为CCHCC与NOS-HCC的独立预测因素;以单一MRI相关指标,包括病灶内含脂肪成分、LLRT1WI及LMRT1WI鉴别CCHCC与NOS-HCC的AUC分别为0.652、0.689及0.687,三者联合的AUC为0.762,提示平扫及Gd-EOB-DTPA增强MRI用于鉴别CCHCC与NOS-HCC的效能良好。
综上,平扫及Gd-EOB-DTPA增强MRI可用于鉴别诊断CCHCC与NOS-HCC。但本研究为单中心回顾性分析,样本量有限,有待后续通过开展多中心大样本前瞻性临床研究进一步探讨。
利益冲突:全体作者声明无利益冲突。
作者贡献:宋明月查阅文献、研究设计与实施、数据和统计分析、撰写文章;杜明占图像分析、研究实施;郭凌川指导、审阅文章;张卫国指导、修改及审阅文章。

