血清CD73和帕金森病患者运动障碍相关性研究
赵 媛 刘 向 杨国锋
帕金森病(Parkinson′ s disease,PD)是最常见的引起老年人运动障碍的神经退行性疾病,其典型临床核心运动4主征为震颤、强直、少动和运动迟缓、姿势步态不稳。随着病情进展,PD运动症状进行性加重,成为引起PD患者生活质量下降、生活依赖度增高的主要原因[1,2]。目前研究表明,黑质纹状体多巴胺(dopamine,DA)能神经元的进行性丢失可引起多巴胺D2/D1受体介导的纹状体抑制性和兴奋性调节功能失衡,间接通路(胆碱能通路)的兴奋性增加,引起PD患者运动障碍[3,4]。
核苷酸酶(Ecto-5′-Nucleotidase,5′-NT,CD73)存在于大多数正常组织中,可将细胞外单磷酸腺苷(adenosine monophosphate,AMP)转化为腺苷,作用于腺苷受体而在免疫、炎症和维持细胞稳态中发挥作用[5]。既往研究表明,持续存在的小胶质细胞介导的神经炎症是PD疾病进展的主要原因[6]。研究证明,PD中CD73可与A2A受体 (adenosine A2A receptor,A2AR)相互作用形成二聚体,增强小胶质细胞激活及其下游炎性细胞因子IL-β、IL-6和TNF-α的表达[7]。此外,CD73的高表达可以增加苍白球外侧部GABA能的释放,使纹状体-苍白球棘突投射神经元的兴奋性增高,增加皮层对运动的抑制[4,8,9]。因此,基于CD73参与了调控PD炎性反应及病程进展,CD73已逐渐成为PD诊疗的重要靶点。
但目前国内外尚缺乏监测血清CD73在PD中动态变化及探索其在PD诊断中临床价值的相关研究。本研究通过分析血清CD73在不同H&Y(Hoehn &Yahr)分期PD患者中的水平变化,以及其与运动障碍严重程度的相关性,探讨血清CD73可否用作PD诊断的参考依据,分析其是否有望成为评估PD患者病情进展的新指标。
资料与方法
1.研究对象:本研究纳入2022年2~11月于河北医科大学第二医院老年病科住院的60岁以上PD患者97例为病例组。其中,女性51例(52.6%),男性46例(47.4%);吸烟者10例(10.3%),患者平均年龄为67.93±5.74岁。另纳入同时期河北医科大学第二医院体检中心接待的老年健康体查者71例为健康对照组。其中,女性31例(43.7%),男性40例(56.3%);吸烟者14例(19.7%),平均年龄为65.01±6.42岁。
2.纳入标准:①符合2016版中国帕金森病诊断和拟诊标准;②病程达1年及以上;③患者存在下列某一项或多项特征且显而易见,包括姿势不稳、静止性震颤、肌肉僵直、非原发性视觉障碍等;④临床资料完整;⑤患者与家属知晓,签署知情同意书。本研究经笔者医院医学伦理学委员会讨论通过(伦理学审批号:2022-R036)。
3.排除标准:①继发性帕金森综合征患者;②帕金森叠加综合征患者;③有严重心脏、肝脏、肾脏、胃肠道功能障碍者;④提供病史不清楚详细者;⑤近1个月内有感染者;⑥患有免疫系统疾病者;⑦有慢性感染性疾病者;⑧近1个月内使用消炎药、免疫调节药者;⑨有恶性肿瘤病史者;⑩近期有外伤或头颅手术史者。
4.研究内容及方法:收集纳入对象资料包括年龄、性别、吸烟史以及病例组患者的病程。病例组患者病情评估:采用统一帕金森病评定量表第3部分(运动检查)(unified Parkinson′s disease rating scale part Ⅲ, UPDRS-Ⅲ)对患者运动功能进行测评(皆在患者临时停药,处于“关”状态下评估),此量表共14项,每项按照相应症状的严重程度不同为0~4分,得分越低者表示生活质量越优;采用H&Y分期对患者运动障碍严重程度进行测评,根据患者运动症状的分级划分为轻度PD组(H&Y为Ⅰ~Ⅱ期)和中重度PD组(H&Y为Ⅲ~Ⅴ期)[10]。以上测评均由两个神经内科主治医师共同参与。
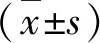
结 果
1.病例组和健康对照组一般资料分析:本研究共纳入研究对象168例。其中,病例组97例,健康对照组71例。病例组较对照组年龄偏大(P<0.01),两组研究对象性别分布均衡(P>0.05),是否有吸烟史无明显差别(P>0.05)。此外,病例组病程为2.0(1.0,4.0)年,H&Y分期为2.0(2.0,3.0),UPDRS-Ⅲ评分为18.66±0.70分。CD73在PD患者外周血中表达显著降低(P<0.01,表1)。
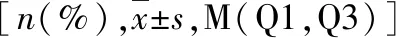
表1 病例组与健康对照组一般资料分析
2.血清CD73和其他危险因素与帕金森病相关性的Logistic回归分析:经过Logistic回归分析,在调整了年龄、性别、吸烟史后,结果显示血清CD73水平越低,患PD的风险越大(OR=0.208,P<0.01,表2)。
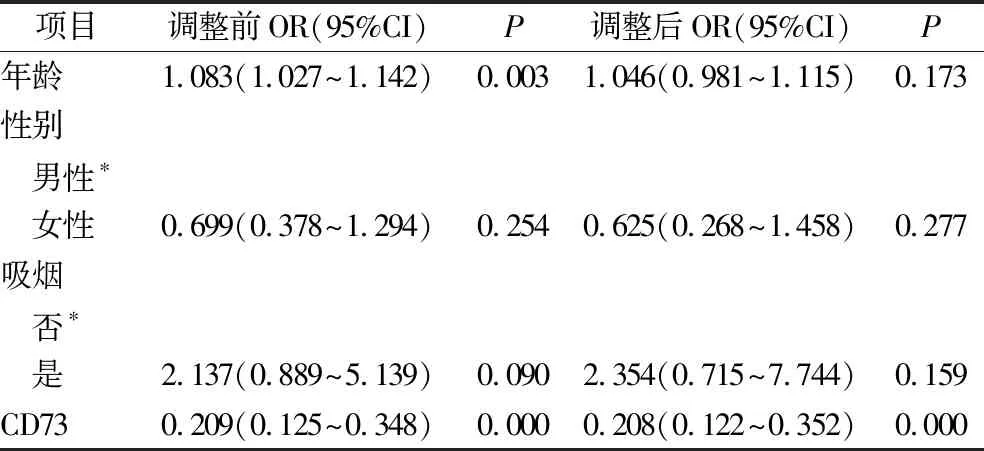
表2 血清CD73和其他危险因素与帕金森病相关性的Logistic回归分析
3.血清CD73对PD的预测ROC曲线:以健康对照组为阳性样本,病例组为阴性样本绘制ROC曲线,结果显示血清CD73对PD预测的AUC=0.845,95%CI:0.787~0.902,最佳截断值为2.85U/L,敏感度为90.1%,特异性为67.0%(P<0.001,图1)。
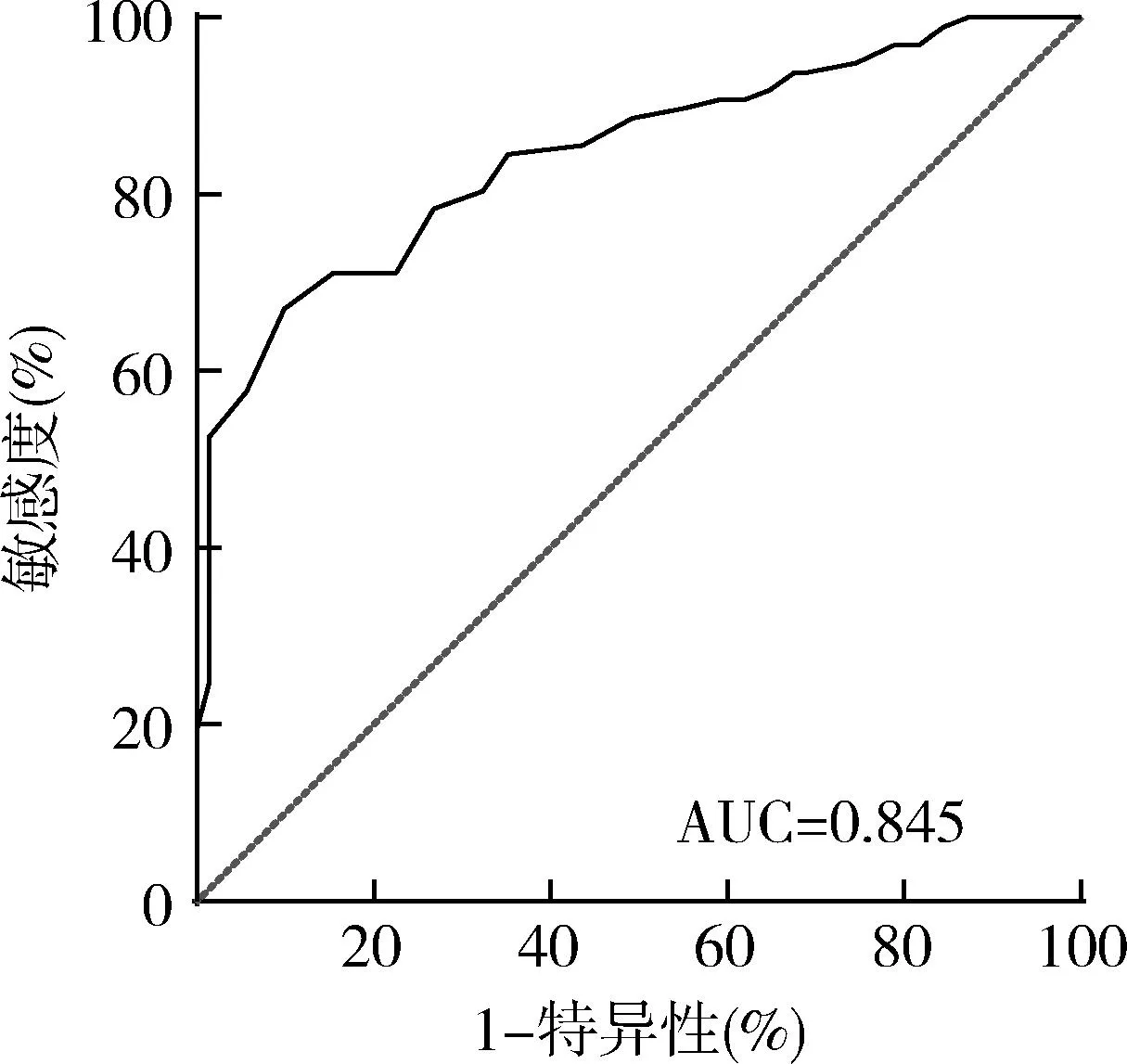
图1 血清CD73对PD的预测ROC曲线
4.轻度PD组与中重度PD组一般资料分析:按照H&Y分期对病例组研究对象进行分组,Ⅰ~Ⅱ期为轻度PD组(n=50);Ⅲ~Ⅴ期为中重度PD组(n=47)。两组患者年龄、性别及吸烟史比较差异无统计学意义(P>0.05)。中重度PD组比轻度PD组患者病程更长,UPDRS-Ⅲ评分更高,而血清CD73水平降低(P<0.05,表3)。

表3 轻度PD组与中重度PD组一般资料分析
5.PD患者血清CD73与H&Y分期、UPDRS-Ⅲ评分的相关性分析:经Pearson相关分析可知,PD患者血清CD73水平与H&Y分期和UPDRS-Ⅲ评分呈负相关(P<0.01,表4)。图2示在疾病分期早期(H&Y Ⅱ期),血清CD73下调较健康对照组显著下调,并且随着H&Y分期的增加,血清CD73的含量逐渐减少,表明血清CD73可能是PD诊断的新型指标。

图2 不同H&Y分期PD患者血清中CD73水平

表4 血清CD73相关性分析
讨 论
PD是最常见的神经退行性疾病之一,在全球老龄化和工业化的推动下,PD患者数量呈指数上升[11]。统计显示,至2040年,全世界患PD的人数预计将超过1200万[12]。目前,PD的发病机制尚不明确,其主要病理机制为以α-突触核蛋白(α-synuclein,SNCA)为主要成分的路易小体形成和以背侧纹状体为主的基底核的DA水平降低[13,14]。研究表明,PD的运动症状由纹状体DA耗竭所致,但也有许多研究显示另外一些神经结构(前额叶皮质区和小脑)和神经化学系统 (包括胆碱能、5- 羟色胺能、谷氨酸能) 也参与了运动症状的发生[15~18]。其典型临床特征除了核心运动4主征外,还有相对次要的运动症状,如精确动作障碍、书写障碍、语言功能受损及构音障碍等。随着病情进展,PD运动症状进行性加重,成为引起PD患者生活质量下降、生活依赖度增高的主要原因。因此,有效预测PD运动症状发生、发展,实现疾病的早期诊断、早期治疗尤为重要。
CD73(5′-核苷酸酶, 5′-NT)是由NT5E基因编码,催化AMP形成胞外腺苷的主要酶,参与调节细胞稳态、应激反应、损伤和疾病等机制[5,19]。CD73通过 C-末端的丝氨酸残基与糖基磷脂酰肌醇构成二聚体固定于细胞膜上。研究表明CD73是脑内最主要的5′-核苷酸酶,占全部AMP水解能力的85%~95%[20]。其主要高表达于纹状体,嗅结节以及脑膜[20,21]。经CD73代谢产生的腺苷,作用于A2AR信号通路,对小胶质细胞介导的神经炎性反应调节至关重要[7]。CD73在大脑中动脉栓塞小鼠脑组织中的表达和活性较健康对照组明显上调[22]。
研究表明,CD73的缺失可明显加重小胶质细胞激活及其他炎性细胞的浸润。在慢性低灌注性白质损伤模型,上调CD73可显著减轻小鼠工作记忆损伤,小胶质细胞及星形胶质细胞活化以及所引发的级联炎性反应[23]。在PD模型小鼠脑组织中,CD73上调并激活A2A受体相关腺苷通路;敲除CD73能抑制PD模型中A2A受体的激活和上调,并发挥保护多巴胺能神经元和减轻小鼠运动障碍的作用。进一步研究发现,CD73可促进PD中小胶质细胞激活和增加炎性细胞因子的释放[7]。由此可见,CD73在PD的病理进展中发挥重要作用,但血清CD73水平是否与PD运动症状严重程度相关,可否用作PD诊断的参考指标仍有待于进一步研究。
综上所述,本研究通过比较分析97例PD患者及71例健康对照者血清CD73水平,发现CD73在PD患者外周血清中含量较健康对照人群明显下降,且PD患者血清CD73水平与H&Y分期和UPDRS-Ⅲ评分呈负相关(P<0.01)。依据血清CD73表达水平绘制ROC曲线,通过评估曲线下面积,发现血清CD73的AUC为0.845(95% CI: 0.787~0.902),对PD具有较高的敏感度(90.1%)及特异性(67.0%)。由此可见血清CD73水平与PD疾病分期及运动障碍严重程度均呈明显相关性。但血清CD73可否作为新型PD诊断标志物及预测PD进展的指标,仍需开展大样本量及多中心研究予以证实。

