基于UPLC-MS/MS方法分析哈萨克族食管鳞癌患者的血清脂质组学特征
刘瑞雪,李德生,张力为
(新疆医科大学第一附属医院胸外科,新疆 乌鲁木齐 830054)
2020年国际癌症研究中心的研究报告显示,食管癌居世界恶性肿瘤发病率第8位,死亡率第6位[1]。食管癌的发病有明显的地域和种族差异[2],我国是食管癌的高发区,占全球新发病例的50%以上,90%以上是鳞状细胞癌[3]。新疆哈萨克族食管癌发病率为68/10万,死亡率是生活在同一地区汉族或其他少数民族的3~4 倍,远远超过全国和世界的平均水平,被列为新疆特高发肿瘤之一[4]。目前我国食管癌的术后5年生存率虽然较以往有所提高,但仍然不超过30%~40%[5]。癌细胞在脂质合成及脂质氧化等方面发生了特定改变[6]。作为代谢组学的一个独立分支,脂质组学已经在各类肿瘤研究中识别和量化脂质,以揭示癌症进展的关键驱动因素[7]。靶向定量脂质组学有助于检测特定物质的精确浓度,有助于为潜在的生物标志物和药物靶点的发现提供多样化的数据[8]。所以,针对我区哈萨克族食管鳞癌(esophageal squamous cell carcinoma,ESCC)的种族特点,本研究拟使用哈萨克族ESCC 患者血清样本通过超高效液相色谱串联质谱技术(ultra performance liquid chromatography/tandem mass spectrometry,UPLC-MS/MS)进行靶向脂质组学分析,旨在探究新疆哈萨克族ESCC 患者的脂质代谢特征,进一步筛选出可能影响哈萨克族ESCC 患者疾病进展的脂质代谢标记物。
1 材料与方法
1.1 一般资料
选取2018年1月—2020年12月在新疆医科大学第一附属医院胸外科进行食管癌根治术的哈萨克族患者30 例,所有患者均经病理学诊断为食管鳞状细胞癌,作为ESCC 组。另外选择同期在新疆医科大学健康管理中心体检的哈萨克族健康体检者30例为对照组。本研究已获新疆医科大学第一附属医院医学伦理委员会批准(K202304-04),所有受试者在研究开始前均已签署知情同意书。
1.2 纳入和排除标准
ESCC 组纳入标准:①在新疆医科大学第一附属医院胸外科行食管癌根治术的哈萨克族患者;②术后病理学诊断为食管鳞状细胞癌;③无心脑血管等慢性疾病;④无代谢性疾病。ESCC 组排除标准:①有其它肿瘤病史;②标本采集前有放化疗病史;③长期口服影响机体代谢的研究对象;④素食者。
对照组纳入标准:①在新疆医科大学健康管理中心体检的哈萨克族健康成人,体检结果无异常;②无代谢性疾病。对照组排除标准:①体检发现有甲状腺疾病,高血压及糖尿病等影响机体代谢的疾病;②孕妇、哺乳期妇女及经期女性;③素食者。
1.3 样品采集和制备
采集所有受试对象的晨间空腹(至少空腹8 h)静脉血5 mL,4 ℃静置2 h后3 000g离心15 min(离心半径为16 cm),取上清液用于临床血清生化及血脂检测,剩余血清样本于-80 ℃冰箱冻存。取10 μL 的血清样本混入480 μL 的脂质提取液(甲基叔丁基醚和甲醇按体积比5∶1 混和),将样品4 ℃,3 000g离心15 min,取上清液250 μL,重新加入250 μL 甲基叔丁基醚,超声10 min 后,再次将样品4 ℃,3 000g离心15 min,取上清液250 μL,重复上述步骤1 次,最后取30 μL上清液于进样瓶中上机检测。
1.4 UPLC-MS/MS检测
使用SCIEX ExionLC 超高效液相色谱仪,通过液相色谱柱对目标化合物进行色谱分离。液相色谱A相为40%水和60%乙腈溶液,其中含10 mmol/L 乙酸铵;B 相为10%乙腈,90%异丙醇溶液,其中含10 mmol/L 乙酸铵。流动相流速0.3 mL/min,柱温45 ℃,样品盘温度6 ℃,进样体积2 μL。数据采集时,以多反应监测(MRM)模式进行质谱分析。AB Sciex QTrap 6500 质谱仪器参数如下:离子喷雾电压:+5 500/-4 500 V,气帘气流速:40 psi,离子源温度:350 ℃,离子源气体压力1∶50 psi,离子源气体压力2∶50 psi。
1.5 统计分析
首先通过LipidSearch、Metlab 软件对原始数据进行采集汇总、归一和滤噪等处理。采用Biobud-v软件对所有目标化合物进行定量分析,根据每个样品脂质内标峰面积和实际浓度关系计算出每个脂质相对于该内标的绝对浓度。接着使用SIMCA软件对代谢组数据进行对数(Log)转换加UV 格式化处理,然后进行单变量统计分析和多元变量统计分析,包括主成分分析(principal component analysis,PCA)和正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis,OPLS-DA)、脂质组成分析及脂质链长和不饱和度等项目分析。最后,利用OPLS-DA模型中的变量投影重要度(variable importance in the projection,VIP)识别两组间的明显差异的代谢物,对于VIP>1.0 和P<0.05 的代谢物被认为是显著差异的代谢物。
2 结 果
2.1 两组人群一般资料和血生化指标比较
ESCC 患者和健康对照人群的一般资料和血生化指标的检测结果见表1,ESCC 组患者血清总胆固醇、总蛋白、白蛋白低于对照组(P<0.05)。两组年龄、性别、甘油三酯、总胆汁酸、HDL-C、LDL-C比较,差异均无统计学意义(P>0.05)。

表1 ESCC患者和健康对照人群的一般资料和血生化指标的检测结果
2.2 多元统计分析
通过SIMCA 软件对ESCC 患者及对照组整理好的代谢组数据进行对数(Log)转换,然后对其进行PCA和OPLS-DA 分析。结果提示两组间存在分离趋势(图1A)。OPLS-DA 分析获取更加可靠的代谢物的组间差异与实验组的相关程度信息(图1B)。从OPLS-DA得分图的结果可以看出,样本基本处于95%置信区间内。根据OPLS-DA,可以计算出每个代谢物的VIP值,这是筛选差异代谢物的重要参数之一。

图1 ESCC组和正常对照组PCA及OPLS-DA分析得分散点图
2.3 哈萨克族ESCC患者的脂类组成分析
根据脂类头部基团,将脂质进一步分为多个亚类。通过Biobud-v软件对所有目标化合物进行脂质定量分析,结果提示总体样本中检测到脂质化合物及各亚类共计13 类,其中浓度最高的化合物是甘油三酯,见图2A。通过计算同一样品中各脂质亚类浓度总和定量其总浓度,结果提示ESCC 中溶血磷脂酰胆碱(LPC),磷脂酰乙醇胺(PE)的浓度显著降低(P<0.05),神经酰胺(Cer)的相对浓度明显升高(P<0.05),虽然游离脂肪酸(FFAs)、二酰甘油(DAG)、三酰甘油(TAG)、溶血磷脂酰乙醇胺(LPE)、磷脂酰胆碱(PC)、二氢神经酰胺(DCER)、己糖基神经酰胺(HCER)、乳糖基神经酰胺(LCER)、鞘磷脂(SM)及胆固醇酯(CE)的总浓度在两组间无明显差异,结果见图2B(P>0.05)。但FFA、DG、TAG、LPC、LPE、PC、PE及SM的主要种类在两组间差异明显(P<0.05),见图3。
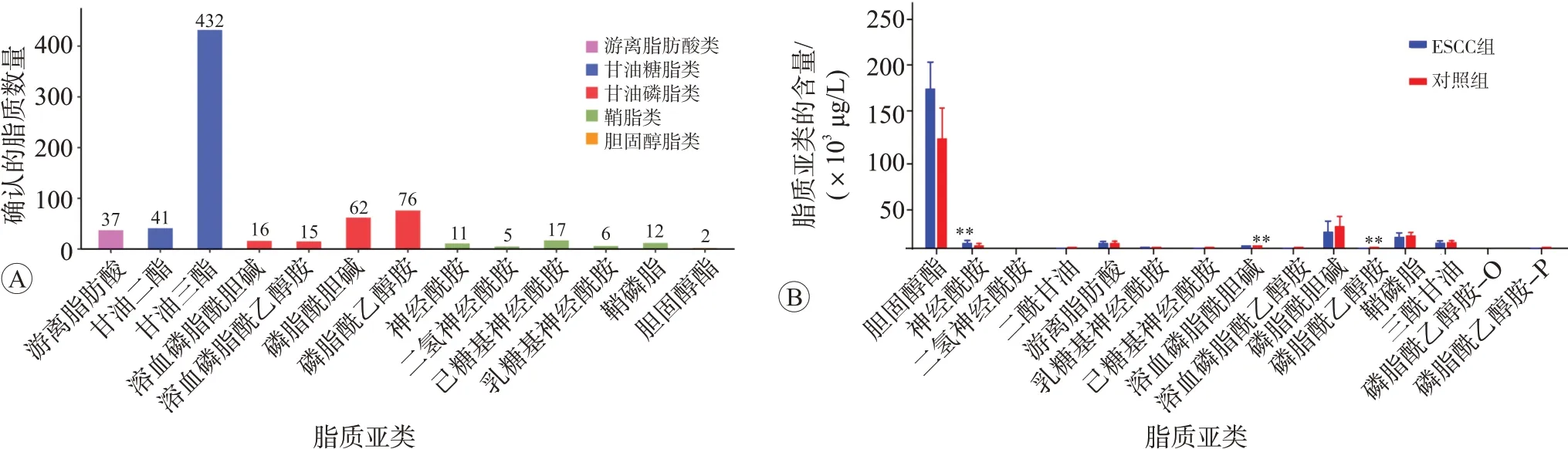
图2 ESCC组与正常对照组的脂质筛选及脂质亚类浓度的差异
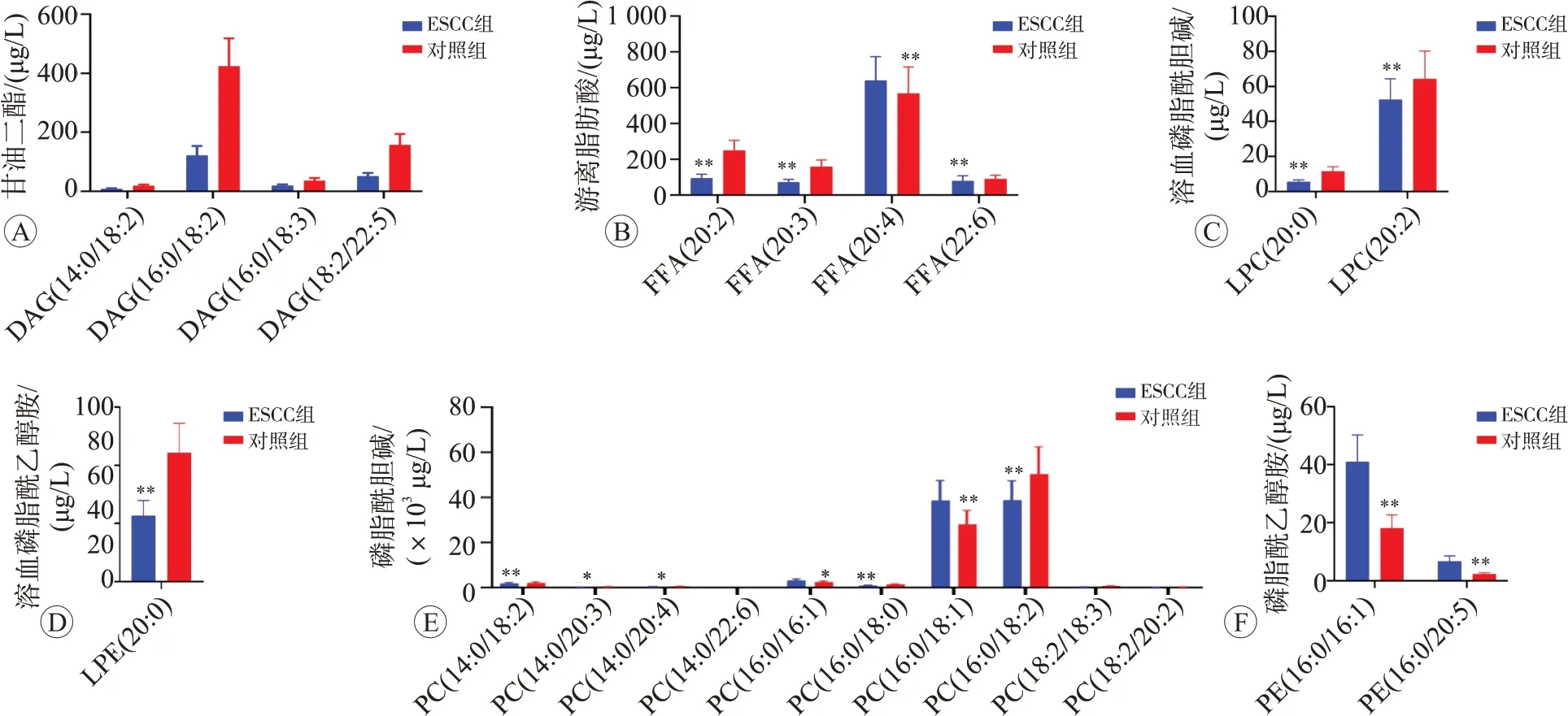
图3 ESCC组与正常对照组血清样本中脂质亚类浓度的差异分析
2.4 哈萨克族ESCC 患者血清中的差异脂质代谢物的筛选
我们以P<0.05,VIP>1 的标准进行差异脂质代谢物筛选,共筛选出249种差异脂质代谢物,其中79种上调,170种下调见图4A。我们选取OPLS-DA模型各组中VIP最大的前20种脂质,发现其表达水平均是下调的,见图4B。为了了解它们之间的可能调节关系,我们对VIP最大的前50个差异脂质进行Pearson相关性分析,结果提示几种类型的甘油三酯与其它几种类型的脂质均存在明显正相关见图5。我们又以阈值(P<0.05和差异倍数>2或<0.5)筛选差异脂质代谢物,共筛选出73 种差异脂类,其中与对照组相比较,ESCC 组上调的有34 种,见表2,下调的有43 种,见表3。其中甘油二酯DAG(14:0/18:2)、DAG(16:0/18:2)、DAG(16:0/18:3)、DAG(18:2/22:5)均是下调的,尤其是DAG(18:2/22:5)下调了37%;游离脂肪酸类FFA(20:2)、FFA(20:3)、FFA(20:4)、FFA(22:6)均是下调的,尤其FFA(20:4)下调了36%。而TAG 种类在ESCC 组出现了2 倍的上调变化。在甘油磷脂类中,尤以PE(16:0/16:1)和PE(16:0/20:5)变化最为明显,在肿瘤组中其上调了2.28和2.48倍。

图4 ESCC组与正常对照组血清样本中差异表达的脂质
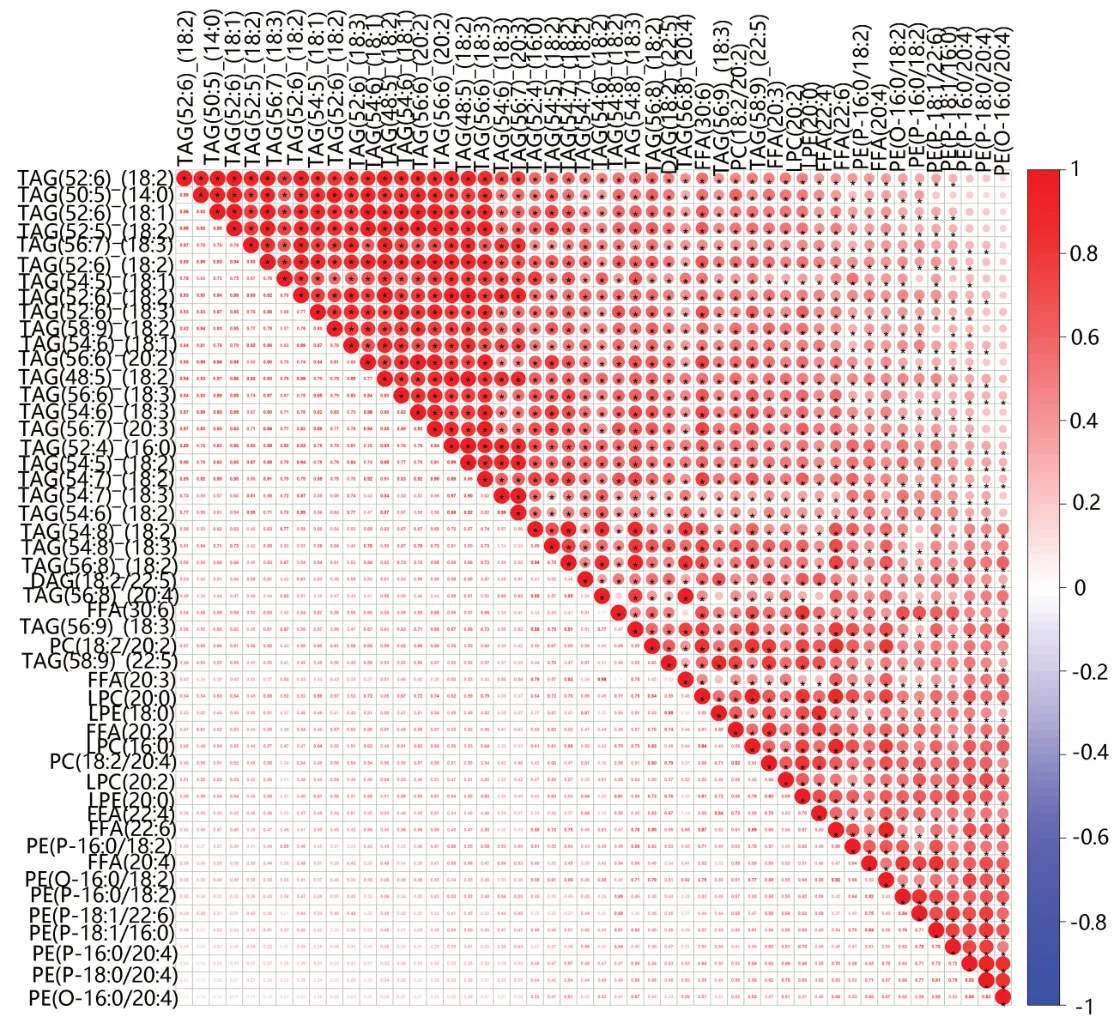
图5 ESCC组与正常对照组血清样本中差异表达脂质的相关性分析
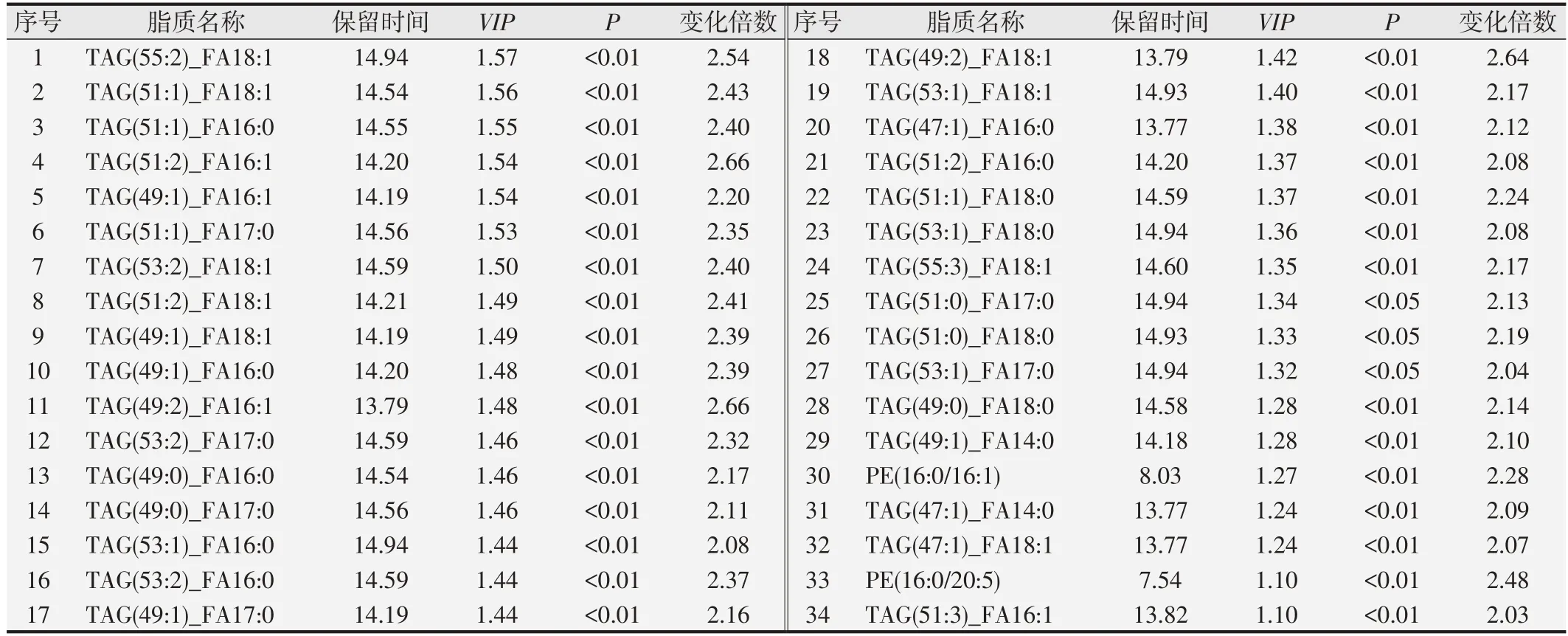
表2 食管鳞状细胞癌和对照组患者血清中上调的脂质代谢物
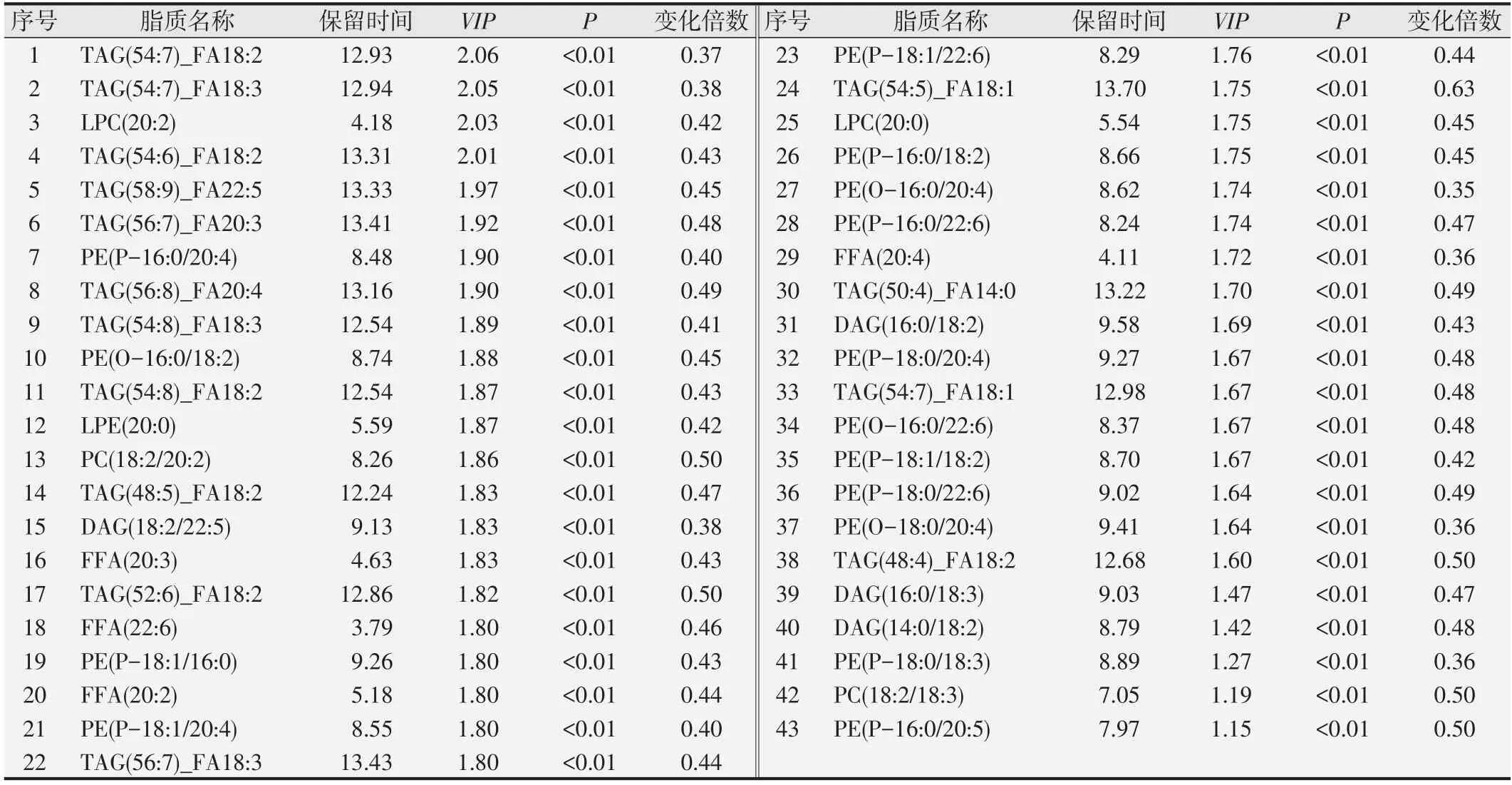
表3 食管鳞状细胞癌和对照组患者血清中下调的脂质代谢物
2.5 哈萨克族ESCC患者血清样本中脂质链长分析
与健康人群相比较,肿瘤组中游离脂肪酸浓度在18、20、22、24、26、28、30链长处减少,而在14碳链处其浓度在肿瘤组中反而增加。LPC 在肿瘤组的浓度在所有链长处均低于正常组。肿瘤组PC 浓度在36、38 链长处少于正常组。肿瘤组中LPE 浓度在18、22 链长处相较正常组明显减少。PE 浓度在肿瘤组中随着碳链长度的增加而减少。SM在肿瘤组中其浓度在22、24 链长处明显减少。在肿瘤组中,HCER 和DCER 浓度在36链长处,相较于正常组其浓度反而增加,结果见图6。
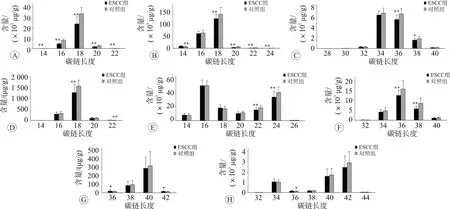
图6 ESCC组和正常对照组中不同碳链长度对应的脂类化合物浓度
2.6 哈萨克族ESCC 患者血清样本中脂链不饱和度分析
本研究中TAG、LPC、PC 和PE 在肿瘤组中几乎所有不饱和键的脂质浓度相较正常组均明显下调,差异有统计学意义(P<0.05 或P<0.01)。其他含有部分不饱和键的脂类化合物浓度在肿瘤组中也明显下调(P<0.05或P<0.01),结果见图7。
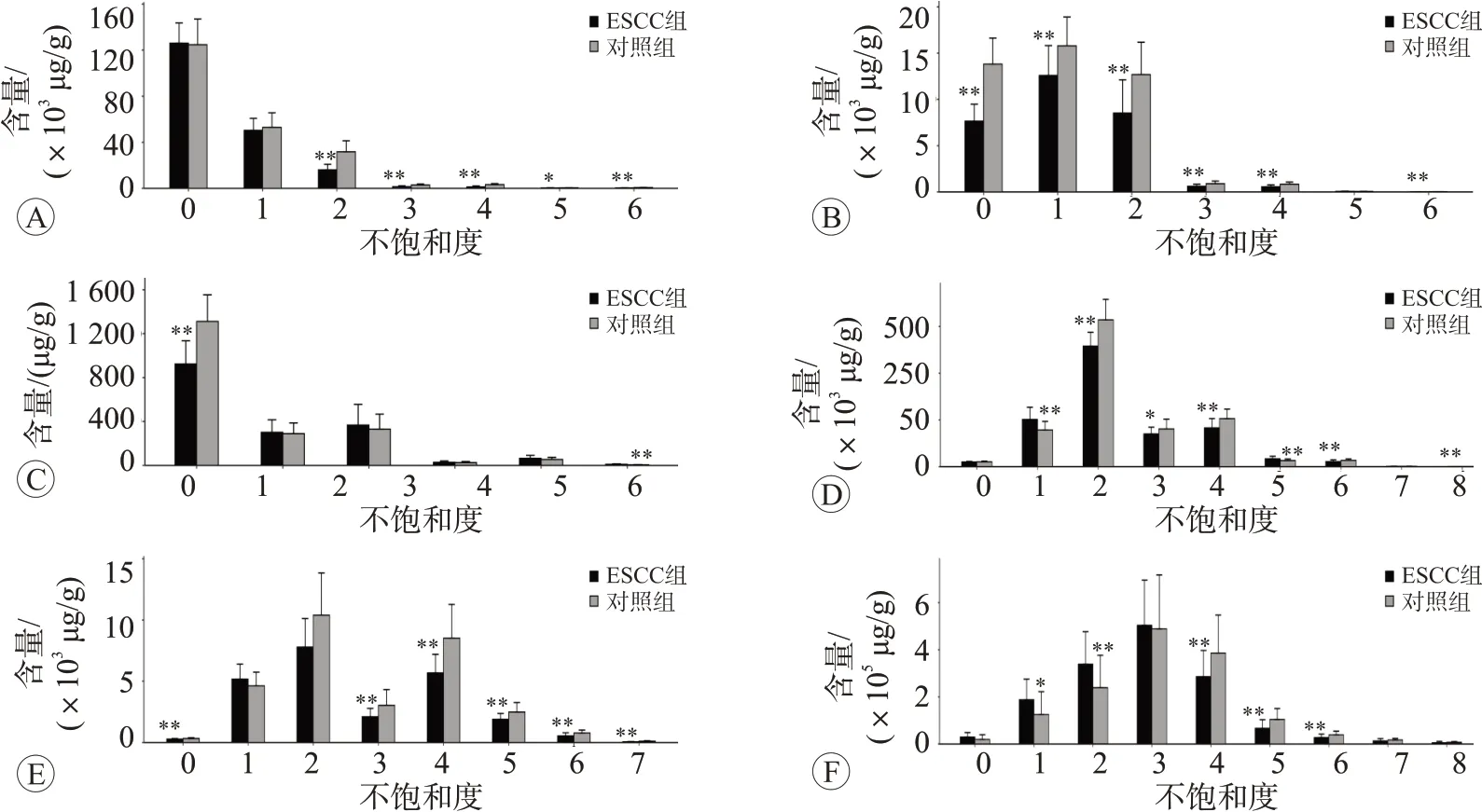
图7 ESCC组和正常对照组中不同碳链饱和度对应的脂类化合物浓度
3 讨 论
多项研究报道癌症中发生脂质代谢重编程,脂质代谢物参与肿瘤细胞能量储存、细胞信号传导、细胞膜的构成和细胞间的相互作用[9]。之前对ESCC的多个转录组数据集的综合分析显示了脂质代谢途径的改变,包括糖鞘脂生物合成、鞘脂代谢和甘油脂代谢[10]。我们课题组结合新疆地区食管癌的流行病学特点,前期针对新疆哈萨克族ESCC 进行的一项非靶向代谢组学研究显示了脂质代谢的改变,比如油酸、LysoPC(15:0)与淋巴结的转移相关[11],这说明脂质分子的种类和水平可能提示哈萨克族ESCC 的病程和发展趋势。因此,本研究仍以哈萨克族人群为研究目标进一步通过脂质的准确鉴定和定量全面进行脂质谱分析,进一步探究哈萨克族ESCC 样本的脂质组成、分布等特点。
脂质链长度为该脂质分子所有脂肪酸的碳原子总和。脂链因长度差异导致脂质功能各异,链的长度会影响细胞质膜的厚度,进而影响细胞膜的流动性、相关脂质转运蛋白和靶蛋白的活性和功能[12]。研究发现,胰腺中CD8+T 细胞中特异性长链脂肪酸(LCFAs)的逐渐积累不仅破坏了线粒体功能,而且通过脂肪酸的β氧化过程促进了TCA 循环,且不同类型的LCFAs和不同饱和度的脂质可能为肿瘤微环境中维持肿瘤进展和免疫细胞代谢重编程提供线索[13]。而本研究提示肿瘤组中FFA、PC、LPC、PE、LPE 的浓度在部分链长处均低于正常组人群,尤其是肿瘤组中LPC的浓度在所有链长处均低于正常组。同时,脂肪酸链中双键数目的总和决定脂链不饱和程度,肿瘤细胞增殖和侵袭能力的增强与细胞膜脂质的饱和度密切相关[14]。有研究指出脂肪酸残基可能因不饱和程度以及双键的位置而不同,与非恶性细胞相比,癌细胞的细胞膜表现出不同程度的不饱和,癌细胞细胞膜较低的饱和度,可防止细胞膜脂质过氧化[15-16]。而本研究中TAG、LPC、PC 和PE 在肿瘤组中饱和度相较正常组均明显下调。
甘油磷脂代谢是食管癌一种重要的代谢途径。本研究中,LPC(16:0)、LPC(20:2)、LPC(18:0)、LPC(20:0)、 LPC(20:1)、 LPC(22:6)、 LPC(22:4)、 LPC(20:4)、LPC(18:2)、LPC(14:0)、LPC(20:3)、LPC(18:3)、LPE(20:0)、LPE(18:0)、LPE(20:1)和LPE(20:2)的水平在ESCC中降低,而LPE(22:5)、LPE(16:1)的水平则增高,提示哈萨克族ESCC 患者存在LPC 和LPE 代谢障碍。Xu等[17]的研究也表明LPC(14:0)水平在ESCC 患者血清中降低。LPC 和LPE 既是磷脂酰胆碱(PC)和磷脂酰乙醇胺(PE)的代谢产物,也是哺乳动物细胞膜的结构成分。一项研究表明,LPCs的低水平与乳腺癌、结肠癌的高风险直接相关[18]。也有研究表明LPEs通过抑制磷脂酶D(PLD)影响细胞增殖和迁移[19]。一项ESCC 研究表明,LPE(16:0)、LPE(20:4)和LPE(18:1)水平在ESCC患者血清中较高[20]。而本研究中得出LPE(20:0)、LPE(18:0)、LPE(20:1)和LPE(20:2)的水平在ESCC 中降低,而LPE(22:5)、LPE(16:1)的水平则增高。总之,哈萨克族ESCC 患者血浆磷脂水平异常提示脂质和能量代谢紊乱。
鞘磷脂(sphingomyelin,SM)是细胞膜的主要成分,鞘磷脂分布在细胞膜的两侧,外叶的鞘磷脂浓度较高。鞘磷脂生物合成涉及鞘氨酸合成,进一步酰化成神经酰胺[21]。相反,鞘磷脂(SM)分解导致神经酰胺(Cer)释放[22]。本研究发现SM(22:0)、SM(22:1)、SM(24:0)在ESCC组中的浓度低于正常对照组。鞘磷脂水平的升高具有促进肿瘤生长的作用,其机制是发挥促凋亡神经酰胺的减少[23]。研究报道,自噬相关蛋白9A(ATG9A)通过调节鞘磷脂水平破坏自噬体组织,被认为是自噬的负调节因子[24]。本研究还发现神经酰胺Cer(18:0/26:1)在ESCC 组中的浓度高于正常对照。Cer 作为第二信使分子,是神经鞘磷脂酶催化反应的产物,神经酰胺膜水平的增加可诱导线粒体释放细胞色素C,从而激活细胞凋亡通路[25]。一些新的癌症治疗策略旨在过表达神经酰胺生物合成途径关键酶,导致程序化癌细胞死亡[26]。先前的一项ESCC研究中发现,两种二氢神经酰胺Cer(d18:0/24:0)和Cer(d18:0/24:1)在转移性ESCC 中增加,Cer(d18:0/24:0)和Cer(d18:0/24:1)在小鼠实验转移模型中抑制转移灶的形成[27]。因此,神经酰胺可能是一种有希望干预ESCC转移的药物。
总而言之,本研究通过UPLC-MS/MS 检测平台对亚类脂质进行检测,哈萨克族ESCC 患者血清中不同的脂质变化,可能与构成细胞增殖所需膜结构的成分增加和能量代谢事件重编程相关,后期还需要在此次发现的标志物的基础上,进行具体的脂质分子通路间的研究。本研究有一定的局限性,研究中并未纳入其他民族脂质组学分析,仍值得进一步比较分析。

