不同发酵时间对沙米甜醅营养、感官品质及其酚类物质抗氧化活性的影响
黄玉敏, 韩富娟, 韩立宏
(北方民族大学生物科学与工程学院,银川 750021)
沙米是苋科沙蓬属一年生草本植物沙蓬的籽粒,具有耐寒、耐旱、耐贫瘠等特点,适于生长在沙漠或沙化地带[1],是优异的防风固沙先锋植物,也是一种药食兼用植物[2]。沙米富含蛋白质、粗脂肪、碳水化合物、矿物质等营养成分[3],其中Ca含量达到0.229 mg/g,显著高于糜子、黄米、糯米和燕麦,Fe含量约为30.650 mg/kg,显著高于黄米、糯米;Zn含量约15.735 mg/kg,显著高于水稻、黄米和糯米[4],有益于降血糖[5,6]、抗氧化[7,8]、降血脂[9]等。代表性的传统沙米食品有沙米转刀面、沙米凉粉、沙米羊肉面等[10]。目前国内外也有关于沙米深加工食品相关的零星研究报道,例如沙米酸奶[11,12]、沙米复配代餐粉[13]和沙米粉条[14]。由于其优异的营养价值和保健功能,且不与水稻、小麦、燕麦等常规粮食争夺种植土地,所以沙米被认为是潜在粮食作物[15,16]。因此,寻求经济实效的沙米深加工途径,开发高品质、低成本的沙米深加工食品,对于挖掘沙蓬的经济价值,推进沙漠生态环境治理与农业经济发展的有机结合具有非常重要的意义。
甜醅是我国宁夏、甘肃、陕西、青海等地区的民间传统小吃[15]。传统甜醅是以燕麦、荞麦、青稞等谷物为原料,经过甜酒曲固态发酵而成的低酒精度的食品[18],其醅汁如糖水、醅粒似果肉、口感甘甜且带有醇酒香味,有一定的降血脂和抗氧化能力[19]。本研究以沙米为原料,进行沙米甜醅制作,系统探究了不同处理时间所得沙米甜醅的营养价值、食用品质及其酚类物质抗氧化活性,以期为沙米资源的深加工利用及新型甜醅产品的研发和工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
沙米,产自腾格里沙漠甘肃省民勤地段(2021年秋收获);甜酒曲。
氢氧化钠,磷酸二氢钾,邻苯二甲酸氢钾,磷酸氢二钠,硼砂,冰乙酸,无水乙酸钠,酚酞,浓硫酸,可溶性淀粉,钨酸钠,铁氰化钾,硫代硫酸钠,甲醇;猪胰腺α-淀粉酶(50 U/mg),糖化酶(30~60 U/mg),葡萄糖苷酶(30~60 U/mg),D-G标准品,没食子酸标准品,ABTS,DPPH,Folin-Ciocalteu,均为分析纯。D-葡萄糖试剂盒(GOPOD)。
1.2 仪器与设备
H2050R-1高速冷冻离心机,BILON92-IIL超声波细胞粉碎机,LGJ-10S真空冷冻干燥器,AL 104分析天平,CR-400/410色彩色差计,UV-5500分光光度计。
1.3 实验方法
1.3.1 沙米甜醅制作
沙米与水的比例为1.0∶3.5(m/V),称取150.0 g沙米,加入525.0 mL蒸馏水,4 ℃条件下浸泡1 h,下锅蒸煮25.00 min,出锅自然冷却至25 ℃,加入0.3 g甜酒曲搅拌均匀,放入发酵箱在29 ℃和80%湿度条件下进行发酵。发酵时间分别设定为0、6、12、24、36、48、60 h。每个时间段发酵结束取出成品60 g立即进行测定,剩余部分冷冻干燥后磨粉过100目筛备用。
1.3.2 沙米甜醅pH变化
采用侯曼玲[21]的方法测定,沙米甜醅样品捣碎匀浆后称取5.00 g,量取50.00 mL煮沸冷却后的蒸馏水加入其中,振荡5 min后离心,离心参数设定为3 000 r/min 4 ℃。离心后取上清液用酸度计测定。
1.3.3 总酸含量测定
采用直接滴定法测定[22]。称量40.00 g沙米甜醅样品于150 mL三角瓶中,加入80 ℃的蒸馏水100 mL,沸水浴30 min,冷却至室温,转移至250 mL容量瓶,使用煮沸冷却后的蒸馏水定容,快速滤纸过滤。称取40.00 g滤液,置于250 mL三角瓶中,加50.00 mL水和0.20 mL 1%酚酞指示剂,用0.01 mol/L NaOH标准滴定溶液滴定至微红色且30 s不褪色,记录消耗0.01 mol/L氢氧化钠标准滴定溶液的体积,计算总酸含量。
1.3.4 还原糖含量测定
采用铁氰化钾法[23]进行测定。称取沙米甜醅样品5.00 g于100 mL锥形瓶中,依次加入5.00 mL 95%乙醇和50.00 mL乙酸缓冲液,振摇匀后立即加入2.00 mL 12%的钨酸钠溶液,振摇5 min。精确吸取样品溶液0.50 mL于试管中,再精确加入5.00 mL铁氰化钾溶液,混匀后立即将试管浸入沸水浴中,并确保试管内液面低于沸水液面下3~4 cm,加热20 min,取出试管用冷水浴冷却。将试管内液体倒入100 mL锥形瓶中,用25.00 mL乙酸盐溶液振洗试管后倾入锥形瓶中,加5.00 mL 10% 碘化钾溶液,混匀后立即用0.10 mol/L硫代硫酸钠溶液滴定至淡黄色,再加1.00 mL淀粉溶液,继续滴定直至溶液蓝色消失,记下消耗硫代硫酸钠溶液体积,计算还原糖含量。
1.3.5 游离氨基酸含量测定
采用茚三酮比色法进行测定[24]。配制谷氨酸标准溶液,绘制标准曲线,然后根据标准曲线计算沙米甜醅冻干粉中游离氨基酸的含量。
1.3.6 总酚含量测定
采用福林酚法进行测定[25]。取2.50 g沙米甜醅冻干粉置于50.00 mL体积分数80%的甲醇溶液中,37 ℃水浴中振荡取(120 r/min)2 h,接着室温超声30 min, 3 000 r/min 离心15 min得多酚提取液。精确称取没食子酸标准品0.011 0 g,用蒸馏水溶解并定容至100 mL,得质量浓度为0.110 0 mg/mL 的标准溶液,准确吸取0.00、0.50、1.00、1.50、2.00 mL分别置于25 mL的棕色容量瓶中,分别加蒸馏水6.00、5.50、5.00、4.50、4.00 mL,然后分别加入福林酚试0.50 mL混匀,最后在8 min之内加入0.50 mL质量分数20%的碳酸钠溶液,充分混匀后定容,25 ℃避光放置1 h,760 nm下测定吸光值。测定结果以没食子酸当量表示(mg 没食子酸/g 甜醅干物质)。标准曲线方程为y=79.131x+0.0105,决定系数R2=0.999 5。
1.3.7 抗氧化能力测定
采用Kim等[24]的方法测定沙米甜醅多酚提取液的DPPH游离基清除能力。配制0.40 mmol/L的DPPH无水乙醇溶液,分别取2.00 mL多酚提取液和 2.00 mL DPPH溶液混匀,避光条件下反应30 min,反应液在517 nm处测定其吸光值。以2.00 mL无水乙醇替代2.00 mL DPPH溶液配制对照组,以2.00 mL无水乙醇替代2 mL多酚提取液配制空白组,其他条件同上。DPPH 自由基清除率按照公式进行计算:
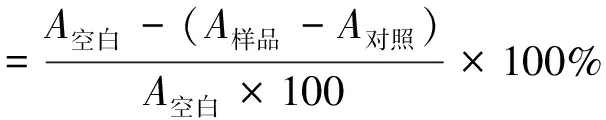
式中:A空白为2 mL DPPH溶液和2 mL无水乙醇的混合液体的吸光度;A对照为2 mL多酚提取液和2 mL无水乙醇的混合液体的吸光度;A样品为2 mL DPPH溶液和2 mL多酚提取液的混合液体的吸光度。
采用水杨酸法测定沙米甜醅酚类物质羟基自由基清除能力[27]。将沙米甜醅多酚提取液、FeSO4溶液(6 mmol/L),水杨酸溶液(6 mmol/L)H2O2溶液(6 mmol/L)各2 mL依次加入25 mL容量瓶中,摇匀定容10 mL,在510 nm处测定其吸光度,取空白溶液对比。
1.3.8 体外消化特性测定
采用Englyst[28]的方法对发酵沙米甜醅的体外消化性进行测定。称取1.00 g糖化酶溶于10.00 mL蒸馏水中,使用磁力搅拌器搅拌30 min后1 500 g离心10 min制得糖化酶溶液。称量1.00 g α-淀粉酶溶于16.30 mL蒸馏水中,使用磁力搅拌器搅拌30 min后1 500 g离心10 min制得α-淀粉酶溶液。取0.10 mL糖化酶溶液并向其中加入8.00 mL α-淀粉酶溶液,用磁力搅拌器混合均匀,制成酶液。称取100 mg沙米甜醅冻干粉末(干基)于50 mL离心管中,向离心管中加入4.00 mL酶液和20.00 mL醋酸钠缓冲液,混匀后在37 ℃恒温水浴振荡器中振荡20 min和120 min 取出。用移液枪吸取0.10 mL样液于2.00 mL离心管中,向离心管中加入95%乙醇0.90 mL,5 000 r/min离心10 min,取上清液0.10 mL于5.00 mL离心管中,加入3.00 mL葡萄糖氧化酶/过氧化物试剂,放入恒温水浴锅在40~50 ℃下恒温水浴20 min。将离心管取出后用分光光度计在510 nm处测量吸光度值。
1.3.9 色泽测定
将经过不同时间发酵处理所得的沙米甜醅匀浆后,称取30.00 g用保鲜膜包裹,使用高精度色差仪多点测定样品的亮度(L值)、红绿值(a,偏红为正值,偏绿为负值)和黄蓝值(b,偏黄为正值,偏蓝为负值)。样品的白度值w=L-a-b。
1.3.10 沙米甜醅食用品质评价
参照张杰等[29]的方法,在保持发酵终点一致的基础上,根据不同发酵时间制备样品并进行发酵。发酵结束后,取出所有样品,室温放置10 min,由10位经过专业感官评价训练的评定员进行感官评价。沙米甜醅的感官评价指标及评定标准见表1。感官评分采用模糊数学法进行统计。因素集A={A1气味,A2组织状态,A3滋味,A4色泽};各因素权重B={0.3,0.2,0.3,0.2};评语集C={良好,中等,差},其中良好得分在80~100分,中等在50~79分,差在0~49分。感官评定员对不同发酵时间段的沙米甜醅一一进行评定,各因素每个等级所得的票数除以参与感官评定的评定人员总数,得到模糊矩阵W。模糊关系综合评定集Z=B(各因素权重集)×W(模糊矩阵)。

表1 感官评价标准
1.4 数据统计与分析
除色差的测定每个样品重复6次之外,其余指标的测定均重复3次。测试数据采用SPSS 25.0软件分析,并通过多因素方差分析法(Duncan法,P<0.05)进行差异显著性分析,实验结果表示为“平均值±SD(标准差)”。采用Origin 2018软件绘图。
2 结果与分析
2.1 沙米甜醅在不同发酵时间下的pH和总酸含量变化
由图1可知,发酵时间在0~12 h之间时,沙米甜醅pH呈现缓慢下降的趋势,总酸含量随着发酵时间的延长没有发生显著性变化(P>0.05);当发酵时间超过12 h后,沙米甜醅中的pH随发酵时间延长显著降低(P<0.05),而总酸含量随之显著增大(P<0.05);当发酵达到48 h之后,随着发酵继续进行,甜醅pH和总酸含量不再发生显著性变化(P>0.05)。pH降低反映了发酵体系中微生物的繁殖速率和代谢活性[30]。pH变化趋势说明沙米发酵体系在12 h后进入发酵高峰期。发酵引起的乳酸和其他有机酸的积累使得沙米中的总酸含量显著升高。本研究采用以米根霉为主要菌种的甜酒曲,发酵过程中总酸含量的增大与米根霉分解沙米籽料中的淀粉,利用碳源大量产酸有关。 pH下降可以起到防腐作用,防止与腐败有关的微生物及其他致病微生物的生长繁殖[31],总酸积累也可赋予发酵体系丰富的口感[32]。

图1 沙米甜醅在不同发酵时间下的pH和总酸含量变化
2.2 沙米甜醅在不同发酵时间下的还原糖和游离氨基酸含量变化
由图2可知,发酵时间为0~12 h的时候,沙米甜醅中的还原糖和游离氨基酸含量没有随着发酵进行发生显著性变化(P>0.05);12~48 h的时候,沙米甜醅中的还原糖和游离氨基酸含量随着发酵时间延长显著(P<0.05)升高;发酵达到48 h之后,两者的含量均随着发酵进行显著下降(P<0.05)。
还原糖是发酵体系中微生物可以直接利用的碳源,其在发酵过程中的含量变化趋势直接反映微生物的生长情况。本实验中还原糖随着发酵进程的变化规律,说明发酵12 h以上时,甜酒曲中的米根霉大量繁殖,并分泌大量糖化酶,酶分解淀粉使得发酵体系中的还原糖含量急剧上升[33]。发酵48 h之后,一方面糖化酶活力下降,另一方面还原糖又用于酒精发酵[34],因此还原糖含量随着发酵持续进行显著下降。甜醅发酵过程中,还原糖量的积累可以增进沙米甜醅的甘甜口感的形成。发酵前的蒸煮处理增大了沙米蛋白的溶解度,为发酵过程中微生物能够更有效地利用沙米蛋白提供了可能,微生物分解蛋白产生其生长所需要的小分子氮源。同时,微生物代谢的蛋白水解酶使得大量蛋白质水解,使得发酵体系中游离氨基酸数量显著增加。发酵48 h后,与还原糖变化同样的原因导致发酵体系中游离氨基酸数量呈现下降趋势。发酵过程中微生物对蛋白的水解,不但可以极大增强人体对蛋白的利用率[32],而且各种呈味氨基酸的产生与相互配合对沙米甜醅的风味也发挥了非常重要的作用。
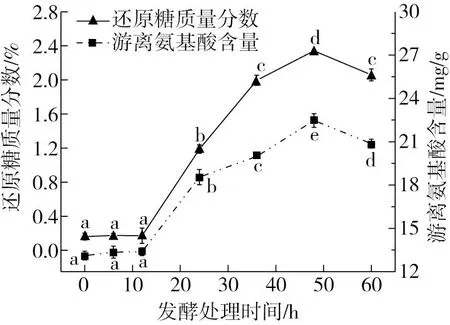
图2 沙米甜醅在不同发酵时间下的还原糖和游离氨基酸含量变化
2.3 沙米甜醅在不同发酵时间下的酚类物质含量及其抗氧化活性变化
由图3可知,0~24 h之内,沙米甜醅的总酚含量随着发酵时间的进行无显著性变化(P>0.05),当发酵时间超过24 h后,沙米甜醅中的总酚含量随着发酵时间的延长呈现显著增大(P<0.05)的趋势。发酵前期(0~24 h),发酵体系中的总酚含量几乎无变化,这是因为微生物在这个阶段主要消耗发酵体系中的营养物质进行繁殖,而沙米中酚类物质的转化或生成尚未开始。随着发酵的逐步完成,一方面,存在于沙米籽粒中的结合态酚在微生物酶和发酵所产酸的作用下转化为游离酚[35];另一方面,微生物代谢可以改变沙米中的生物活性物质,合成酚类化合物等新的物质[32],所以,发酵体系中的总酚含量随着发酵进程显著增大。

图3 沙米甜醅在不同发酵时间下的酚类物质含量变化
由图4可知,沙米甜醅的抗氧化活性随着发酵时间的变化趋势与甜醅中总酚含量呈现高度正相关关系。酚类物质的抗氧化活性与其化学结构息息相关[36]。这说明甜醅发酵不但增大了发酵体系中总酚类物质的含量,而且对酚类物质的抗氧化活性不会产生显著的破坏性影响。

图4 沙米甜醅在不同发酵时间下的抗氧化活性变化
2.4 沙米甜醅在不同发酵时间下的淀粉体外消化特性的变化
依据淀粉在人体内的消化情况可将为其分为快速消化淀粉、慢速消化淀粉和抗性淀粉3类,快速消化淀粉,指进食后20 min内在口腔和小肠中被快速消化吸收的部分,慢消化淀粉,指进食后20~120 min间可在小肠中被完全消化吸收但速度缓慢的淀粉,而抗性淀粉则指在进食120 min后依然不能被小肠消化吸收的淀粉[37,38]。由图5可知,当发酵时间达到36 h及以上时,沙米淀粉中的快速消化淀粉相比未发酵样品显著下降(P<0.05),而抗性淀粉含量相比未发酵样品显著升高(P<0.05)。随着发酵的进行,一方面酒曲微生物代谢的糖化酶、α-淀粉酶对淀粉进行了水解;另一方面发酵产酸使得淀粉处于酸性环境。已有研究表明,淀粉酶处理及酸处理均会增加大米淀粉中抗性淀粉含量[39],所以当发酵进行到一定程度后沙米甜醅的抗性淀粉含量会有所增加。

图5 沙米甜醅在不同发酵时间下的淀粉体外消化特性的变化
2.5 沙米甜醅在不同发酵时间下的的色泽变化
色泽是影响食品商品价值的重要指标之一。由表2可知,发酵0~12 h的时候,沙米甜醅的a、b、L和w值随着发酵进行均没有发生显著性变化(P>0.05),当发酵时间达到24 h及以上时,不同发酵时间所得沙米甜醅样品的a、b和L值均显著(P<0.05)大于未发酵产品。沙米甜醅的w值也随着发酵时间的延长发生不规律的变化。这些结果说明,24 h及以上的发酵处理使得沙米样品相对于未发酵样品在色泽上更红更黄,亮度更高。酚类物质及其所处食品体系的酸碱度跟食品色泽直接相关[40,41]。甜醅发酵处理增大了沙米体系中总酚类物质的含量,而且随着发酵进行沙米体系的pH不断下降,这些因素都会直接引起发酵体系色泽的改变。
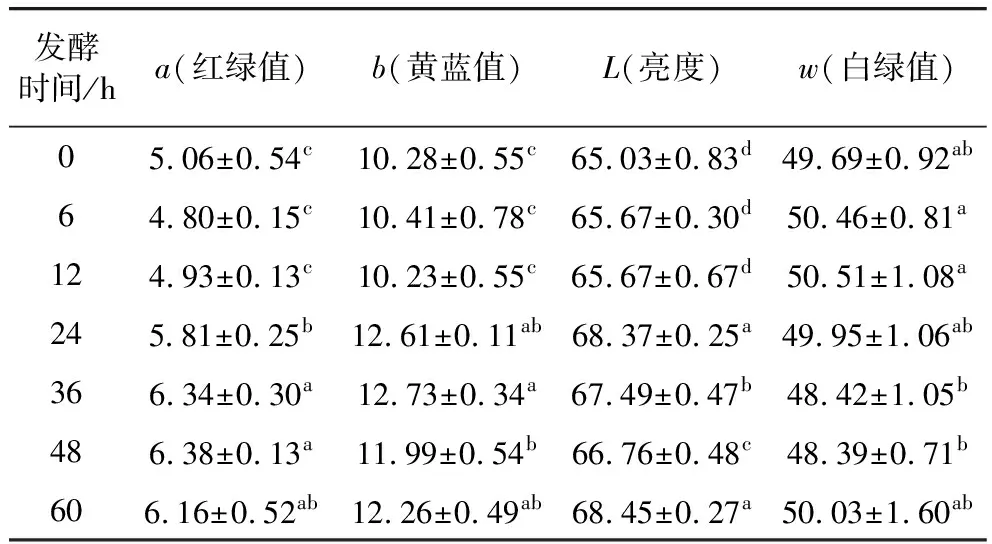
表2 沙米甜醅在不同发酵时间下的的色泽变化
2.6 发酵时间对沙米甜醅感官品质的影响
未经发酵的沙米煮制样品固体胚比较干爽疏松,沙米籽粒相对完整分散。随着发酵时间的延长,沙米籽粒不断变软,胚体质地不断变得致密,总体积不断减小,有汁液流出。由表3可见,随着发酵时间延长,沙米甜醅的感官品质评分显著增大(P<0.05),发酵48 h时,沙米甜醅的感官品质评分最高,这时的沙米甜醅的酒香味浓而不腻,颗粒均匀完整,有少量的液体,酸甜适中,具有一定的咀嚼性。发酵超过48 h之后,沙米甜醅的酒香味过重,且醅粒破裂严重,没有咀嚼性,口感较差,所以感官评分显著(P<0.05)下降。
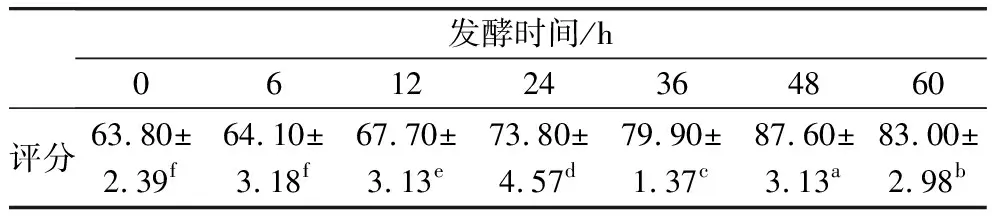
表3 不同发酵时间沙米甜醅的食用品质评定结果
3 结论
甜醅发酵过程借助米根霉代谢酶对沙米籽粒中淀粉、蛋白质的降解作用,显著改变了蒸煮沙米的营养组成、质地形态和食用品质。适当发酵时间(48 h)显著提高了沙米固态胚中总酸、总还原糖、游离氨基酸和总酚的含量及其抗氧化活性,所得沙米甜醅的酒香味浓而不腻,颗粒均匀完整,有少量的液体,酸甜适中,具有一定的咀嚼性,感官评价得分最高。后续可进一步研究多菌种复合发酵处理对不同产地、不同直链淀粉含量沙米的营养和食用品质的影响。

