绵羊超数排卵中血清代谢物变化比较分析
冯 睿, 徐全忠, 王春伟, 王乐群, 冯 爽, 张海龙, 张 立, 张立果, 苏小虎
(1. 内蒙古大学生命科学学院省部共建草原家畜生殖调控与繁育国家重点实验室, 呼和浩特 010020;2. 内蒙古乌兰察布市凉城县农牧和科技局凉城县畜牧工作站, 乌兰察布 013750;3. 内蒙古乌兰察布市农牧和科技局乌兰察布市畜牧工作站, 乌兰察布 012000)
超数排卵是利用外源性促性腺激素在一个发情周期内诱导多个卵泡同时发育,结合胚胎移植技术实现优良家畜个体快速繁殖。然而在生产应用中,供体生产胚胎的效率受多方面影响。寻求合适的表征指标以进行供体筛选是提高超数排卵效率的可行手段之一。除了促卵泡激素(FSH)和促黄体生成素(LH)外,一些小分子代谢物也可以影响卵泡发育。已有研究表明,卵泡液中的一些代谢物不仅影响卵母细胞和颗粒细胞的质量,还可以用来表征卵泡发育[1]。卵泡液中的脂肪酸浓度、氨基酸浓度、葡萄糖类代谢产物均可对卵子成熟产生影响,可用于卵泡发育状态表征[2-4]。有研究表明,卵泡液的一些小分子物质来自血液[5]。因此,血液中的某些代谢物将是反映卵泡发育状况的可行指标。
本实验选取年龄和体重相近的东佛里生绵羊作为供体,分别于卵泡刺激素(FSH)注射前(1st)和人工授精前(2nd)采集血液。外源FSH注射前,卵泡优势化成熟尚未启动,此时应全部为小卵泡。人工授精前,此时已确认供体发情,卵泡已成熟,卵母细胞进入成熟阶段。采用LC-MS/MS进行非靶向代谢组学分析,研究超数排卵时血清代谢物与胚胎产生的关系,可以为胚胎生产中提供饲喂方面的理论依据,也为卵子体外成熟培养体系的优化提供参考。
1 材料与方法
1.1 实验地点与供体母羊管理
供体母羊饲养于内蒙古乌兰察布市丰东知盈牧业科技有限公司。本研究选用的超数排卵供体为1~3岁身体健康、体重65~70 kg的经产东佛里生绵羊。以母羊的营养需求为基础,在畜舍饲养中统一管理。饲料配比:13.60%苜蓿干草、27.30%羊草、4.60%玉米草、15.20%全株玉米青贮、15.20%玉米粒、24.10%母羊精料,粗精比为70∶30。
1.2 方法
1.2.1 超数排卵方法
试验开始前首先进行发情检测,选取未发情供体同期发情及超数排卵流程如下:随机一天将CIDR(Zoetis, New Zealand)插入未发情期母羊阴道内,记为D0;在第10~12天,共250 μg FSH(Stimufol®,Belgium)以10%的递减剂量注射6次;第一次注射FSH时,同步注射250 IU PMSG(Reprobiol,New Zealand);第5次FSH注射时,同步注射PG(Reprobiol,New Zealand)150 μg;最后一次注射FSH时去除CIDR;第13天,检测发情,若母羊已发情,则人工授精2次(间隔12 h);第一次人工授精注射100 IU LH (Reprobiol,New Zealand);第19天,用盐酸利多卡因麻醉后,通过手术冲洗子宫收集胚胎(图1)。
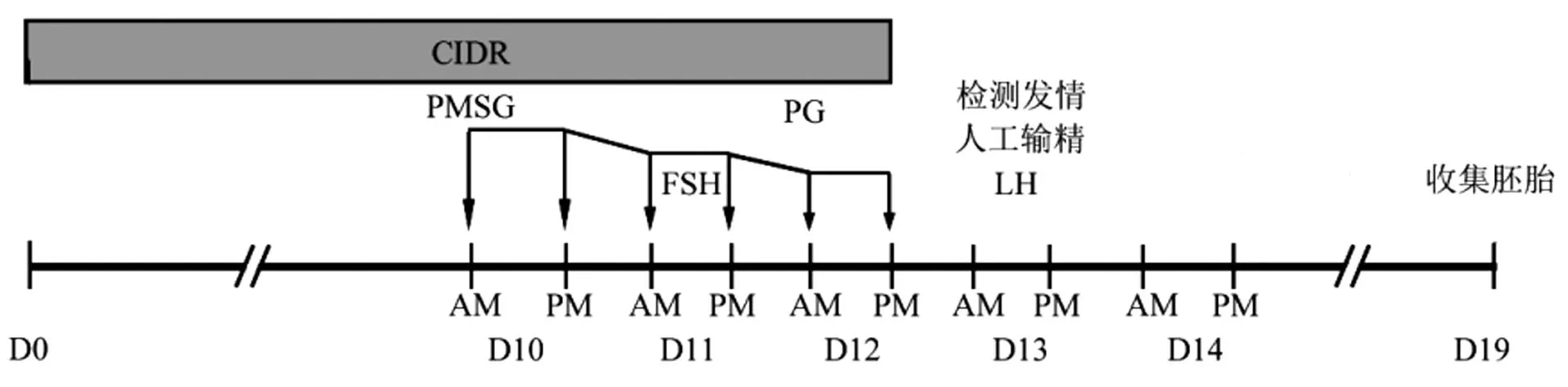
图1 绵羊超数排卵示意图Figure 1 Schedule of ovine superovulation
1.2.2 血液样品采集
卵泡刺激素(FSH)注射前(1st,D10)和人工授精前(2nd,D13)采血,保存在真空采血管中。然后12 000 r/min离心10 min,获得血清。所有血清样本均保存在液氮中,并立即运送到实验室进行进一步分析。
1.2.3 代谢物的提取
首先,将样品和预冷的甲醇通过涡旋混合。混合后的样品在冰上孵化5 min,然后在15000 r/min,4 ℃下离心20 min。用LC-MS级别的水将部分上清液稀释到含有53%甲醇的最终浓度。然后将样品转移到一个带有0.22 μm过滤器的新离心管中,在15000 r/min、4 ℃下离心20 min。最后,将滤液注入LC-MS/MS系统处理。
1.2.4 LC-MS/MS分析
液相色谱-质谱联用仪(Liquid Chromatograph Mass Spectrometer,LC-MS/MS)分析由诺禾致源公司处理。
LC-MS/MS分析使用Vanquish UHPLC系统(ThermoFisher)和Orbitrap Q Exactive系列质谱仪(ThermoFishe)进行。样品被注入Hyperil Gold柱(100×2.1 mm,1.9 μm),使用17 min的线性梯度,流速为0.2 mL/min。正极性模式的洗脱液为洗脱液A(水中0.1%FA)和洗脱液B(甲醇)。负极性模式的洗脱液为洗脱液A(5 mmol/L乙酸铵,pH 9.0)和洗脱液B(甲醇)。溶剂梯度设置:2%B,1.5 min;2%~85%B,3 min;100%B,10 min;100%~2%B,10 min;2%B,12 min。Q Exactive质谱仪在正/负极性模式下运行,喷雾电压为3.5 kV,毛细管温度为320 ℃,鞘内气体流速为35 arb,辅助气体流速为10 arb。
1.2.5 原始数据分析
使用Compound Discoverer 3.1(CD3.1,Thermo Fisher)对LC-MS/MS产生的原始数据文件进行处理。将峰与mzCloud(https:∥www.mzcloud.org/)和ChemSpider(http:∥www.chemspider.com/)数据库进行匹配。使用统计软件R(R-3.4.3版本)、Python(Python 2.7.6版本)和CentOS(CentOS 6.6版本)进行统计分析。
1.2.6 代谢物数据分析
使用HMDB(人类代谢组数据库,http:∥www.hmdb.ca/)、KEGG(京都基因与基因组百科全书,http:∥www.genome.jp/kegg/)和Lipidmaps(脂质代谢途径研究计划,https:∥lipidmaps.org/)数据库对代谢物进行注释。利用metaX进行主成分分析(Principal Component Analysis,PCA)和偏最小二乘法判别分析(Partial Least Squares Discriminant Analysis,PLS-DA),单变量分析(t检验)来计算统计学意义(P值)。根据VIP(Variable important in projection,一般变量权重值)>1且P值<0.05,FC(Fold Change,差异倍数)>1.2或FC<0.83条件筛选出的代谢物被认为是差异代谢物。
2 结果与分析
2.1 超数排卵供体黄体及胚胎形态观察
超数排卵后第19天供体黄体形态如图2(a)所示,为红体状态。E6.5胚胎大部分为桑葚胚,如图2(b)所示。

(a)超数排卵后第19天供体黄体形态;(b)E6.5胚胎。图2 超数排卵供体黄体及胚胎形态Figure 2 Donor corpus luteum and embryonic morphology in sheep during multiple ovulation
2.2 代谢物总览
研究共发现1 158种代谢物,其中,正离子模式下发现721种,负离子模式下437种。使用HMDB和KEGG对其进行注释分析,共有617种被注释,其中,正离子模式下350种,负离子模式下267种。正离子模式注释显示,代谢种类最多的是脂类和脂类分子(91个代谢物),其次是有机酸及其衍生物(63个代谢物)和有机杂环化合物(22个代谢物)。负离子模式注释显示,代谢种类最多的是脂类和脂类分子(81种),其次是有机酸及其衍生物(41种)和苯类(21种)。
2.3 多元统计分析
本研究应用主成分分析(PCA)来确定绵羊超数排卵过程中血清代谢物之间的样品分离和聚集程度。聚集的点表示观察到的变量高度相似,离散的点代表观察到的变量的显著差异。结果显示,在正离子模式下,PC1、PC2分别为20.55%和14.04%[图3(a)];在负离子模式下,PC1、PC2分别为24.02%和16.09%[图3(b)]。结果表明,绵羊超数排卵前后血清代谢物有明显的分离,具有不同的代谢物特征。

(a)正离子模式;(b)负离子模式。图3 绵羊超数排卵中血清代谢物主成分分析(PCA)Figure 3 Principal component analysis of the metabolites in sheep during multiple ovulation
研究采用偏最小二乘法判别分析(PLS-DA)来确定各组之间的具体差异。在绵羊超数排卵前后血清代谢物的比较中,正离子模式下PLS-DA模型的R2Y为0.94,Q2Y为0.68[图4(a)];负离子模式下PLS-DA模型的R2Y为0.92,Q2Y为0.70[图4(b)]。这些结果表明,后续分析可信。

(a)正离子模式;(b)负离子模式。图4 绵羊超数排卵中血清代谢物偏最小二乘法判别分析(PLS-DA)Figure 4 PLS-DA score map of the metabolites in sheep duringmultiple ovulation
2.4 差异代谢物分析
根据VIP>1和FC>1.2或FC<0.83和P<0.05筛选,在两次分析中鉴定出295个差异代谢物(175个为正离子模式,120个为负离子模式)。与1st相比,2nd上调代谢物186种(其中,正离子模式85种,负离子模式101种),下调代谢物共109种(其中,正离子模式90种,负离子模式19种)(图5)。

(a)正离子模式;(b)负离子模式。图5 绵羊超数排卵中血清代谢物热图Figure 5 Volcano plot results of the metabolites in sheep during multiple ovulation
第一次分析中优势代谢物含量最高的10种代谢物是2-Oxindole、Dihydroroseoside、4′-(Imidazol-1-yl)acetophenone、Ethyl-D-glucuronide、HQH、Progesterone、N-{4-[(2R,3R)-3-(Hydroxymethyl)-5-oxo-2-morpholinyl]phenyl}acetamide、DNH、2-Furoylglycine和4-decyl-3-hydroxy-5-oxooxolane-2,3-dicarboxylic acid(表1);第二次分析中优势代谢物含量最高的10种代谢物是11,12-Epoxy-(5Z,8Z,11Z)-icosatrienoic acid、11-Deoxy prostaglandin F2、2-methoxy-3,5-dimethyl-6-[(E)-3-methylundec-2-enyl]pyran-4-one、2-hydroxy-6-[(8Z,11Z)-pentadeca-8,11,14-trien-1-yl]benzoic acid、Eicosapentaenoic acid、SKK、Anacardic acid、FAHFA (17:0/19:2)、FAHFA (17:0/20:3)和16(R)-HETE(表2)。
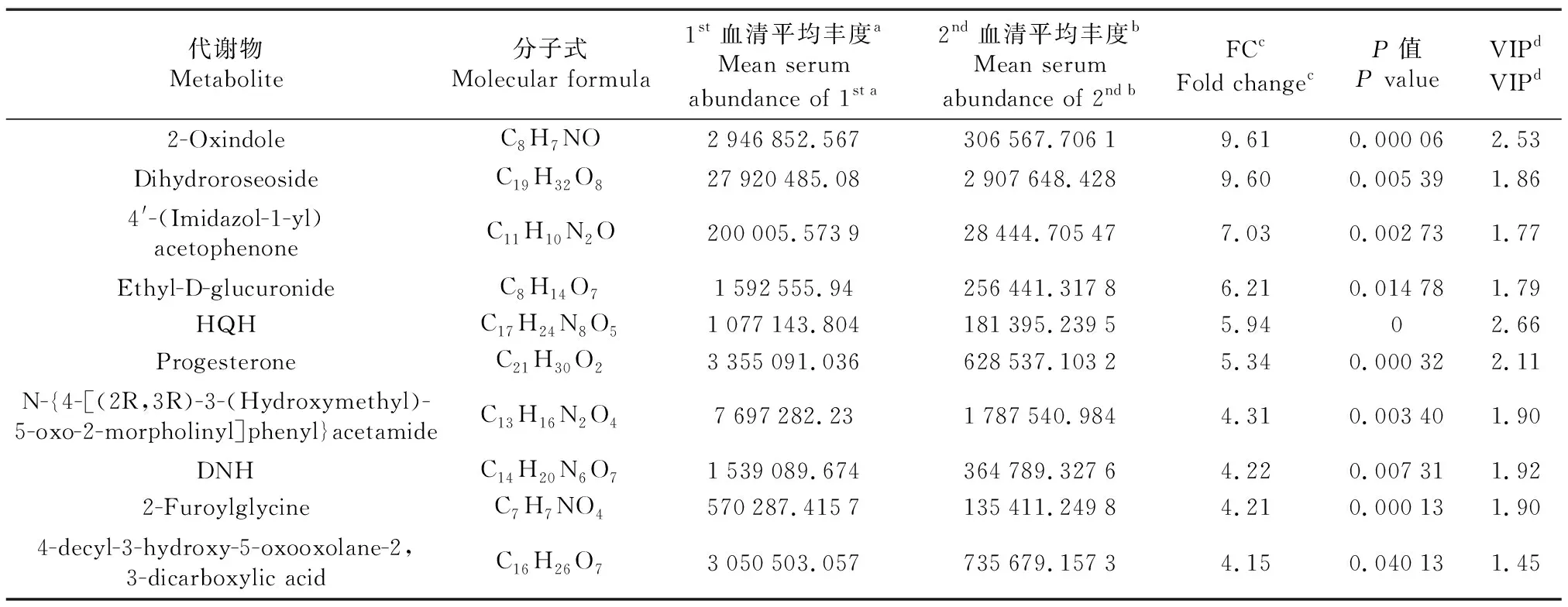
表1 绵羊超数排卵中外源FSH注射前的血清前10优势代谢物Table 1 Top 10 dominant metabolites before FSH injection in sheep during multiple ovulation

表2 绵羊超数排卵中人工输精前的血清前10优势代谢物Table 2 Top 10 dominant metabolites before artificial insemination in sheep during multiple ovulation
2.5 差异代谢物功能富集分析
KEGG途径富集显示,绵羊超数排卵过程中的优势代谢物分别在正负离子模式下富集到39和49条功能通路(图6)。正离子模式下富集的途径包括类固醇激素生物合成、花生四烯酸代谢、胆汁分泌、皮质醇合成和分泌等。负离子模式下的富集途径包括不饱和脂肪酸生物合成、卟啉和叶绿素代谢、花生四烯酸代谢、脂肪酸生物合成等。
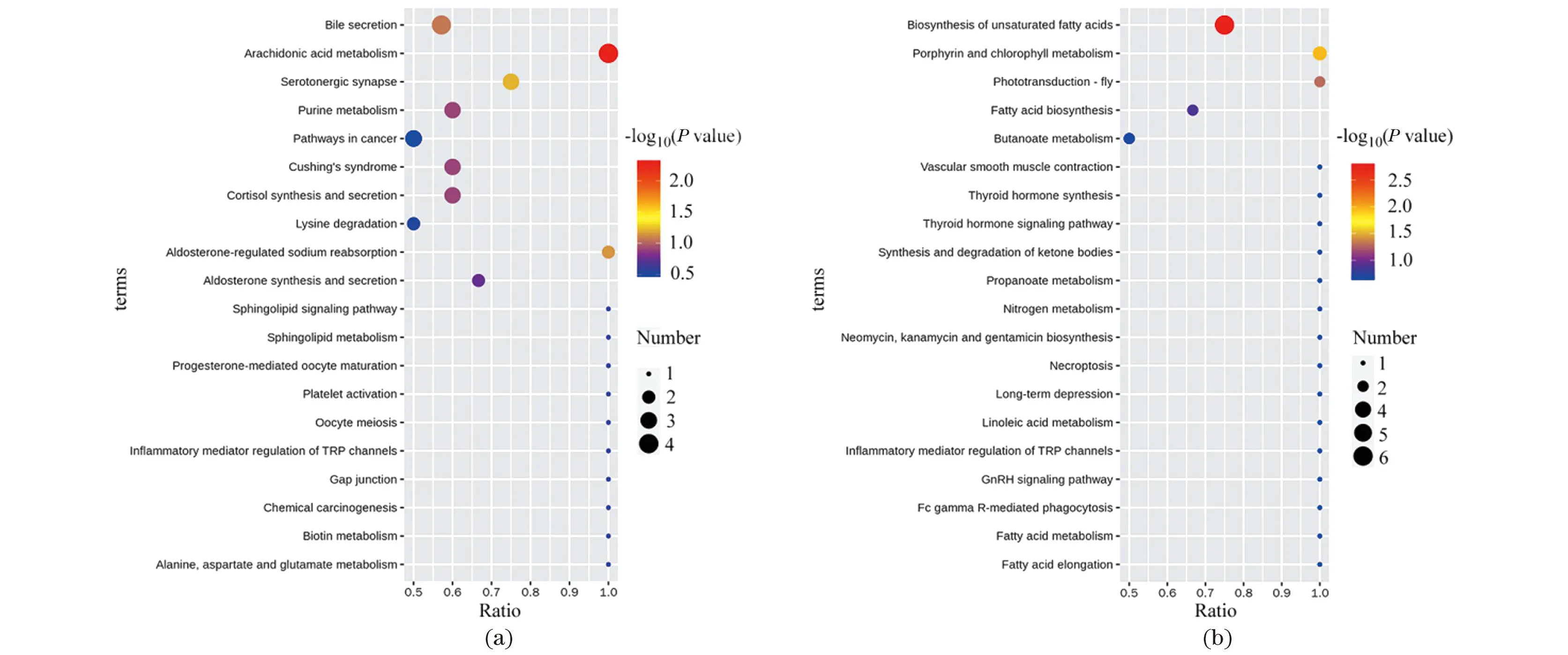
(a)正离子模式;(b)负离子模式。图6 绵羊超数排卵中血清代谢物富集 KEGG pathwayFigure 6 Metabolites enriched KEGG pathway in sheep during multiple ovulation
3 讨论
除生殖激素外,血液中的一些代谢物也与超数排卵过程中卵泡发育和卵子成熟有关。本研究通过FSH注射前与人工授精前的血清代谢组比较,发现295种代谢物在超数排卵过程中发生变化。对其进行功能分析表明,一些代谢物与卵泡成熟相关,具有明显的生物学功能。
3.1 促进卵泡发育的代谢物
一些代谢物在人工授精前含量较高,可能有助于卵泡的成熟,如类固醇类脱氧皮质酮(Deoxycorticosterone)和皮甾酮(Cortodoxone);磷脂酰胆碱类PC (16∶1E/10∶0)和PC(19∶2/18∶4);不饱和脂肪酸类硬脂炔酸(Octadec-9-ynoic acid)、十八碳烯酸(反-6)(trans-Petroselinic acid)和花生四烯酸(Arachidonic acid)。脱氧皮质酮和皮甾酮主要参与甾体激素的生物合成和皮质醇的合成及分泌。脱氧皮质酮既是一种有效的矿物皮质激素,也是一种糖皮质激素。它能刺激某些鱼类[6]和母鸡[7]的卵母细胞成熟。对猕猴的研究也发现,在排卵刺激前和受精后6 h,脱氧皮质酮的含量存在差异[8]。而且,颗粒细胞可能在体内从含胆固醇的脂质合成21-羟化酶衍生的矿物皮质激素,通过矿物皮质激素受体介导的事件促进排卵后黄体的形成[9]。在受精时添加脱氧皮质酮或皮甾酮会改变皮质类固醇受体的调节,并加快孵化[10]。与其他研究相似,本研究表明血清中脱氧皮质酮和皮甾酮可能有助于绵羊超数排卵中卵泡的发育。
磷脂酰胆碱(PC)是两性分子,是生物膜的重要组成部分,在细胞膜的通透性、物质交换、信号传递等功能中起重要作用。磷脂酰胆碱的内稳态对细胞的生存和生长很重要。研究发现,细胞内磷脂酰胆碱总量与细胞生长和凋亡相关,与生长呈正相关,与凋亡呈负相关[11]。在磷脂酶的作用下,磷脂酰胆碱可以增加亚油酸的产生。亚油酸氧化代谢产生13-过氧羟基-9,11-十八碳二烯酸(13-HPODE)(13-Hydroperoxy-9,11-octadecadienoic acid),通过参与EGF受体去磷酸化增强表皮生长因子信号转导[12]。EGF是一种表皮细胞生长因子,可诱导哺乳动物卵巢积云的扩大[13]。此外,复发性流产患者卵泡液中油酸水平降低。油酸可减轻饱和脂肪酸对卵母细胞发育的不良影响[14]。它不仅能调节脂肪酸代谢和细胞内信号,还能降低氧化应激,从而促进卵母细胞和着床前胚胎的发育[15]。硬脂炔酸和十八碳烯酸(反-6)是油酸的重要异构体[16-17]。超数排卵时血清磷脂酰胆碱含量和亚油酸合成增加,提示在此过程中脂质代谢增强。因此,可以利用磷脂酰胆碱、硬脂炔酸和十八碳烯酸(反-6)作为绵羊超数排卵卵泡成熟的血清标志代谢物。
目前已有大量体外实验表明,不饱和脂肪酸的含量会影响哺乳动物的生殖性状。饲喂不饱和脂肪酸(油酸和亚油酸)比例较高的饲粮,围产期奶牛卵泡平均直径增大;排卵前卵泡内雌激素、雄激素等甾体激素浓度升高[18]。Robinson等[19]发现,当饲喂富含亚油酸(C18:2,ω-6 PUFA)或亚麻酸(C18:3,ω-3 PUFA)的饲粮时,卵巢中卵泡的数量增加。因此,饲粮中添加不饱和脂肪酸[如硬脂炔酸和十八碳烯酸(反-6)]可提高绵羊的超数排卵水平,这可能是提高绵羊繁殖力的一种潜在策略。
花生四烯酸是一种长链多不饱和脂肪酸,通过影响类固醇激素和前列腺素的生物合成来调节动物生殖过程[20]。花生四烯酸及其代谢物是类固醇激素生产调节的限速步骤[21]。胆固醇通过类固醇激素合成的急性调节蛋白(StAR)从线粒体外膜运输到内膜[22],进一步对StAR启动子DNA序列的研究表明,5-HPETE增强了StAR启动子的活性,促进了StAR蛋白的表达,增加了类固醇合成的量[23]。此外,花生四烯酸在一系列酶的作用下可合成多种具有生物活性的PGH 2[22]。这些合成的前列腺素作为内部分泌物从细胞中释放,并与分布在邻近靶细胞上的g蛋白偶联受体结合,以调节基本的生殖过程,包括排卵、卵泡发育、叶黄素溶解和分娩[24-25]。因此,本研究结果提示花生四烯酸和8(R) -羟基二十碳四烯酸[8(R) -hydroxy-eicosatetraenoic acid]是预测卵泡成熟的潜在标志代谢物。
3.2 抑制卵泡发育的代谢物
本研究结果表明,黄体酮在超数排卵中下调。黄体酮在绵羊未成熟卵泡中含量较高,可作为绵羊未成熟卵泡的标记代谢物。黄体酮的主要生理作用是由孕激素受体(PGR)介导的。研究结果表明,黄体酮抑制卵泡生长,至少部分作用是在卵巢内发挥的。卵巢黄体可提高大鼠、猴子[26]和人[1]体内黄体酮的循环水平,进而抑制大卵泡的生长发育。在大鼠中,黄体酮通过抑制垂体分泌的促性腺激素而起作用,促性腺激素是卵泡生长所必需的。在人类和猴子的卵巢中,黄体酮的部分抑制作用可能直接在卵巢内发挥。当黄体酮水平很低且稳定时,黄体生成素的积累和孕激素受体变得敏感。因此,黄体化前黄体酮增加可引起LH和FSH含量迅速增加,继而排卵[27-28]。相反,如果黄体酮活性持续高于生理触发水平,则会导致促性腺激素释放激素受体脱敏,进一步使促性腺激素无法积聚或激增,从而阻碍排卵[29]。此外,黄体酮还能抑制卵巢颗粒细胞有丝分裂和卵巢颗粒细胞的凋亡[30]。这表明黄体酮在维持卵泡数量平衡中起着重要作用,可能会抑制卵泡成熟。
4 结论
研究通过LC-MS/MS非靶向代谢组技术对绵羊超数排卵中血清代谢物进行全面对比分析,结果表明血清中高含量的脱氧皮质酮、磷脂酰胆碱和花生四烯酸可能有助于绵羊超数排卵卵泡的发育。研究结果为超数排卵中卵泡发育调控机制解析提供一定帮助,为超数排卵过程中的营养调控和供体选择提供参考。
——碳正离子的产生及稳定性比较

