氯霉素降解菌Pseudoxanthomonas mexicana CC18的筛选、鉴定和降解特性
陈 田, 周 佳, 汪依萍, 耿宁雨, 屈建航, 赵 帅, 谷 燮
(河南工业大学生物工程学院, 郑州 450000)
氯霉素是一种具有旋光活性的酰胺醇类广谱抗生素,可以有效抑制革兰氏阳性菌和阴性菌[1],因其抗菌能力高效和价格低廉等特点而被广泛用于家禽和牲畜的疾病预防和治疗等[2]。但是,残留的氯霉素会随着畜禽粪便的排放进入环境中,对人体的造血系统和消化系统造成严重的毒性反应[3],具有潜在的致癌性和遗传毒性[4],威胁人类健康。抗生素废水的无效处理导致抗生素抗性细菌的增殖和抗生素抗性基因的传播,威胁人类健康和生态安全[5]。因此,如何处理环境中残留的氯霉素,已成为当下亟待解决的环境问题之一[6]。目前,国内外主要采用物理法和化学法,如萃取法、氧化法、还原法等去除水体中的氯霉素[7-9],但采用单一的物理或化学法难以将性质稳定的氯霉素完全去除。生物法对环境的干扰较少,具有高效、运行成本低、环境友好等优势,是一种具有广阔应用前景的氯霉素降解方法[10]。
生物法主要利用微生物的代谢活动降解氯霉素,因此,高效氯霉素降解菌的获得成了关键[11]。赵梦君[12]从安徽某制药厂排水口污泥中分离筛选到一株氯霉素高效降解菌株LMS-CY,能以氯霉素为唯一碳源生长,且其降解氯霉素的速率与菌体接种量呈正相关。史可等[13]从长期受抗生素毒性选择的活性污泥中分离培养了一株氯霉素高效降解细菌CAP-2,24 h后对50 mg/L氯霉素降解率为36.3%。这些菌株为生物降解氯霉素提供了必要的前提条件,但是目前关于氯霉素降解的菌株资源仍十分稀缺[14]。因此,本研究从处理氯霉素废水的生物接触氧化反应器内活性污泥中筛选到1株氯霉素降解菌CC18,对该菌株的生理生化特征、系统发育类型、生长与降解特性进行研究,以期为生物降解氯霉素提供微生物资源。
1 材料与方法
1.1 材料
1.1.1 样品来源
处理氯霉素废水的生物接触氧化反应器内的活性污泥。
1.1.2 培养基
牛肉膏蛋白胨培养基:牛肉膏3 g/L,蛋白胨5 g/L,NaCl 2.5 g/L,琼脂7.5 g/L,H2O 1 L,pH值为7.0,121 ℃灭菌20 min。
氯霉素培养基:氯霉素10 mg/L(根据具体试验调整),无水乙酸钠1.154 g/L,葡萄糖0.281 g/L,NH4Cl 0.229 g/L,K2HPO40.067 g/L,MgSO4·7H2O 0.049 g/L,CaCl20.023 g/L,1 mL/L微量元素(0.03 g/L CuSO4·5H2O,1.5 g/L FeCl3·6H2O,0.03 g/L KI,0.15 g/L H3BO3,0.12 g/L MnCl4·H2O,0.12 g/L ZnSO4·7H2O,0.06 g/L NaMoO4·2H2O,0.15 g/L CoCl2·6H2O),H2O 1 L,pH值为7.5,115 ℃灭菌20 min。
1.1.3 仪器
岛津LC-2030C-1260型高效液相色谱仪;INSPECT S50型扫描电镜(美国FEI)。
1.2 方法
1.2.1 CC18的分离与筛选
称取1 g活性污泥于9 mL的无菌水中,依次梯度稀释成10-1~10-9的菌悬液。分别吸取不同浓度的菌悬液0.2 mL涂布于牛肉膏蛋白胨固体培养基上(每组3个平行),在28 ℃条件下培养2~3 d。观察菌落的生长情况,菌落大小合适时利用三区划线法进行纯化,直至出现单菌落,命名为CC18。
1.2.2 CC18的鉴定
使用碱裂解法提取CC18的DNA,采用细菌通用引物27F/1492R进行PCR扩增。PCR扩增反应体系25 μL:模版 DNA 1.5 μL,通用引物 27F 和 1429R各 0.5 μL,2×TaqMaster Mix 12.5 μL,ddH2O 10 μL。PCR反应条件:94 ℃预变性 3 min;94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸2 min,共30个循环;最后72 ℃再延伸10 min。将PCR产物送至生工生物工程(上海)股份有限公司进行测序,并在NCBI与已有序列进行 Blast 比对,选取相似度高的序列,利用MEGA 11软件构建CC18系统发育树。
1.2.3 CC18的生理生化特性
分别采用革兰氏染色试验、氧化酶试验、淀粉水解试验、甲基红试验、荧光色素试验、耐盐性试验、硝酸盐还原试验分析菌株CC18主要的生理生化特征[12],并进行扫描电镜[15]观察。
1.2.4 CC18的生长曲线
将新鲜的CC18接种至100 mL牛肉膏蛋白胨液体培养基中,置于28 ℃、150 r/min的恒温摇床培养,每隔4 h测量一次OD600值。
1.2.5 CC18的生长与降解特性
挑取适量新鲜CC18菌落接种于牛肉膏蛋白胨液体培养基中,置于28 ℃、150 r/min的恒温摇床培养24 h,使用无菌水将其OD600值调整至1,接入到氯霉素培养基中,置于28 ℃、150 r/min的恒温摇床中振荡培养。分别以氯霉素质量浓度(10、20、30、40、50 mg/L)、接种量(2%、4%、6%、8%、10%)、氯霉素培养基的pH值(5、6、7、8、9)、培养温度(22、28、32、37 ℃)为研究对象,考察其对CC18降解氯霉素的影响。每个处理组设3个重复样,并设空白对照。培养24 h后取样,以8 000 r/min转速离心10 min后,用0.22 μm的滤膜抽滤两次,利用高效液相色谱法测定上清液中的氯霉素浓度。
1.2.6 高效液相色谱法测定氯霉素含量
用高效液相色谱仪测定氯霉素浓度,色谱柱为Agilent ZORBAX SB-C18(150 mm×4.6 mm,5 μm),流动相为甲醇∶水=65∶35,流速1 mL/min,采用等梯度洗脱,柱温为30 ℃,进样量为10 μL,紫外检测器检测波长为278 nm。
1.2.7 响应面法验证多因素作用下降解菌CC18的最佳降解条件
根据上述试验的结果,利用SPSS软件对上述4个因素进行显著性分析,选取对CC18降解氯霉素影响最显著的3个因素,以氯霉素降解率为响应值,应用Design-Expert 12软件进行分析,利用Box-Behnken设计3因素3水平试验,如表1。
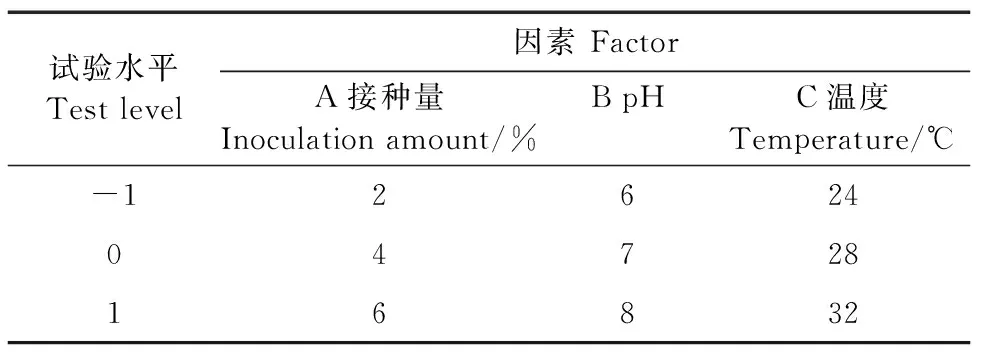
表1 因素与水平表Table 1 Factor and level table
2 结果与分析
2.1 CC18的形态特征和生理生化特性
从处理氯霉素废水的生物接触氧化反应器内活性污泥中分离筛选到的降解菌CC18的菌落呈圆形,浅黄色,边缘整齐,中部凸起,较湿润,半透明,易挑取,其菌体呈杆状(图1)。CC18为革兰氏阴性菌,氧化酶试验阳性,接触酶试验阳性,甲基红试验阴性,淀粉水解试验阴性,荧光色素试验阴性,可耐受5%的NaCl,硝酸盐还原试验阳性。
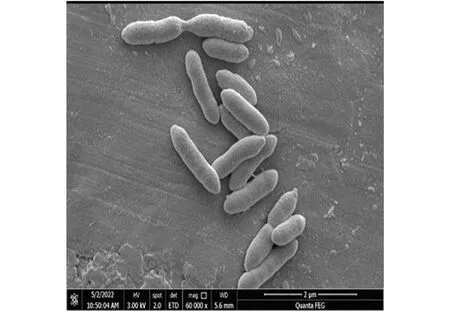
图1 CC18菌体形态电镜图Figure 1 Electronmicrograph of strain CC18
2.2 CC18的系统发育分析
经PCR扩增后,CC18的序列长度为1 445 bp,在NCBI中进行Blast比对,菌株CC18与墨西哥假黄单胞菌Pseudoxanthomonasmexicana(AF273082)的同源性最高,为99.79%(图2)。结合其形态观察和生理生化鉴定结果,参考《伯杰氏细菌鉴定手册》,初步鉴定菌株CC18为墨西哥假黄单胞菌。
2.3 CC18的生长和降解特性
CC18的生长曲线如图3所示,该菌在牛肉膏蛋白胨液体培养基中生长约12 h后进入对数生长期,约52 h后到达稳定期,约72 h后进入衰退期。

图3 CC18生长曲线Figure 3 Growth curve of CC18
2.3.1 氯霉素质量浓度对氯霉素降解率的影响
图4为CC18在不同氯霉素质量浓度下的降解率和生长情况,当氯霉素质量浓度为20 mg/L时,其降解效果最佳,为9.2%。当氯霉素质量浓度在10~20 mg/L时,该菌生长情况较好。因此,CC18生长和降解氯霉素的最佳质量浓度为20 mg/L。

图4 不同氯霉素质量浓度下CC18对氯霉素的降解效果(a)和生长情况(b)Figure 4 Effect of different chloramphenicol mass concentrations on the degradation efficiency (a) and growth (b) of CC18
2.3.2 接种量对氯霉素降解率的影响
图5为不同接种量下CC18对氯霉素的去除效果和生长情况。当接种量为4%时,该菌对20 mg/L氯霉素的降解效果最佳,去除率为15.5%。
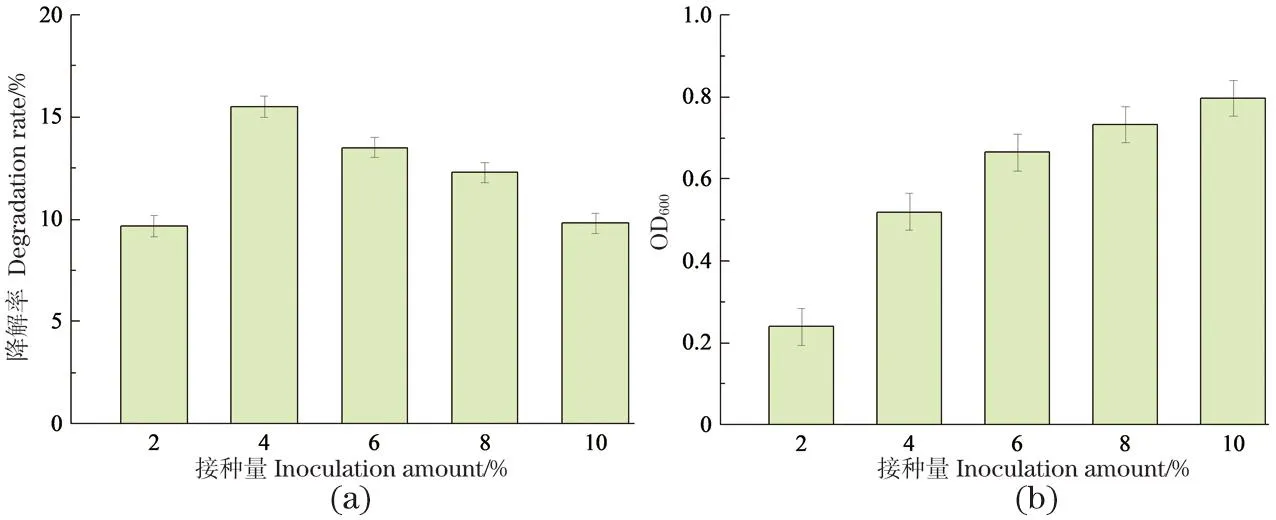
图5 不同接种量下CC18对氯霉素的降解效果(a)和生长情况(b)Figure 5 Effect of different inoculations on the degradation efficiency (a) and growth (b) of CC18
2.3.3 pH值对氯霉素降解率的影响
图6为CC18的接种量为4%,不同pH值下其对20 mg/L氯霉素的降解效果和生长情况。当pH值为7时,该菌对氯霉素的降解效果和生长情况均最佳。因此,CC18生长和降解氯霉素的最佳pH值为7。

图6 不同pH值下CC18对氯霉素的降解率(a)和生长情况(b)Figure 6 Effect of different pH values on the degradation efficiency(a) and growth (b) of CC18
2.3.4 温度对氯霉素降解率的影响
图7为CC18的接种量为4%,培养基的pH值为7,不同培养温度下CC18对20 mg/L氯霉素的降解率。当温度为28 ℃时,该菌的生长情况和对氯霉素的降解效果最佳,去除率为22.9%。因此,CC18生长和降解氯霉素的最佳温度为28 ℃。
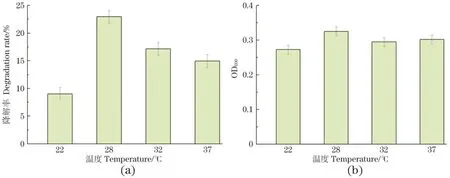
图7 不同培养温度下CC18对氯霉素的降解率(a)和生长情况(b)Figure 7 Effect of different temperatures on the degradation efficiency (a) and growth (b) of CC18
2.4 响应面法优化CC18降解氯霉素的效果
2.4.1 回归方程拟合及方差分析
采用 Design-Expert 12 软件对所得数据进行二次回归分析,回归模型方差分析结果见表2,对各因素回归拟合后,得到二次回归方程如下:
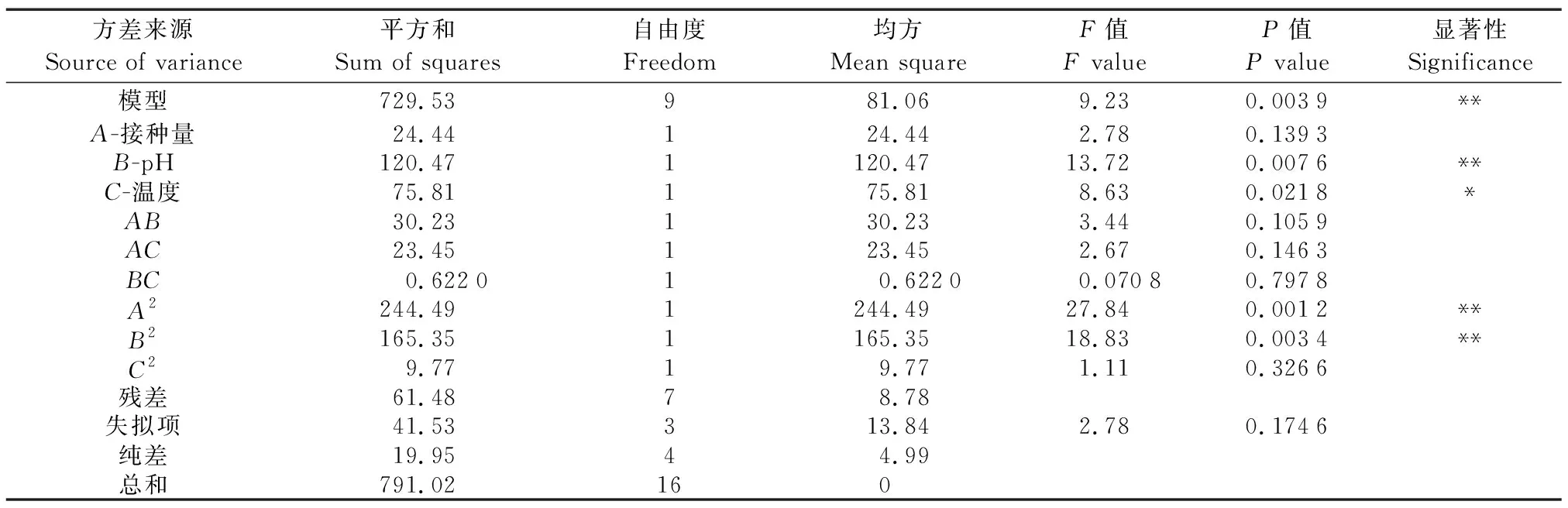
表2 回归模型方差分析Table 2 Analysis of variance of regression model
Y=26.27-1.75A+3.88B+3.08C-2.75AB-2.42AC+0.394 4BC-7.62A2-6.27B2-1.52C2,R2=0.922 3,由方差分析回归方程模型高度显著(P<0.01),失拟项的P=0.174 6>0.05,失拟项差异不显著,一次项、平方项均对响应值有显著性影响,因此,模型选择正确。根据F值可以判断3种影响因素的强弱,依次是B>C>A。其中,一次项B,二次项A2和B2的P<0.01,达到高度显著水平;一次项C的P<0.05,达到显著水平。
2.4.2 响应曲面和等高线
接种量、pH值和温度这3个因素交互作用对CC18降解氯霉素效果的影响见图8~图10。结果表明:在一定温度条件下,随着接种量不断提高,CC18降解氯霉素的效率呈先升高后降低的趋势;接种量与pH值对CC18降解氯霉素效率具有较大的影响,呈抛物线式的变化;在温度一定的情况下,随着pH值的增加,CC18降解氯霉素的效率呈先升高后降低的趋势。

图8 接种量与温度对氯霉素降解率的三维曲面图(a)与等高线图(b)Figure 8 Three dimensional curved surface diagram (a) and contour diagram (b) of the effect of inoculation amount and temperature on the degradation rate of chloramphenicol
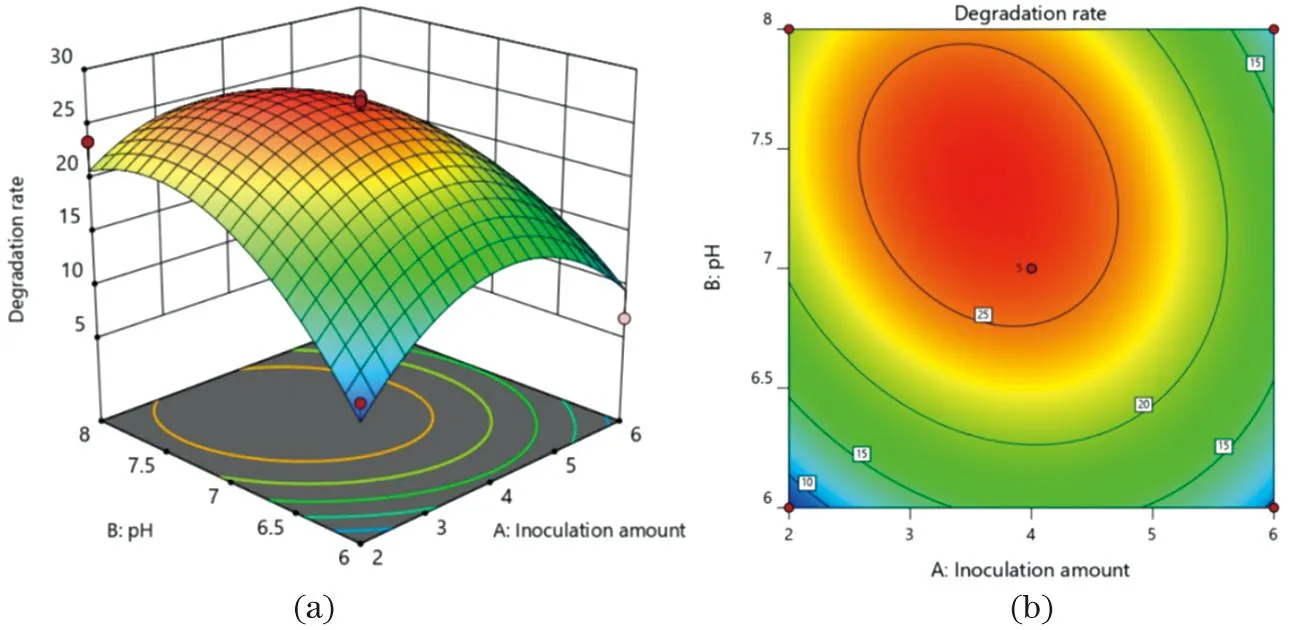
图9 接种量与pH值对氯霉素降解率的三维曲面图(a)与等高线图(b)Figure 9 Three dimensional curved surface diagram (a) and contour diagram (b) of inoculation amount and pH value on chloramphenicol degradation rate

图10 温度与pH值对氯霉素降解率的三维曲面图(a)与等高线图(b)Figure 10 Three dimensional curved surface diagram (a) and contour diagram (b) of temperature and pH value on chloramphenicol degradation rate
2.4.3 验证试验
根据 Design-Expert 12 软件的分析结果,得到CC18降解20 mg/L氯霉素的最优条件:接种量3.6%,pH 7.6,温度30 ℃,理论降解率28.2%。经试验验证后,其实际降解率为30.6%。与理论值接近,表明该模型能很好地优化CC18降解氯霉素的条件。
3 讨论
尽管抗生素的抑菌作用会增加生物处理的难度,然而生物强化因其经济、高效、环保等优势逐渐成为治理环境中抗生素污染的重要手段之一。目前,已有一些能够降解氯霉素的微生物(表3)。如从鱼塘沉积物中驯化、筛选出氯霉素降解菌PseudomonasmigulaCSFO-3,7 d时对100 mg/L氯霉素的降解率为29.0%[16];从被氯霉素污染的南明河水中筛选到 2 株氯霉素降解菌:嗜水气单胞菌(Aeromonashydrophila)和恶臭假单胞菌(Pseudomonasputida),14 d时恶臭假单胞菌(Pseudomonasputida)对50 μg/L氯霉素去除率为89.5%,而嗜水气单胞菌(Aeromonashydrophila)对50 μg/L氯霉素去除率仅为13.8%;从水产养殖池塘沉积物中分离出的铜绿假单胞菌,7 d时对60 mg/L氯霉素的降解率为29.0%[17]。本研究从处理氯霉素废水的生物接触氧化反应器内活性污泥中筛选到的墨西哥假单胞菌PseudoxanthomonasmexicanaCC18,1 d时对20 mg/L氯霉素去除率为30.6%。这些氯霉素的降解菌大多归属于假单胞菌属,但是墨西哥假单胞菌在氯霉素降解中的作用尚未见报道。
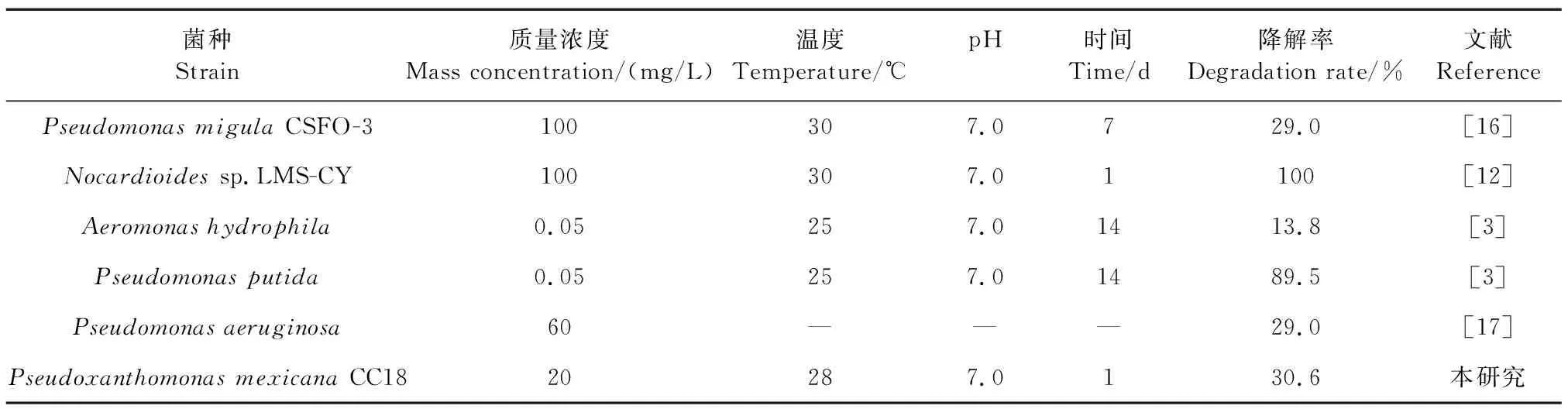
表3 部分氯霉素降解菌的降解效果Table 3 The degradation effect of some chloramphenicol degrading bacteria
虽然本研究筛选的墨西哥假单胞菌CC18对氯霉素的降解效果不如已报道的菌株LMS-CY[12]和CSFO-3[16],这可能与菌属、筛选条件和实验方法等因素有关,但是墨西哥假单胞菌CC18对20 mg/L氯霉素的降解速度较快,24 h能达到30.6%的降解率,明显短于嗜水气单胞菌和恶臭假单胞菌所需的14 d。Lin等[18]从活性污泥中分离出的假单胞菌CE21和CE22,24 h时CE21对100 mg/L头孢氨苄的降解率为46.7%,而假单胞菌CE22的降解率高达90%,进一步表明假单胞菌属在抗生素的降解方面具有重要作用。综上所述,这些氯霉素降解菌为解决氯霉素滥用后污染水体的生物处理提供了菌种基础,但氯霉素的降解机制以及实际应用等方面仍需要大量研究。本研究首次发现墨西哥假单胞菌CC18具有降解氯霉素的作用,有望制备成微生物菌剂应用于氯霉素污染水体的生物修复[19],不仅可有效减少环境中残留的氯霉素,也为污染水体的环境生物治理打下基础,具有很大的潜在应用价值[20]。
4 结论
本研究从处理氯霉素废水的生物接触氧化反应器内活性污泥中分离出一株氯霉素降解菌CC18,结合其形态观察、生理生化特性和16S rRNA基因序列分析,CC18归属于墨西哥假单胞菌(Pseudoxanthomonasmexicana)。当其接种量为4%,pH值为7,温度为28 ℃时,24 h该菌株对20 mg/L氯霉素的降解率为22.9%。通过响应面试验进一步优化,当接种量3.6%,pH值为7.6,温度30 ℃时,24 h时其对20 mg/L氯霉素的降解率为30.6%。本研究首次发现墨西哥假单胞菌属具有降解氯霉素的功能,不仅丰富了氯霉素降解微生物菌种库,也为微生物治理复杂环境的抗生素污染提供更多选择。

